ポイント
- CD11c+骨髄系免疫細胞における鉄の過剰蓄積が、アセトアミノフェン誘導性肝障害を著しく悪化させることを明らかにしました。
- 鉄代謝制御酵素FBXL5をCD11c+細胞で欠損させたマウスモデルを用い、免疫応答や肝傷害の変化を詳細に解析しました。
- 鉄過剰によりIL-6の産生が亢進し、好中球の肝臓への浸潤を促進することで炎症と組織障害が増悪する新たな病態機構を解明しました。
- 免疫細胞内の鉄の代謝を標的とすることで、薬剤性肝障害を含む炎症性疾患に対する新たな治療戦略となる可能性を示しました。
概要
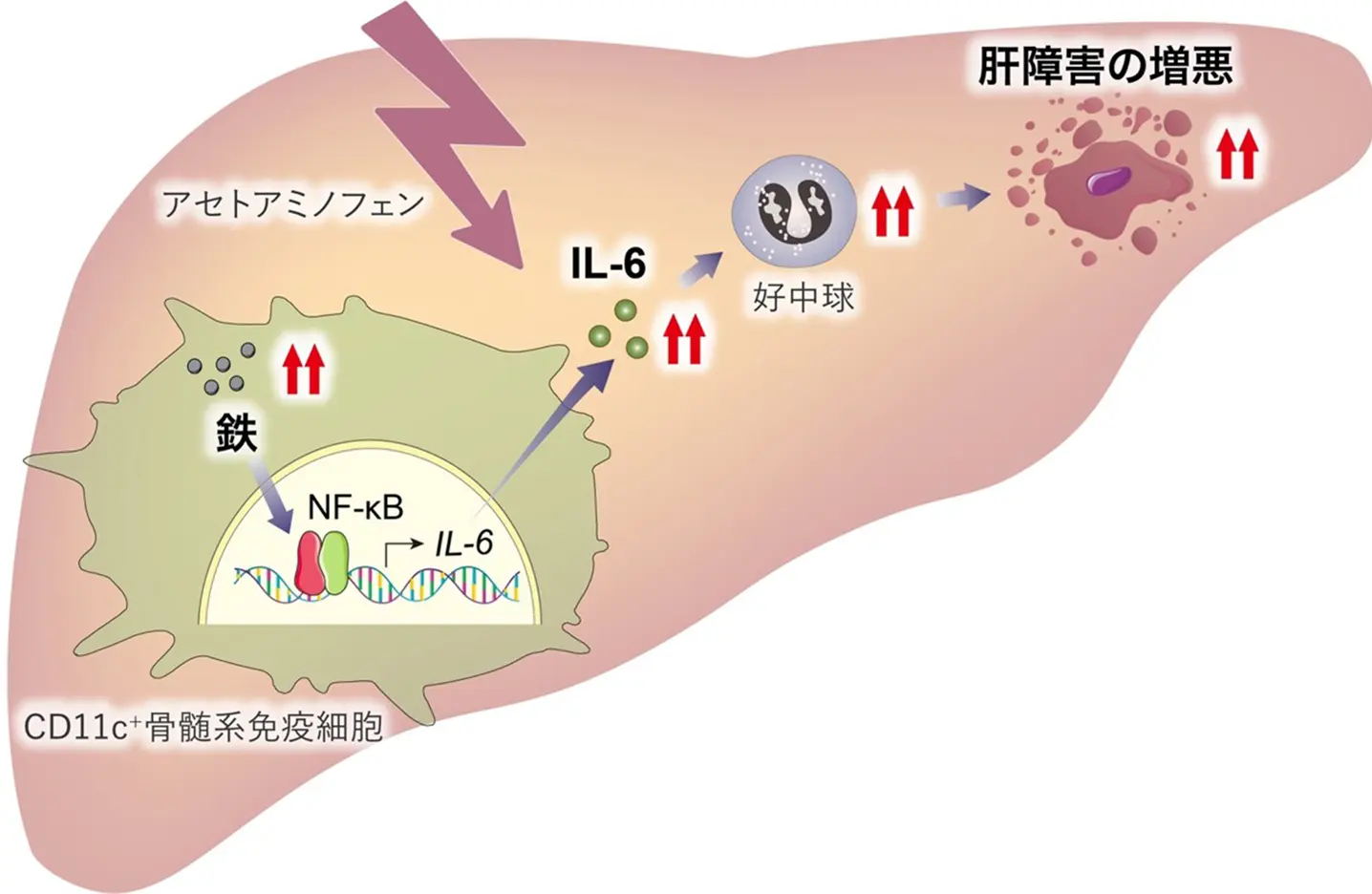
東京科学大学(Science Tokyo)総合研究院 難治疾患研究所 細胞動態学分野の諸石寿朗教授、熊本大学 分子薬理学講座 金森耀平助教、刘赛赛博士課程学生らの研究チームは、CD11c+[用語1]骨髄系免疫細胞における鉄の過剰が、アセトアミノフェン[用語2]による急性肝障害を悪化させることを明らかにしました。
本研究では、細胞の鉄調節に重要な役割を果たす遺伝子FBXL5[用語3]を、CD11c+骨髄系免疫細胞に特異的に欠損させたマウスを作製し、鉄過剰状態にある免疫細胞が肝障害の病態進行に及ぼす影響を解析しました。その結果、FBXL5欠損マウスでは炎症性サイトカインIL-6[用語4]の発現が著しく上昇し、好中球[用語5]の肝内への浸潤が顕著に認められました。これに伴い、肝炎症状が悪化し、死亡率も増加しました。さらに、IL-6中和抗体を投与することで肝障害の軽減が確認され、IL-6が病態悪化において重要な役割を果たすことが示されました。
アセトアミノフェン中毒による急性肝障害は、進行すると命に関わる肝不全を引き起こすことがあります。これまで免疫細胞の関与は知られていたものの、鉄代謝がその機能に与える影響については十分に明らかにされていませんでした。本研究は、鉄が免疫応答を促進し、炎症を悪化させる仕組みを解明したものです。今後は、免疫細胞内の鉄制御を標的とした新たな肝保護療法の開発が期待されます。
本成果は、東京科学大学 制がんストラテジー研究室との共同研究によって得られ、10月21日(現地時間)付で「Communications Biology」誌に掲載されました。
背景
急性肝障害は、薬剤、ウイルス、自己免疫などさまざまな原因によって発症し、重症化すると肝不全に至る深刻な疾患です。中でも、解熱鎮痛薬として広く使用されているアセトアミノフェンの過剰摂取は、急性肝障害の主な原因のひとつとされており[参考文献1]、早期の炎症抑制と組織修復が予後の改善において重要な鍵となります。
近年、肝障害の発症や進展には免疫系が深く関与していることが報告されており[参考文献2]、特に好中球、マクロファージ、樹状細胞などの骨髄系免疫細胞が重要な役割を果たすことが明らかになってきました。
CD11cは従来、樹状細胞のマーカーとされてきましたが、炎症下では一部のマクロファージでもこのマーカーが発現します。これらのCD11c+骨髄系細胞は、肝臓における免疫応答の制御に関与し、組織損傷を抑える保護的な働きを持つことも報告されています。一方で、これらの細胞がどのように活性化され、炎症を助長する方向へと機能が変化するのか、その詳細は明らかにされていませんでした。
また近年では、免疫細胞の代謝状態がその機能に大きく影響することが注目されていますが[参考文献3]、CD11c+細胞における鉄代謝の役割やその影響については、いまだ十分に理解されていませんでした。
本研究では、この課題に着目し、鉄代謝制御因子FBXL5を用いてCD11c+細胞内の鉄恒常性を人為的に乱し、その影響を解析しました。
研究成果
研究チームはまず、鉄センサーとして知られるFBXL5をCD11c+細胞に特異的に欠損させたマウスを作製し、アセトアミノフェン誘導性肝障害モデルにおける病態の変化を解析しました。このマウスでは、血中ALT(アラニンアミノトランスフェラーゼ)[用語6]値の上昇、組織学的な肝障害の進行、さらに高用量アセトアミノフェン投与後の生存率の低下といった重篤な肝障害が認められました。これは、CD11c+細胞におけるFBXL5欠損により鉄が過剰に蓄積し、炎症反応が促進された結果と考えられます。
さらに、組織内の免疫細胞浸潤を詳細に解析したところ、特に好中球の肝内浸潤がFBXL5欠損マウスで有意に増加しており、炎症の増悪および組織傷害への関与が示唆されました。遺伝子発現解析においても、FBXL5欠損マウスではIL-6などの炎症関連遺伝子の発現が著しく上昇していることが確認され、加えて血中IL-6濃度の上昇も観察されました。これにより、IL-6が好中球の動員を引き起こしている可能性が示されました。
次に、IL-6の役割を直接検証するため、中和抗体を用いてIL-6を抑制したところ、FBXL5欠損マウスにおいて血中ALTの低下、組織損傷の軽減、好中球浸潤の抑制といった改善効果が確認されました。これは、鉄過剰によってCD11c+細胞内でIL-6産生が誘導され、それが好中球浸潤と肝障害の悪化を引き起こしているという因果関係を支持する結果です。
さらに、分子メカニズムの解析により、鉄過剰がIL-6発現を促進する過程において、炎症刺激後に転写因子NF-κB[用語7]がIL-6の遺伝子発現調節領域により強く結合することが明らかになりました。
以上の結果から、CD11c+骨髄系細胞における鉄代謝の破綻が、IL-6発現と好中球動員を介して急性肝障害を悪化させることが示されました。
社会的インパクト
急性肝障害は、日常的に使用される薬剤が原因となって発症することもある身近な疾患であり、重症化すると命に関わる肝不全へと進行するため、社会的にも大きな関心が寄せられています。なかでも、アセトアミノフェンによる肝障害は、過剰摂取や代謝異常によって突発的に発症し、迅速な対応と治療が求められます。
本研究は、免疫細胞内の鉄過剰が炎症反応を増悪させるという新たな病態メカニズムを明らかにしたものであり、これは肝疾患にとどまらず、自己免疫疾患や感染症、がんなど、炎症を伴うさまざまな疾患への応用可能性を示唆しています。
特に、臨床的にもよく知られている炎症性サイトカインIL-6の関与を明確に示したことは、既存の抗IL-6療法との親和性も期待され、臨床応用への橋渡しとなる可能性があります。また、鉄代謝を標的とすることで免疫細胞の炎症状態を制御できる可能性は、薬剤性肝障害をはじめとした炎症性疾患に対する新たな治療法の開発へとつながることが期待されます。
今後の展開
今後の研究では、本研究で示されたCD11c+細胞における鉄の役割を、さらに精緻に解明する必要があります。特に、CD11c+細胞には複数のサブセットが存在することから、単一細胞解析や系譜追跡法を用いて、それぞれの細胞種がどのように病態に関与しているのかを明らかにすることが重要です。
また、鉄がNF-κBの転写活性を高めるという転写制御メカニズムについても、クロマチン構造やヒストン修飾などのエピジェネティック制御が関与している可能性があり、これらの点についても検討を進めていく必要があります。こうした解析により、より精密な制御機構を明らかにし、病態の解明や新たな薬剤開発への応用が期待されます。
さらに、肝臓以外の臓器においても鉄代謝が炎症制御に関与している可能性があるため、本研究の成果を他の臓器炎症モデルや慢性炎症性疾患に拡張することで、より包括的な治療戦略の提案につながると考えています。
付記
本研究成果は日本学術振興会(23K18098, 24H00864, 24H00865, 22K15396, 24K10094)、科学技術振興機構(JPMJFR226J)、加藤記念バイオサイエンス振興財団の支援を受けて実施したものです。
参考文献
用語説明
- [用語1]
- CD11c:主に樹状細胞や一部のマクロファージなど、骨髄系免疫細胞に発現する分子で、免疫応答において司令塔のような役割を果たす。
- [用語2]
- アセトアミノフェン:解熱鎮痛薬。過剰に摂取すると肝障害を引き起こす可能性がある。
- [用語3]
- FBXL5:細胞内の鉄濃度を感知し、過剰な鉄の蓄積を防ぐ働きを持つ酵素。この酵素が機能しないと、細胞内に鉄が過剰に蓄積する。
- [用語4]
- IL-6:炎症時に産生されるサイトカインで、好中球の動員や免疫応答の悪化に関与する。
- [用語5]
- 好中球:感染や炎症部位に素早く集まり、病原体や壊死組織の除去する免疫細胞。過剰に活性化されたり、炎症部位に過剰に集積したりすると、炎症の悪化や組織障害を引き起こす可能性がある。
- [用語6]
- ALT(アラニンアミノトランスフェラーゼ):肝臓が障害を受けた際に血中で増加する酵素で、肝機能を評価する代表的な血液検査項目。
- [用語7]
- NF-κB:炎症性遺伝子の発現を調節する転写因子で、免疫応答において中心的な役割を担う。
論文情報
- 掲載誌:
- Communications Biology
- タイトル:
- Iron overload in CD11c+ myeloid cells exacerbates acetaminophen hepatotoxicity
- 著者:
- Saisai Liu, Yohei Kanamori, Yudai Ohta, Shuran Li, Yanliang Liu, Hao Li, Mohamed Fathi Saleh, Akihiro Nita, Keiichi I. Nakayama, Toshiro Moroishi
研究者プロフィール
諸石 寿朗 Toshiro Moroishi
東京科学大学 総合研究院 難治疾患研究所 細胞動態学分野 教授
研究分野:分子生物学、細胞生物学
金森 耀平 Yohei Kanamori
熊本大学 大学院生命科学研究部 分子薬理学講座 助教
研究分野:栄養学、病態医化学
関連リンク
東京科学大学 総務企画部 広報課
- Tel
- 03-5734-2975
- Fax
- 03-5734-3661
- media@adm.isct.ac.jp