ポイント
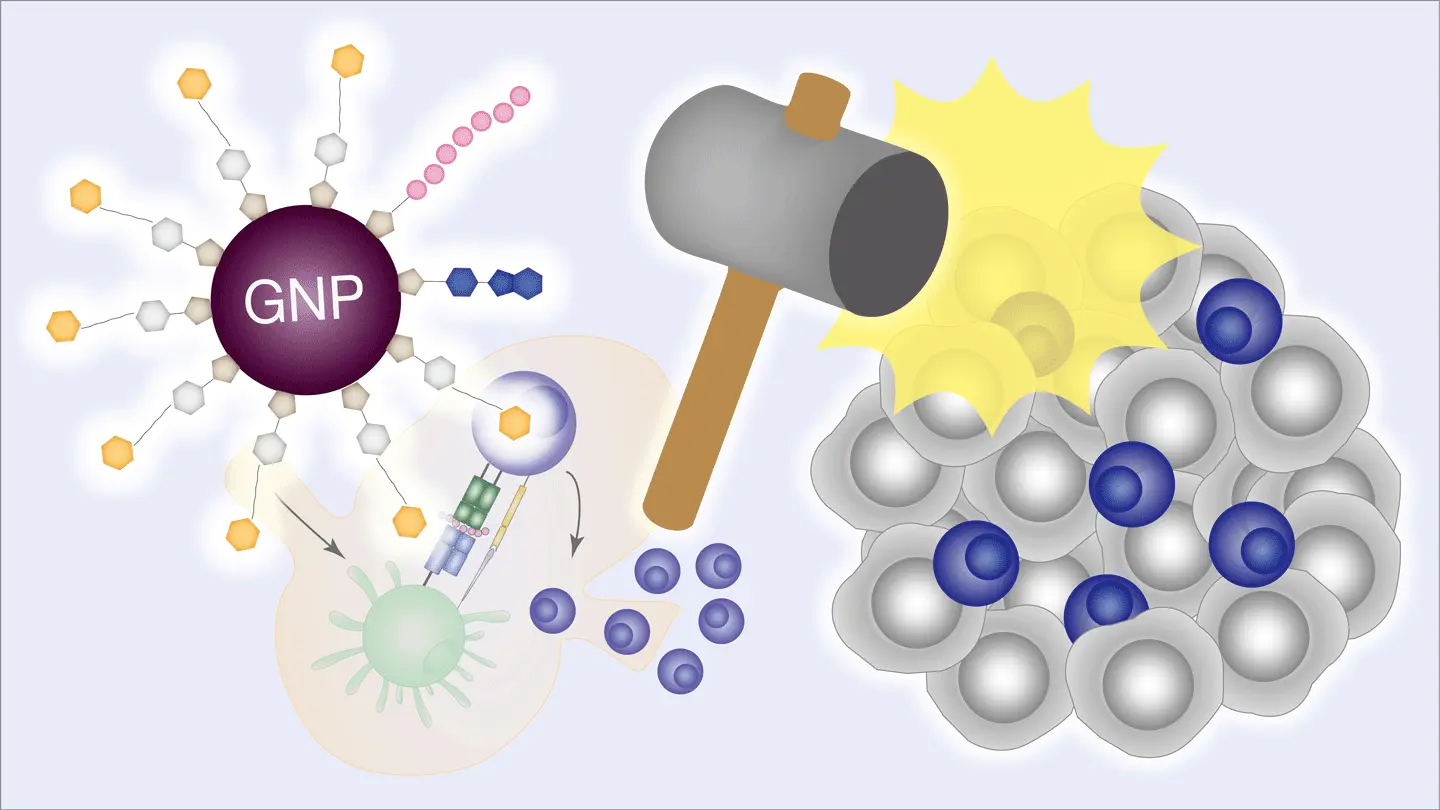
- 抗原・免疫刺激分子・糖鎖を一体化させた新しい「統合型グリコ・ナノワクチン(iGN)」を開発。
- 金ナノ粒子上に複数の要素を配置することで、マウスモデルで効率的にがん免疫を活性化。
- T細胞によるがん細胞攻撃を誘導し、免疫チェックポイント阻害薬との併用でさらなる効果が期待される。
概要
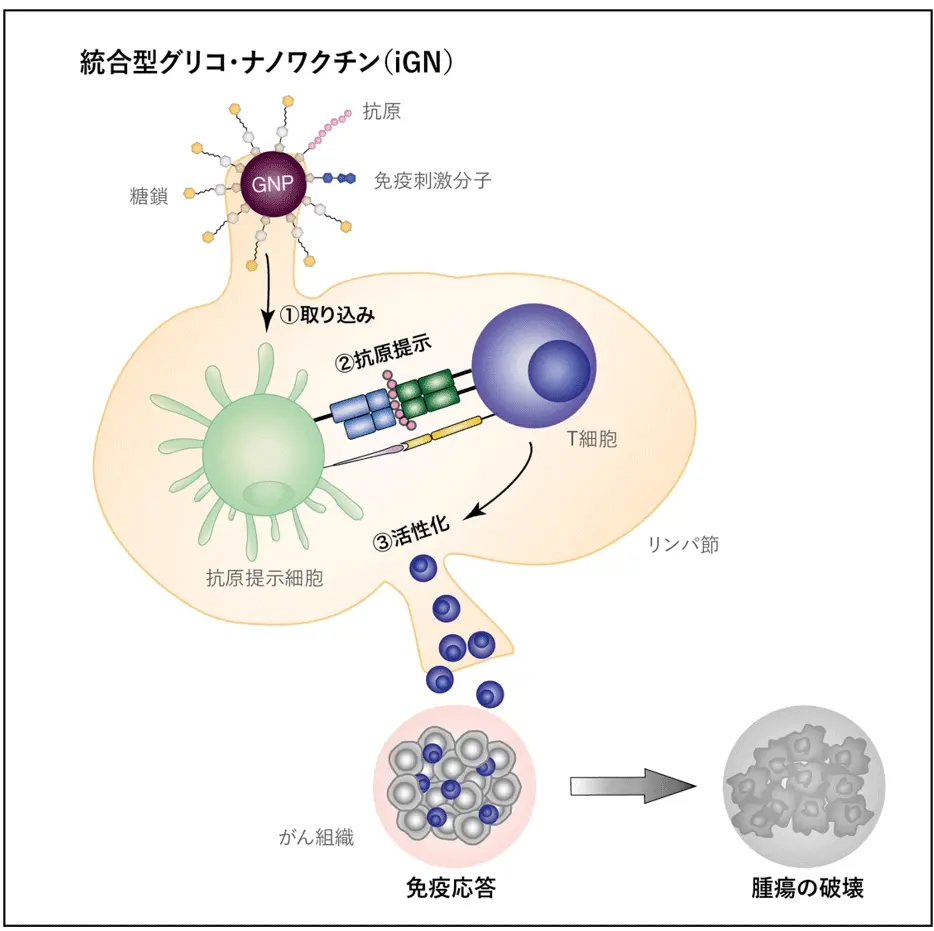
東京科学大学(Science Tokyo)総合研究院 難治疾患研究所 細胞動態学分野の諸石寿朗教授、鹿児島大学 大学院理工学研究科の新地浩之研究准教授、熊本大学 大学院生命科学研究部 分子薬理学講座の新村麻由美研究員(研究当時、現・株式会社ワールドインテックR&D事業部)らの研究チームは、抗原[用語1]・免疫刺激分子(アジュバント[用語2])・糖鎖[用語3]を統合的に配置した新しい「統合型グリコ・ナノワクチン(iGN; integrated glyco-nanovaccine)」を開発しました。従来のがんワクチンは効果が限定的でしたが、iGNは抗原提示細胞[用語4]を強力に活性化し、T細胞[用語5]によるがん細胞への攻撃を促進することで、マウスモデルにおいて腫瘍を破壊できることを確認しました。さらに、免疫チェックポイント阻害薬[用語6]との併用によって治療効果が増強されることも明らかになりました。本成果は、がん免疫療法[用語7]をより幅広い患者に適用できる可能性を拓く重要な一歩です。
近年、免疫チェックポイント阻害薬を中心としたがん免疫療法は注目を集めていますが、依然として効果が得られない患者も多数存在することが課題となっています。がんの種類によっては「免疫が効きにくい状態(冷たい腫瘍)」が存在するため、免疫を呼び覚ます新たな治療戦略の開発が求められてきました。本研究で開発されたiGNは、こうした免疫不応答の壁を突破する可能性を秘めています。今後は、より多様ながん種を対象とした効果検証や臨床応用を進め、患者一人ひとりに適した免疫治療の実現につなげていくことが期待されます。
本成果は、カリフォルニア大学サンディエゴ校 医学部、鹿児島大学 大学院理工学研究科、熊本大学 免疫学講座との共同研究によって得られ、8月29日付で「Communications Medicine」誌に掲載されました。
背景
がんは日本人の死因の第1位を占める重大な疾患であり、その新規治療法の開発は世界的に喫緊の課題となっています。従来のがん治療は外科的切除、放射線治療、化学療法が中心でしたが、強い副作用や再発・転移のリスクといった問題が残されてきました。これに対して、患者自身の免疫システムを活性化し腫瘍を排除する「がん免疫療法」は、新たな治療戦略として近年大きな注目を集めています。特に免疫チェックポイント阻害薬は一部の患者で劇的な臨床効果を示しましたが、依然として奏効しない症例が多数存在することが大きな課題とされています[参考文献1]。
なぜ多くの患者で治療効果が限定的なのか。その主要因の1つは、腫瘍組織が「冷たい腫瘍(cold tumor)」と呼ばれる免疫不応答状態にあるためと考えられています。このような腫瘍では免疫細胞の浸潤が乏しいうえ、がん特異的T細胞の誘導に必須となる抗原提示が十分に行われないため、免疫療法の効果が発揮されにくいと考えられます。したがって、腫瘍微小環境[用語8]を「熱い腫瘍(hot tumor)」へと変換し、免疫細胞を効率的に呼び込み、腫瘍特異的T細胞応答を誘導する新たな治療アプローチの開発が求められています[参考文献2]。
がんワクチンはその有力な候補の1つですが、従来型ワクチンは抗原や免疫刺激分子の送達効率が低く、抗原提示細胞を十分に活性化できないため、期待されたほどの治療効果を発揮できませんでした。そこで本研究チームは糖鎖の機能に着目しました。糖鎖は細胞認識や免疫応答の調節に深く関わる分子であり、これを活用することで免疫細胞のターゲティングや活性化を効率的に行える可能性があると考えられました。
以上の背景を踏まえ、本研究では抗原・免疫刺激分子・糖鎖を一体化した「統合型グリコ・ナノワクチン(iGN; integrated glyco-nanovaccine)」を新たに設計し、その免疫賦活効果および抗腫瘍効果を前臨床モデルで検証することを目的としました。
研究成果
研究チームはまず、糖鎖を表面に修飾した金ナノ粒子[参考文献3]に、免疫刺激分子(アジュバント)とがんモデル抗原を組み込み、これらを一体化した「統合型グリコ・ナノワクチン(iGN)」を作製しました。このiGNは、従来の単純な成分混合型ワクチンとは異なり、抗原提示細胞による取り込み効率と抗原特異的T細胞の活性化能力を同時に高めるように設計されています。
実験では、マウスにiGNを投与したところ、強力な免疫活性化が誘導され、抗原特異的T細胞応答が著しく向上しました。さらに、マウス腫瘍モデルにおいては、単独投与でも腫瘍の増殖が抑制されました。また、免疫チェックポイント阻害薬と併用することで、単剤では効果が乏しい腫瘍に対しても強力な抗腫瘍効果が得られました。これにより、治療抵抗性の高い腫瘍においても免疫療法の効果を引き出せる可能性が示されました。
加えて、iGNは比較的安価かつ安定に調製できるため、臨床応用に向けた製造・流通の観点からも利点を有しています。さらに、異なるがん抗原を搭載することで、理論的には多様ながん種に対応可能であり、個別化医療[用語9]への展開も期待されます。
社会的インパクト
今回の研究成果は、がん治療における大きな課題である「免疫療法が奏効しない患者」に対する新たな治療戦略の1つとなることが期待されます。現在、免疫チェックポイント阻害薬の市場規模は急速に拡大していますが、その効果を得られるのは患者全体の一部にとどまっており、依然として多くの患者が治療の恩恵を受けられていません。そのため、より幅広い患者層に有効な免疫療法を開発することは、臨床現場および社会全体から強く求められています。
iGNを用いたがん治療の最大の特徴は、腫瘍微小環境を免疫応答に適した状態へと再構築し、これまで治療抵抗性を示していた腫瘍に対しても治療効果を発揮し得る点にあります。これにより、がん治療成績の改善や患者予後の向上に寄与するだけでなく、治療効果の最適化を通じて医療資源の効率的活用にもつながる可能性があります。さらに、ナノ粒子工学と医学を融合させた本手法は、がん免疫療法にとどまらず、新規感染症ワクチンの開発など、次世代バイオ医薬品の基盤技術としても大きな展開が期待されます。
今後の展開
今後の研究では、まずさまざまながん種に対してiGNの効果を確認することが重要です。特に、免疫チェックポイント阻害薬が効きにくい膵がんや大腸がんなどでの検証が期待されます。また、マウスで得られた成果を人に応用するためには、効果の確認に加えて、安全性や投与方法の検討も必要です。
さらに、iGNは設計を柔軟に変更できるため、患者ごとの腫瘍に合わせてカスタマイズすることが可能です。将来的には、個々の患者に最適化された「オーダーメイド型免疫療法」の開発につながる可能性があります。加えて、ナノ粒子技術と糖鎖科学を組み合わせた本手法は、がんだけでなく、感染症や免疫不全疾患など幅広い治療薬の開発にも応用できると期待されます。
付記
本研究成果は日本医療研究開発機構、科学技術振興機構、日本学術振興会、武田科学振興財団、篷庵社の支援を受けて実施したものです。
参考文献
- [1]
- Hegde, P. S. & Chen, D. S. Top 10 Challenges in Cancer Immunotherapy. Immunity 52, 17-35, doi:10.1016/j.immuni.2019.12.011 (2020).
- [2]
- Irvine, D. J. & Dane, E. L. Enhancing cancer immunotherapy with nanomedicine. Nature Reviews Immunology 20, 321-334, doi:10.1038/s41577-019-0269-6 (2020).
- [3]
- Mateu Ferrando, R., Lay, L. & Polito, L. Gold nanoparticle-based platforms for vaccine development. Drug Discov Today Technol 38, 57-67, doi:10.1016/j.ddtec.2021.02.001 (2020).
用語説明
- [用語1]
- 抗原:免疫系が認識する分子で、T細胞や抗体による免疫反応を誘導する。がんワクチンではがん細胞特有の抗原が用いられる。
- [用語2]
- 免疫刺激分子(アジュバント):ワクチンの効果を高める物質。抗原と一緒に投与することで、免疫細胞の活性化や抗体・T細胞応答を強化する。
- [用語3]
- 糖鎖:糖が連なった分子で、細胞認識や免疫応答の調節に関与。
- [用語4]
- 抗原提示細胞:免疫系の司令塔として働く細胞。抗原をT細胞に提示し、免疫応答を開始させる。代表的な細胞に樹状細胞がある。
- [用語5]
- T細胞:免疫系の重要な細胞で、がん細胞や感染細胞を直接攻撃する。抗原特異的T細胞は、特定の抗原を認識して効率的に攻撃する。
- [用語6]
- 免疫チェックポイント阻害薬:がん細胞が免疫の攻撃を回避する仕組み(チェックポイント)を阻害する薬。これにより、T細胞ががん細胞を攻撃しやすくなる。
- [用語7]
- がん免疫療法:患者自身の免疫システムを活性化してがん細胞を攻撃させる治療法。従来の手術や化学療法に比べ、再発や転移のリスクを減らす可能性がある。免疫チェックポイント阻害薬などが代表例。
- [用語8]
- 腫瘍微小環境:腫瘍を取り囲む細胞や血管、免疫細胞などの環境。腫瘍の増殖や免疫応答に大きく影響する。
- [用語9]
- 個別化医療:患者ごとの遺伝子や腫瘍特性に基づき、最適な治療法を選択する医療アプローチ。
論文情報
- 掲載誌:
- Communications Medicine
- タイトル:
- Harnessing an integrated glyco-nanovaccine technology for enhanced cancer immunotherapy
- 著者:
- Mayumi Niimura, Yasuhisa Sakamoto, Mayuko Shimoda, Narumi Harada, Ayato Maeda, Shiho Wada, Koki Murata, Chanida Thinyakul, Saisai Liu, Haruka Ohara, Asuka Iwamoto, Yohei Kanamori, Akihiro Nita, Masahiro Wakao, Yasuo Suda, Hiroyuki Oshiumi, Tomoko Hayashi, Dennis A. Carson, Hiroyuki Shinchi, Toshiro Moroishi
研究者プロフィール
諸石 寿朗 Toshiro MOROISHI
東京科学大学 総合研究院 難治疾患研究所 細胞動態学分野 教授
研究分野:分子生物学、細胞生物学