ポイント
- 肺がん細胞において、YAP/TAZ活性の異なる細胞同士が“助け合う”ことで、細胞死「フェロトーシス」に対する集団的な抵抗性を獲得することを明らかにした。
- 患者由来の検体とマウスモデルの解析から、GCH1という酵素が抗酸化物質BH4を産生・分泌し、がん細胞間で共有されることで、細胞死を回避する仕組みを示した。
- がん細胞同士の協調によって生じる治療抵抗性という新たな概念を提唱し、がんの多様性に応じた次世代型治療戦略の構築に向けて重要な知見を提供した。
概要
東京科学大学(Science Tokyo) 総合研究院 難治疾患研究所 細胞動態学分野の諸石寿朗教授、および熊本大学 分子薬理学講座の李浩研究員(研究当時、現・関西学院大学助教)らの研究チームは、肺がんにおけるがん細胞の多様性が治療抵抗性に関与する仕組みを、患者検体の解析およびマウスモデルを用いた実験によって解明しました。
研究チームは、がん細胞の増殖や転移に関わる分子であるYAPおよびTAZ[用語1]の活性に着目し、腫瘍内においてこれらの活性が異なる細胞群が共存する場合、患者の予後が悪化することを明らかにしました。さらに、YAP/TAZ活性が低い細胞は、鉄依存的細胞死であるフェロトーシス[用語2]に強い耐性を示すだけでなく、抗酸化物質BH4(テトラヒドロビオプテリン)[用語3]を産生・分泌することによって、隣接するがん細胞も保護していることが判明しました。この防御機構の鍵となる酵素がGCH1(GTPシクロヒドロラーゼ1)[用語4]であり、GCH1を阻害する薬剤とフェロトーシス誘導剤との併用によって、肺がんの治療効果が動物モデルにおいて大きく高まることを確認しました。
これらの成果は、がん細胞間の"助け合い"によって生じる治療抵抗性という新たな概念を提示するとともに、フェロトーシスを標的とした新たながん治療戦略の開発に道を拓くものです。
本成果は、熊本大学 微生物学講座、免疫ゲノム構造学講座、細胞病理学講座、呼吸器外科講座との共同研究によって得られ、7月6日(現地時間)付で「EMBO reports」誌に掲載されました。
背景
私たちの体は、約30兆個を超える膨大な数の細胞から構成されており、これらの細胞は全て、同一の遺伝情報であるDNAを共有しています。しかし、体のさまざまな組織や臓器の役割を担うために、それぞれが異なる性質や機能を獲得し、多様な細胞タイプへと分化しています。この「細胞の多様性」は、私たちの生命活動を正常に維持し、成長や適応、組織の修復など、多くの生理的プロセスに不可欠なものです。
一方で、この多様性はがんにおいては複雑な問題を引き起こします。がん細胞はもともと正常な細胞から発生しますが、遺伝子の変異や周囲の微小環境の影響を受けて、腫瘍内に「サブクローン」と呼ばれる、異なる性質を持つ細胞群を形成します。この腫瘍の異質性[用語5]は、がんの進行や治療効果に大きな影響を与え、がん治療における最大の難題の一つとなっています[参考文献1]。
特に肺がんは、世界中でがんによる死亡原因の上位に位置しており、その治療は依然として困難を極めています。早期発見や標準的な治療を行っても、しばしば再発や遠隔転移を引き起こし、患者の予後に大きく影響します。そのため、肺がんの治療効果を飛躍的に高めるためには、がん細胞の多様性や腫瘍内の複雑な相互作用を理解し、それらを標的とした新たな治療法の開発が急務となっています。
このような背景のもと、本研究では、がん細胞の増殖や悪性化、転移に関わる二つの分子「YAP」と「TAZ」に注目し、がん細胞におけるそれらの異質性が、がんの生存戦略や治療抵抗性にどのように関与しているのかを調べました。
研究成果
研究チームはまず、ヒト肺腺がん患者のサンプルを用いて、YAPおよびTAZ(YAP/TAZ)の活性と患者予後との関係を調べました。従来、がん細胞の増殖や悪性度の高さはYAP/TAZ活性の高さに起因すると考えられており、YAP/TAZ活性の上昇が腫瘍の進行を主導するとされてきました[参考文献2]。しかし今回の解析により、がん組織においてYAP/TAZ活性が不均一な(すなわち、YAP/TAZ活性が高いがん細胞と低いがん細胞が混在する)患者は、活性が均一な患者と比べて、有意に生命予後が悪いことが明らかになりました。
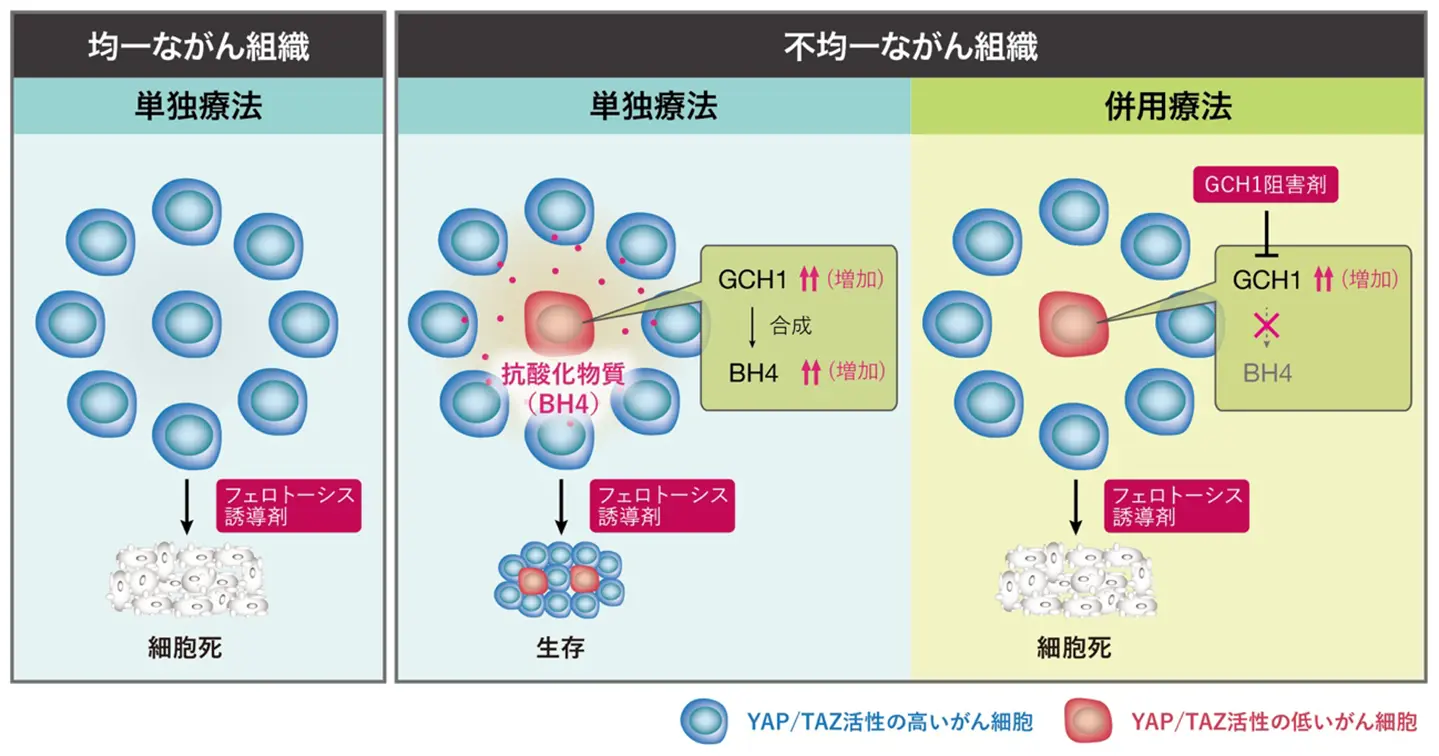
その理由として、YAP/TAZ活性が低い細胞群が、これまであまり注目されてこなかった特殊な細胞死「フェロトーシス」に対して非常に強い耐性を持つことが、細胞を用いた実験により明らかになりました。フェロトーシスとは、細胞内に存在する鉄イオンが細胞膜の酸化を促進し、細胞死を引き起こす新たに発見された細胞死の様式であり、がん細胞を効果的に死滅させる新たな治療標的として注目されています。興味深いことに、YAP/TAZ活性が低い細胞は増殖能力こそ低下しているものの、フェロトーシスに強く抵抗することで腫瘍内での生存競争において重要な役割を果たしていることが判明しました。
この耐性機構の核心には、YAP/TAZ活性の低下によって「GCH1」という酵素の発現が誘導されることがありました。GCH1は、抗酸化物質「BH4」の合成に不可欠な酵素であり、BH4は活性酸素種を除去し、細胞膜の脂質過酸化を防ぐ働きを持っています[参考文献3]。特に、フェロトーシスの誘導に関与する脂質の酸化を抑えることで、細胞を死から守っています。さらに注目すべきことに、このBH4は細胞内だけでなく細胞外にも放出され、隣接するがん細胞にも抗酸化作用を及ぼしていることが明らかになりました。これにより、がん細胞同士が互いに助け合いながら、腫瘍全体としてフェロトーシスへの抵抗性を高めていることが示されました(図)。
次に研究チームは、GCH1の機能を阻害する薬剤とフェロトーシスを誘導する薬剤を併用し、肺がんモデルマウスに投与してその治療効果を検証しました。その結果、併用療法は、いずれか一方の単独療法よりもはるかに高いがん細胞死滅率を示し、腫瘍の成長を抑制することができました。これにより、がん細胞の異質性や細胞間相互作用を標的とした複合的治療法の有効性が実証され、フェロトーシスを標的とした新たな治療戦略の可能性が大きく広がりました。
社会的インパクト
がんは、世界中で年間1,000万人以上が命を落とす深刻な疾患であり、その治療法の改善は医療分野における最優先課題の一つです。従来の抗がん剤や放射線治療は、がん細胞を一律に攻撃するアプローチが中心であり、腫瘍内の細胞多様性や異質性には十分対応できていませんでした。そのため、治療が長期化すると、再発や薬剤耐性といった課題に直面することが少なくありません。
今回の研究成果は、がん細胞群が単独で治療抵抗性を獲得するのではなく、役割分担や協力関係を築くことで、腫瘍全体としての生存率を高めているという新たな視点を提示しました。従来のがん治療では、こうした細胞間の協調的な防御機構は見過ごされており、本成果は治療効果の限界や耐性の発現を説明する重要な手がかりとなることが期待されます。この考え方は肺がんにとどまらず、膵臓がんや乳がんなど他のがん種にも応用できる可能性を秘めており、今後のがん治療の根本的な変革につながることが期待されます。
さらに、本研究で解明された細胞間の防御機構やシグナル伝達のメカニズムは、がんだけでなく他の疾患の病態解明や新薬開発にも寄与する可能性が高く、生命科学全体の進展にも貢献が期待されます。がんを単なる細胞の異常増殖としてではなく、複雑な細胞群による協調的なシステムとして捉え直すことで、これまでの常識を超えた新たな治療パラダイムの構築が期待されます。
今後の展開
今後の研究では、今回発見された「YAP/TAZ活性の異なる細胞群間の相互作用」や「GCH1–BH4抗酸化システム」の分子レベルでの詳細なメカニズムを、さらに深く解明していくことが重要です。特に、BH4がどのような経路で細胞間を移動し、その抗酸化作用が腫瘍全体にどの程度影響を及ぼしているのか、さらにこの作用が細胞の代謝や他のシグナル伝達経路とどのように関連しているのかを明らかにする必要があります。
また、GCH1を標的とした薬剤の開発においては、標的選択性の向上、安全性の確保、体内動態の最適化を図りつつ、今回の基礎研究成果を実臨床へとつなげる取り組みが求められます。さらに、この細胞間防御機構が肺がんに限らず、膵臓がんや乳がん、さらには他の固形がんにおいても共通して存在するかどうかを検証し、より広範ながん治療への応用可能性を探る必要があります。
加えて、がん細胞の多様性に対応した個別化医療(プレシジョンメディシン)の実現に向けては、患者ごとの腫瘍の遺伝的・細胞的特徴を詳細に解析し、それに基づいて最適な治療戦略を設計することが不可欠です。これらの目標を達成するために、基礎医学、薬物動態学、臨床医学など多角的なアプローチを通じて、新たながん治療薬の開発や治療プロトコルの最適化に取り組んでいきます。
付記
本研究成果は日本医療研究開発機構、日本学術振興会、科学技術振興機構、小林がん研究振興財団、高松宮妃癌研究基金、金原一郎記念医学医療振興財団、日本がん研究振興財団、加藤記念バイオサイエンス振興財団の支援を受けて実施したものです。
参考文献
- [2]
- DOI: 10.1038/nrc3876
用語説明
- [用語1]
- YAP(Yes-associated protein)およびTAZ(transcriptional coactivator with PDZ-binding motif):YAP(Yes-associated protein)およびTAZ(transcriptional coactivator with PDZ-binding motif)
細胞内のシグナル伝達を担うタンパク質群で、細胞の増殖・分化・細胞死の制御に関与する。がん細胞の悪性化や治療抵抗性に深く関わる重要因子である。 - [用語2]
- フェロトーシス:細胞内の鉄イオンが過剰に反応し、脂質膜の酸化によって引き起こされる、新しいタイプの細胞死。がん治療の新たな標的として注目されている。
- [用語3]
- BH4(テトラヒドロビオプテリン):強力な抗酸化作用を持つ生体内物質。細胞内の活性酸素種を抑制し、特に脂質の過酸化を防ぐことで細胞を保護する働きがある。
- [用語4]
- GCH1(GTPシクロヒドロラーゼ1):BH4の合成において中心的な役割を担う酵素。抗酸化物質であるBH4の生産を促進し、細胞を酸化ストレスから守る。
- [用語5]
- 腫瘍の異質性:一つの腫瘍内に、性質の異なるがん細胞が混在している状態。腫瘍の進行や治療抵抗性に重要な影響を及ぼす。
論文情報
- 掲載誌:
- EMBO reports
- タイトル:
- Hippo pathway controls biopterin metabolism to shield adjacent cells from ferroptosis in lung cancer
- 著者:
- Hao Li, Yohei Kanamori, Akihiro Nita, Ayato Maeda, Tianli Zhang, Kenta Kikuchi, Hiroyuki Yamada, Touya Toyomoto, Mohamed Fathi Saleh, Mayumi Niimura, Hironori Hinokuma, Mayuko Shimoda, Koei Ikeda, Makoto Suzuki, Yoshihiro Komohara, Daisuke Kurotaki, Tomohiro Sawa, Toshiro Moroishi
研究者プロフィール
諸石 寿朗 Toshiro MOROISHI
東京科学大学 総合研究院 難治疾患研究所 細胞動態学分野 教授
研究分野:分子生物学、細胞生物学
関連リンク
東京科学大学 総務企画部 広報課
- media@adm.isct.ac.jp
- Tel
- 03-5734-2975
- FAX
- 03-5734-3661