ポイント
- 線維化の強い肝がんではSPP1が高発現し、腫瘍内線維化の進展および予後不良と関連することを、大規模臨床データ解析により明らかに。
- 肝がん細胞由来SPP1がCD44を介してHedgehog/GLI1シグナルを活性化し、肝星細胞を誘導することで腫瘍内線維化と腫瘍増殖を促進する分子メカニズムを解明。
- Hedgehogシグナル阻害剤vismodegibにより、腫瘍内線維化および腫瘍増殖が抑制され、線維化を伴う肝がんに対する新たな分子標的治療戦略となる可能性を示唆。
概要
東京科学大学(Science Tokyo) 大学院医歯学総合研究科 分子腫瘍医学分野の田中真二教授、島田周助教、秋山好光講師、波多野恵助教、奈良篤大学院生らの研究チームは、同大学の肝胆膵外科および人体病理学分野との共同研究により、肝がんの進展に深く関わる「腫瘍内線維化」に着目し、その分子基盤を多層的な解析により解明しました。372例の肝がん組織を対象とした網羅的遺伝子発現解析および103例の臨床検体を用いた免疫組織染色解析の結果、分泌タンパク質SPP1(osteopontin)が線維化の強い肝がんで特異的に高発現し、予後不良と強く関連する主要因子であることが明らかになりました。さらに、SPP1を過剰発現する肝がん細胞は、異種移植腫瘍モデルにおいて造腫瘍能および腫瘍内線維化の亢進を示しました。
加えて、SPP1過剰発現肝がん細胞と肝星細胞の共培養実験により、SPP1がCD44を介してHedgehog/GLI1シグナルを誘導し、肝星細胞を活性化することが明らかとなりました。また、Hedgehogシグナル阻害剤vismodegibの投与により、肝星細胞の活性化、腫瘍内線維化、および腫瘍増殖が抑制されました。以上の結果から、SPP1–CD44–Hedgehog経路[用語1]は、腫瘍内線維化と肝がん進展を促進する中心的な経路であり、予後予測因子および治療標的となり得ることが示唆されました。
本研究成果は、線維化を伴う難治性肝がんに対する新たな分子標的治療戦略の開発につながる可能性を示しています。
本成果は、12月28日(現地時間)付で、「Cancer Science」誌オンライン版に掲載されました。
背景
肝細胞がんは原発性肝がんの75〜85%を占め、ウイルス性肝炎、アルコール多飲、糖尿病や肥満に代表される代謝性疾患など、多様な背景から発症します。近年、抗ウイルス療法の発展によりウイルス性肝炎の制御が進んだ一方で、肝炎ウイルス陰性後の発がんリスクや、代謝性疾患関連肝がんの増加が問題となっています。肝炎ウイルス陰性後であっても、5年累積肝がん発症率は2〜8%とされており、代謝性疾患関連肝がんと同様に、肝線維化やFIB-4 index[用語2]がリスク因子として注目されています。実際に、肝がんの80〜90%は線維化肝を背景として発生することが報告されており、肝線維化が肝発がんの重大なリスク要因であることは明らかです。
肝線維化は、主にI型およびIII型コラーゲンなどの細胞外基質の蓄積による瘢痕形成を特徴とし、その中心的役割を担うのが肝星細胞です。肝星細胞は、肝細胞と毛細血管の間に存在する線維芽細胞であり、ビタミンAを貯蔵し、肝臓の代謝や再生に関与しています。炎症などの刺激によって活性化された肝星細胞は、遊走やサイトカイン分泌、コラーゲン産生を介して線維化を進展させます。SPP1(osteopontin)、TGFβ、TNFα、PDGF、IL-1βなど、肝星細胞の活性化に関与する因子が多数同定されており、近年ではcytoglobinやFGF18といった因子が肝星細胞機能を抑制し、線維化を改善することも示されています。一方で、SPP1は免疫療法抵抗性などとの関連が示唆されているものの、その詳細な分子機構は未解明であり、標的治療の確立には至っていません。
本研究では、臨床検体解析を通じて、SPP1が腫瘍内線維化および予後に寄与していることを明らかにし、治療標的としての可能性を検討しました。
研究成果
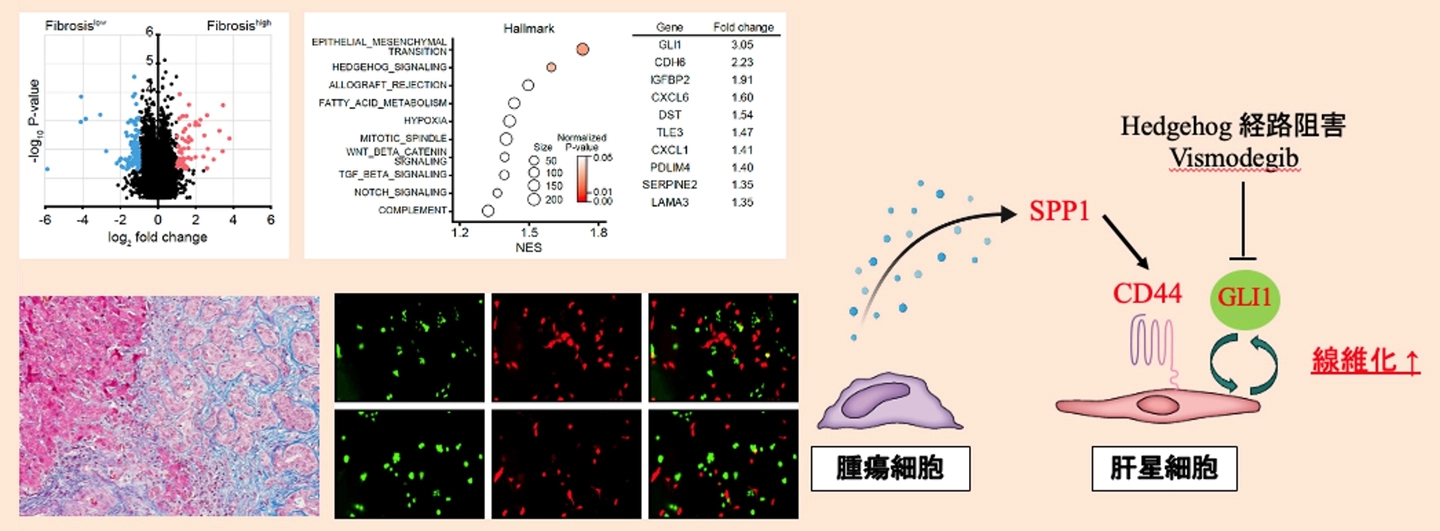
372例の肝がん組織に関する公開データを用いた網羅的遺伝子発現解析において、Ishak fibrosis score[用語3]高値群で発現が上昇している遺伝子の中から、最も予後不良と関連する遺伝子としてSPP1に着目しました。103例の自施設臨床検体を用いた免疫組織染色解析では、SPP1タンパク質が肝がん細胞に強く発現しており、34例(33.0 %)でSPP1の過剰発現が認められました。さらに、102例の肝がん組織に関する公開シングルセルデータにおいても、SPP1が肝がん細胞で高発現していることが示され、これらの結果は互いに矛盾しないものでした。SPP1発現は、腫瘍径、門脈浸潤、背景肝および腫瘍の線維化と関連しており、SPP1高発現群では全生存率(P<0.01)および無再発生存率(P<0.05)が有意に不良でした。
ヒト肝がん細胞株においてSPP1を過剰発現させたところ(SPP1-OE)、増殖能、遊走能、浸潤能のいずれもが有意に亢進しました(P<0.01)。さらに、免疫不全マウス皮下移植腫瘍モデルでは、腫瘍の増殖亢進(P<0.05)および腫瘍内線維化の亢進(P<0.01)が認められました。SPP1-OE細胞から分泌されたタンパク質を含む培養上清は、肝星細胞の遊走能および浸潤能を亢進させました。また、両細胞を共培養した結果、SPP1-OE細胞が肝星細胞を強く誘導することが明らかとなりました(P<0.01)。
遺伝子発現解析およびシグナル経路解析の結果、SPP1-OE細胞と共培養した肝星細胞において、GLI1の発現上昇とHedgehogシグナル経路の活性化が確認されました。さらに、公開シングルセルデータを用いた細胞間相互作用解析[用語4]により、SPP1-CD44が肝がん細胞と肝星細胞の間で最も重要な細胞間シグナルであることが示されました。肝星細胞においてCD44をノックダウン[用語5]すると、GLI1の発現低下および核内移行の抑制が認められました。同様に、肝星細胞においてGLI1ノックダウン、あるいはHedgehogシグナル阻害剤vismodegibによる処理を行うと、SPP1-OE細胞による肝星細胞の誘導が減弱しました。以上の結果から、肝星細胞はSPP1-CD44-Hedgehog経路を介して活性化されることが示唆されました。
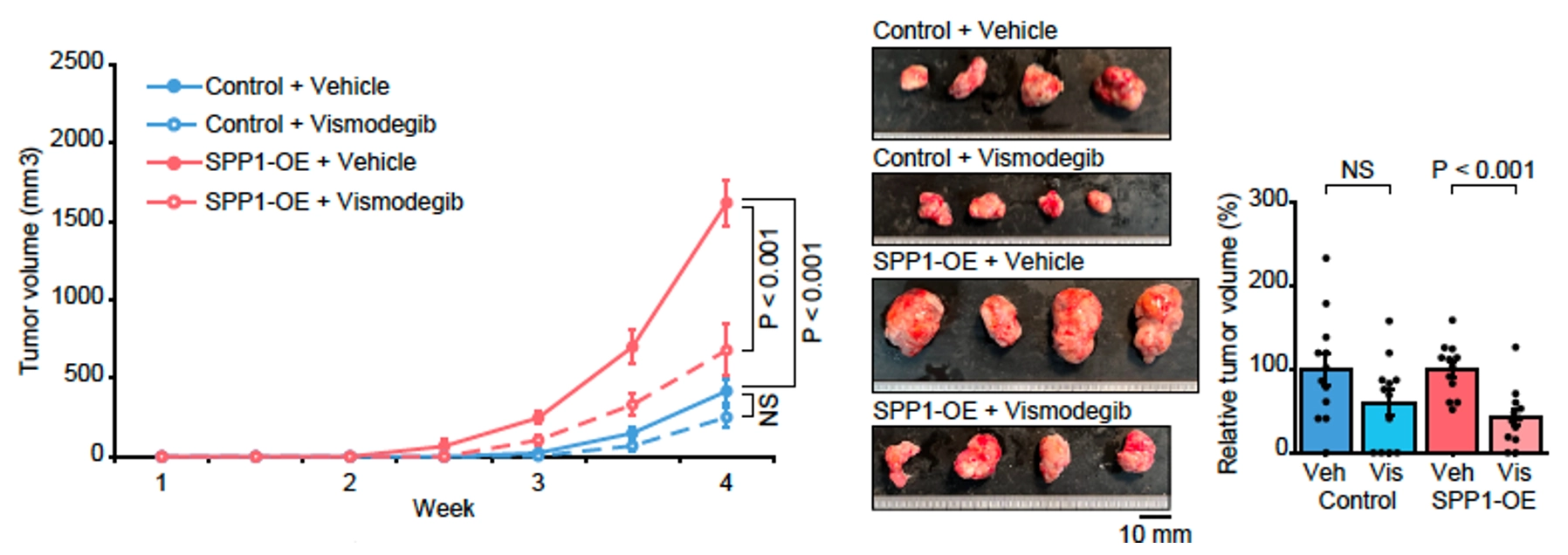
さらに、SPP1-OE細胞の免疫不全マウス皮下移植腫瘍モデルにおいてvismodegibを投与したところ、腫瘍増殖の抑制(P<0.001)および腫瘍内線維化の抑制(P<0.01)が認められました。また、SPP1-OE細胞の免疫不全マウス同所肝内移植腫瘍モデルでは、GLI1陽性かつαSMA・desmin陽性の肝星細胞の増加が認められました。
社会的インパクト
本研究では、網羅的遺伝子発現解析、シングルセルデータ解析[用語6]、細胞間相互作用解析、前臨床モデルなどの多角的な手法を統合することで、肝がんにおける腫瘍内線維化および腫瘍増殖に関わる分子機構を詳細に検討しました。特に、線維化の強い肝がんにおいて SPP1 が高発現し予後と関連する可能性、さらに SPP1–CD44–Hedgehog 経路が肝星細胞の活性化および線維化形成に関与する可能性が示唆されました。これらの知見は、線維化の程度や分子特性に基づいて肝がんを層別化し、治療選択を検討する上での基盤情報となり得ます。
前臨床モデルを用いた検討では、肝がん細胞から分泌されたSPP1が腫瘍内線維化や腫瘍増殖を促進する一方で、Hedgehogシグナル阻害薬 vismodegib がこれらを抑制する可能性が示されました。Vismodegibは基底細胞癌に対する治療薬として米国食品医薬品局(FDA)に承認されており、既存薬の転用による治療が有用となり得る点は、本研究の臨床応用の可能性を強く支持するものです。
今後の展開
今後は、SPP1–CD44–Hedgehog シグナルの詳細な分子機構をさらに検証するとともに、SPP1やGLI1の発現を指標としたバイオマーカーの開発や、線維化の程度に基づく患者層別化の検討を進めることで、線維化を伴う肝がんに対する個別化治療の実現に寄与することが期待されます。
付記
本研究は文部科学省科学研究費補助金、国立研究開発法人日本医療研究開発機構(AMED)「肝炎等克服実用化研究事業」および「次世代がん医療創生研究事業」、高松宮妃癌研究基金研究助成金などのもとに行われたものです。
用語説明
- [用語1]
- Hedgehog経路:細胞の増殖・分化・生存などを制御するシグナル伝達経路。Hedgehog因子が受容体Ptch(Patched)に結合すると、抑制されていたSmo(Smoothened)が活性化され、その下流で転写因子GLI1が核内に移行し、標的遺伝子の発現を促進する。
- [用語2]
- FIB-4 index:年齢、採血結果(肝機能、血小板数)から算出される指標。肝臓の線維化の程度を推定するために用いられる。
- [用語3]
- Ishak fibrosis score:肝臓の線維化(肝硬変の進行度)を評価する病理スコア。
- [用語4]
- 細胞間相互作用解析:細胞同士がどのような分子を介して情報を伝え合っているかを推定する解析。
- [用語5]
- ノックダウン:特定の遺伝子の発現を抑制する遺伝子改変技術。
- [用語6]
- シングルセルデータ解析:組織を1細胞ごとに分けて、各細胞の遺伝子発現を調べる解析。
論文情報
- 掲載誌:
- Cancer Science
- タイトル:
- Targeting SPP1-CD44-Hedgehog axis elicits therapeutic effects in hepatocellular carcinoma by suppressing intratumoral fibrosis
- 著者:
- Atsushi Nara, Shu Shimada, Yoshimitsu Akiyama, Megumi Hatano, Yusuke Chino, Suguru Miyazawa, Hanako Tamura, Daisuke Asano, Yoshiya Ishikawa, Hiroki Ueda, Shuichi Watanabe, Eriko Katsuta, Keiichi Akahoshi, Kenichi Ohashi, Minoru Tanabe, Daisuke Ban, Shinji Tanaka
- DOI:
- 10.1111/cas.70296
研究者プロフィール
田中 真二 Shinji Tanaka
東京科学大学 大学院医歯学総合研究科 分子腫瘍医学分野 教授
研究領域:分子腫瘍医学、消化器外科学
島田 周 Shu Shimada
東京科学大学 大学院医歯学総合研究科 分子腫瘍医学分野 助教
研究領域:分子腫瘍医学
奈良 篤 Atsushi Nara
東京科学大学 大学院医歯学総合研究科 肝胆膵外科学分野 大学院生
研究領域:肝胆膵外科学
関連リンク
東京科学大学 大学院医歯学総合研究科 分子腫瘍医学分野
助教 島田 周
- shimada.monc@tmd.ac.jp