ポイント
- 数百例規模の肝がん臨床検体のバルクデータとシングルセルデータを統合解析し、肝がんの分子免疫学的分類を精緻化した結果、高悪性度肝がんではp53/MYC異常が発症に関与し、T細胞浸潤が低下していることを解明
- p53/MYC異常を有する肝がんは、周囲を血管内皮細胞に覆われた大索状構造(MTM/VETC構造)を形成し、腫瘍内のT細胞を排除することを見出し、MTM/VETC肝がんは免疫抑制的な環境を作ることを確認
- MTM/VETC肝がんに対して、強力な血管新生阻害剤と免疫チェックポイント阻害剤の併用療法により腫瘍が大きく縮小し、新たな治療戦略が有効である可能性が示唆
概要
東京科学大学(Science Tokyo)※ 大学院医歯学総合研究科 分子腫瘍医学分野の田中真二教授、島田周助教、秋山好光講師、波多野恵助教、谷合智彦連携研究員らの研究チームは、同大学の肝胆膵外科、肝臓病態制御学講座、および東京慈恵会医科大学外科学講座との共同研究において、以下の成果を明らかにしました。
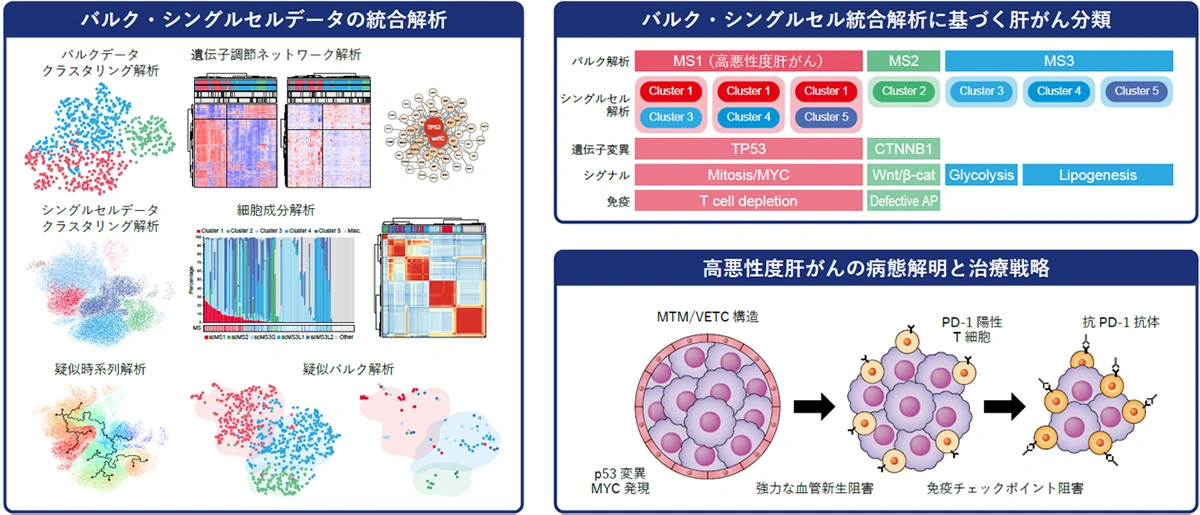
研究グループは、691症例のバルクデータと228,564細胞のシングルセルデータを統合解析し、肝がん細胞を5つのクラスター(1: 細胞分裂亢進、2: Wnt/β-cateninシグナル活性化、3: 解糖系亢進、4・5: 脂肪合成亢進)に分類しました。特に、高悪性度肝がんは、クラスター1(細胞分裂亢進)とクラスター3・4・5(代謝異常)の組み合わせで構成され、p53/MYC異常が発症に関与し、T細胞浸潤が低下していることを明らかにしました。
また、p53欠失とMYC発現を導入したマウス肝がん細胞は、正常免疫マウスの皮下および肝内でMTM/VETC肝がんを形成し、腫瘍内のT細胞を排除することが判明しました。強力な血管新生阻害剤の投与によりMTM/VETC構造が破壊され、T細胞浸潤が改善されることで、免疫チェックポイント阻害剤の効果が向上することが確認されました。
本研究では、高悪性度肝がんのサブタイプの一つであるMTM/VETC肝がんの発症および免疫回避メカニズムを解明し、血管新生阻害剤と免疫チェックポイント阻害剤の併用療法が有望であることを示唆しました。
本成果は、2月26日付(米国東部時間)付で、米国肝臓学会誌「Hepatology」電子版に掲載されました。
- 2024年10月1日に東京医科歯科大学と東京工業大学が統合し、東京科学大学(Science Tokyo)となりました。
背景
肝がんは、肝炎ウイルス感染、アルコール摂取、代謝異常などによる慢性肝疾患を背景に発症する複雑な疾患です。外科的切除、局所焼灼療法、経動脈化学塞栓療法(TACE)、薬物療法などの治療法が存在するものの、依然として予後は不良です。
近年、薬物療法として血管新生阻害剤や免疫チェックポイント阻害剤が登場しましたが、効果には個人差があり、どの患者にどの治療が有効かを見極めることが課題となっています。これまでの研究では、肝がんは分子生物学的・臨床病理学的特徴に基づき「増殖型」と「非増殖型」に分類され、特に「増殖型」はTP53変異が多く、増殖性・幹細胞性が強いため転移しやすく、予後が悪いことが知られています。しかし、その分子メカニズムは十分に解明されておらず、有効な治療法も確立されていません。
一方、最近の病理学的研究では、大索状型優位構造(macrotrabecular-massive: MTM)や、血管内皮細胞が腫瘍塊を取り囲む構造(vessels encapsulating tumor clusters: VETC)を持つ肝がんが全体の約30%を占めることが報告されています。MTM/VETC肝がんは浸潤能・転移能が高く、高悪性度肝がんのサブタイプの一つとして注目されていますが、その分子メカニズムや有効な治療法は未解明のままです。
本研究では、肝がんのサブタイプ分類をより詳細に解析し、その結果をもとに高悪性度肝がんのモデルを作製することで、発症メカニズムの解明と新たな治療戦略の開発を目指しました。
研究成果
肝がんのサブタイプ分類を精緻化するために、公開データベースに登録されている691症例のバルク[用語1]データと、228,564細胞の<a href="#note2" id="note2u" title="癌細胞と間質細胞(血管内皮細胞、免疫細胞など)をそれぞれ1細胞ずつ分けること。>シングルセル[用語2]データを、スーパーコンピューター「SHIROKANE」を用いて統合解析しました。バルク解析では、肝がん組織が、以前報告されたMS1(高悪性度)、MS2(CTNNB1変異)、MS3(代謝異常)の3つのサブタイプに分類され、遺伝子調節ネットワーク解析と遺伝子パスウェイ解析によりMS1ではp53/MYC異常が中心的な役割を果たしていることが明らかとなりました。
シングルセル解析では、肝がん細胞自体がクラスター1(細胞分裂亢進)、クラスター2(Wnt/β-cateninシグナル活性化)、クラスター3(解糖系亢進)、クラスター4・5(脂肪合成亢進)の5つの主要クラスターに分類されることが判明しました。また、疑似バルク解析[用語3]と疑似時系列解析[用語4]を用いた結果、MS1はクラスター1(細胞分裂亢進)とクラスター3・4・5(代謝異常)の組み合わせで構成されていることがわかりました。さらに、MS1ではT細胞浸潤が低下しているという免疫学的特徴も確認されました。
次に、高悪性度肝がんのモデル化を目的として、p53欠失とMYC発現を導入したマウス肝がん細胞株を作製しました。この細胞株は、同系統の正常免疫マウスの皮下および肝内においてMTM/VETC肝がんを形成し、腫瘍内のT細胞を排除することで免疫抑制性の腫瘍微小環境[用語5]を構築することが明らかになりました。
また、当院で肝がん切除を受けた症例104例のうち、36例(35%)にMTM/VETC構造が認められました。MTM/VETC肝がん症例では、無再発生存および全生存の両指標において有意に予後不良であることが確認されました。さらに、腫瘍組織内のTリンパ球浸潤が低下していることが明らかになり、リアルワールドのデータとマウスモデルの結果が矛盾しないことが示されました。
RNAシークエンス解析の結果、p53欠失/MYC発現肝がん細胞株において、血管新生因子angiopoietin-like protein 2(Angptl2)とIL-11が特徴的に発現していることが判明しました。さらに、これらの遺伝子をノックアウトすると、腫瘍のMTM/VETC構造が消失し、腫瘍内のTリンパ球浸潤が改善することを発見しました(図1)。
この細胞株を用いた正常免疫マウス移植腫瘍モデルに対し、血管新生阻害剤レンバチニブおよび免疫チェックポイント阻害剤抗PD-1抗体を投与したところ、抗PD-1抗体単剤では抗腫瘍効果が認められなかったのに対し、レンバチニブと抗PD-1抗体の併用療法は、レンバチニブ単剤と比較して顕著な腫瘍縮小効果を示しました。レンバチニブ投与群の移植腫瘍では、MTM/VETC構造が消失し、腫瘍内のTリンパ球浸潤の増加が確認されました(図2)。
さらに、臨床解析の結果、治療前のCT画像によりMTM/VETC肝がんを予測診断できることが示され、MTM/VETC肝がん症例において実際に同併用療法が奏功したことも報告しました。
社会的インパクト
本研究では、大規模なバルクデータとシングルセルデータの統合解析を通じて、肝がんのサブタイプ分類を精緻化しただけでなく、各サブタイプの分子メカニズムや免疫プロファイルの詳細を解明しました。これにより、各サブタイプに対する最適な治療戦略を検討する上での重要な基盤となる知見を得ることができました。
さらに、本研究成果をもとに高悪性度肝がんの分子生物学的・病理学的・免疫学的特徴を再現した肝がん細胞株を作製し、前臨床モデルとして治療戦略を検討した結果、高悪性度肝がんには強力な血管新生阻害と免疫チェックポイント阻害の併用療法が著効することが示されました。加えて、実際の臨床症例においても、MTM/VETC肝がんの画像診断(イメージングバイオマーカー)により、複合免疫療法の効果を予測できる可能性が示唆されました。
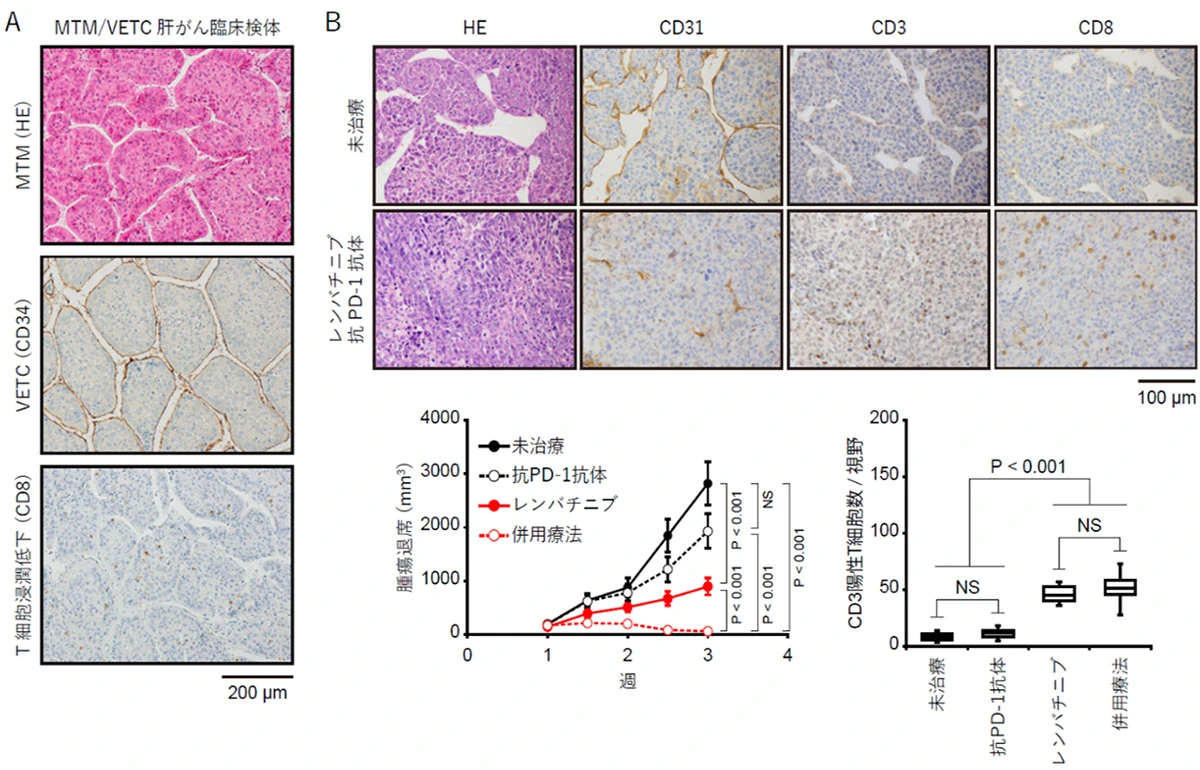
A. ヒト臨床症例、B. マウスモデル
今後の展開
今後は、本研究をさらに発展させ、各サブタイプの分子メカニズムに基づいた前臨床モデルを作製するとともに、各サブタイプに特異的な治療法の開発を進めることで、肝がんの個別化治療の実現が期待されます。
付記
本研究は文部科学省科学研究費補助金、国立研究開発法人日本医療研究開発機構(AMED)「肝炎等克服実用化研究事業」および「次世代がん医療創生研究事業」、高松宮妃癌研究基金研究助成金などのもとに行われたものです。
用語説明
- [用語1]
- バルク:癌細胞と間質細胞(血管内皮細胞、免疫細胞など)が一緒になった状態。
- [用語2]
- シングルセル:癌細胞と間質細胞(血管内皮細胞、免疫細胞など)をそれぞれ1細胞ずつ分けること。
- [用語3]
- 疑似バルク解析:シングルセルデータをサンプル単位で集約し、疑似的なバルクデータとして解析する手法。
- [用語4]
- 疑似時系列解析:遺伝子発現のパターンから擬似的な時間軸を推定し、発生や進行のプロセスを解析する手法。
- [用語5]
- 腫瘍微小環境:癌細胞とそれを取り巻く腫瘍血管、免疫細胞、間質などで構成される構造。
論文情報
- 掲載誌:
- Hepatology
- 論文タイトル:
- Integrative transcriptome profiling elucidates molecular and immunovascular characteristics of macrotrabecular hepatocellular carcinoma
- 著者:
- Tomohiko Taniai, Shu Shimada, Yoshimitsu Akiyama, Megumi Hatano, Koya Yasukawa, Yosuke Igarashi, Shu Tsukihara, Yoshiaki Tanji, Keita Kodera, Kohei Okazaki, Koichiro Haruki, Atsushi Nara, Kohei Yagi, Keiichi Akahoshi, Daisuke Ban, Yasuhiro Asahina, Toru Ikegami, Minoru Tanabe, Shinji Tanaka
研究者プロフィール
田中 真二 Shinji TANAKA
東京科学大学 大学院医歯学総合研究科 分子腫瘍医学分野 教授
研究領域:分子腫瘍医学、消化器外科学
島田 周 Shu Shimada
東京科学大学 大学院医歯学総合研究科 分子腫瘍医学分野 助教
研究領域:分子腫瘍医学
谷合 智彦 Tomohiko Taniai|東京慈恵会医科大学 総合医科学研究センター遺伝子治療研究部
東京科学大学 大学院医歯学総合研究科 分子腫瘍医学分野 連携研究員
研究領域:分子腫瘍医学、肝胆膵外科学