ポイント
- 胃がん患者の予後を推測する新たなバイオマーカーを同定。
- ヒストンラクチル化上昇と解糖系亢進のフィードバック機構を解明。
- ヒストンラクチル化を標的とする新しいがん治療法の可能性に期待。
概要
東京科学大学(Science Tokyo)※ 大学院医歯学総合研究科 分子腫瘍医学分野の田中真二教授、秋山好光講師、島田周助教、波多野恵助教、月原秀連携研究員らの研究グループは、同消化器外科学分野、東京慈恵会医科大学外科学講座、および東京大学大学院医学系研究科衛生学教室との共同研究において、以下の成果を明らかにしました。
胃がんにおいて、乳酸を基質とするヒストンH3K18(ヒストンH3の18番目のリジン残基)ラクチル化レベルの亢進が胃がん患者の予後悪化に密接に関連していることを発見し、ヒストンH3K18ラクチル化が胃がんの予後を推測する新たなバイオマーカー[用語1]となる可能性が示唆されました。
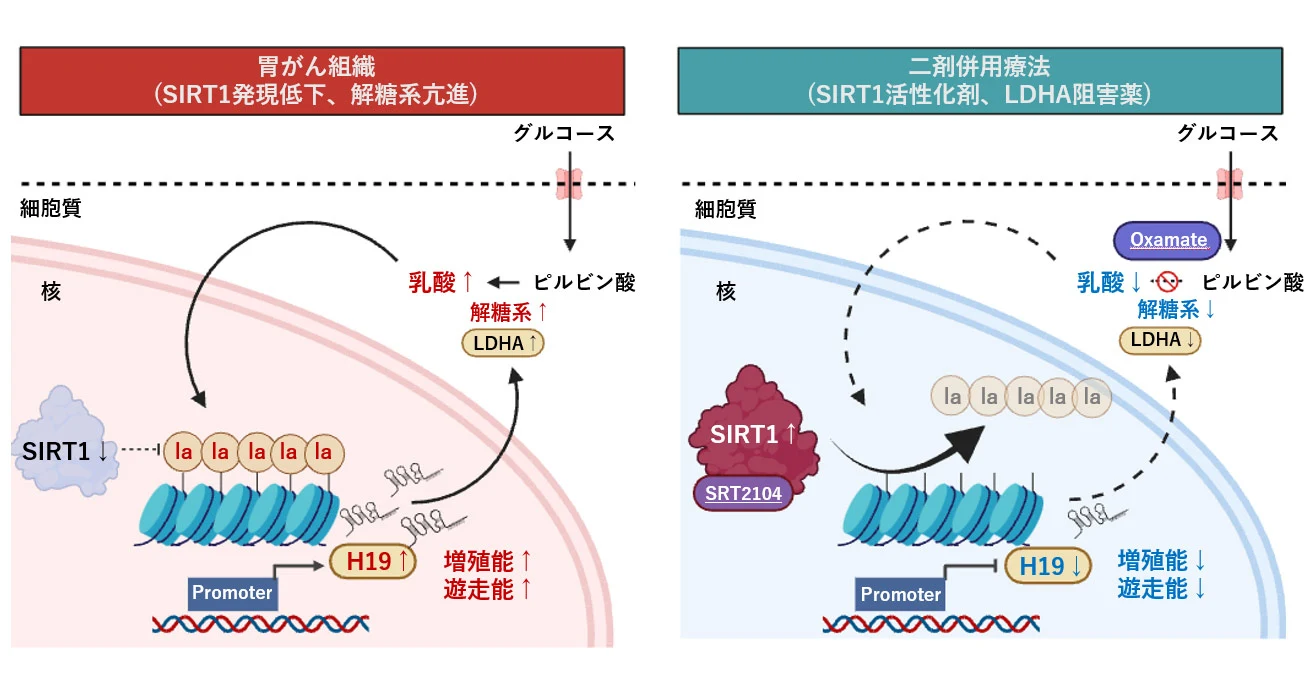
またSIRT1[用語2]がヒストンラクチル化[用語3]を除去する酵素であることを突き止め、胃がん組織ではSIRT1遺伝子の発現が低下していることが確認されました。このことから、SIRT1の発現低下が、ヒストンラクチル化レベルの上昇を招く原因であると推測されました。
さらにヒストンラクチル化レベルの亢進が、長鎖ノンコーディングRNA[用語4]の一つであるH19の発現を上昇させ、それを介してがん特有の解糖代謝(Warburg効果[用語5])を亢進させ、この代謝亢進がさらにヒストンラクチル化を加速させるフィードバックループ機構を形成し、がんの増殖・悪性化が進行していることが示唆されました。
本研究成果は、12月11日付(英国時間)の「Oncogene」誌電子版に掲載されました。
- 2024年10月1日に東京医科歯科大学と東京工業大学が統合し、東京科学大学(Science Tokyo)となりました。
背景
乳酸は解糖系の最終代謝産物であり、その代謝異常はがんの増殖や進展に深く関与しています。がん細胞特有の解糖系代謝は、古くからWarburg効果として知られています。近年、新たなエピゲノム修飾[用語6]として乳酸を基質とするヒストンラクチル化が報告されました。
ヒストン修飾[用語7]の一つとして、特定のヒストン H3のリジン残基(K)におけるラクチル化は遺伝子発現を活性化させる作用を持つことや、複数の悪性腫瘍でヒストンラクチル化レベルが高いことが確認されました。また、ヒストンラクチル化修飾には、ヒストンアセチル化修飾酵素(EP300やHDAC1など)が密接に関与することも報告されています。
一方で、胃がんにおけるラクチル化に関連する研究報告はこれまで少なく、ヒストンラクチル化修飾の状態やその修飾関連酵素については、ほとんど解明されていませんでした。
研究成果
臨床胃がん検体を用いてラクチル化状態を評価した結果、胃がん組織においてヒストンH3K18ラクチル化レベルが有意に上昇していることが確認されました(図1)。また、ヒストンH3K18ラクチル化(la)が亢進している胃がん患者では、全生存期間および無再発生存期間が短く、ヒストンラクチル化亢進は、胃がん患者の予後を予測する有望なバイオマーカーとなる可能性が示唆されました(図2)。
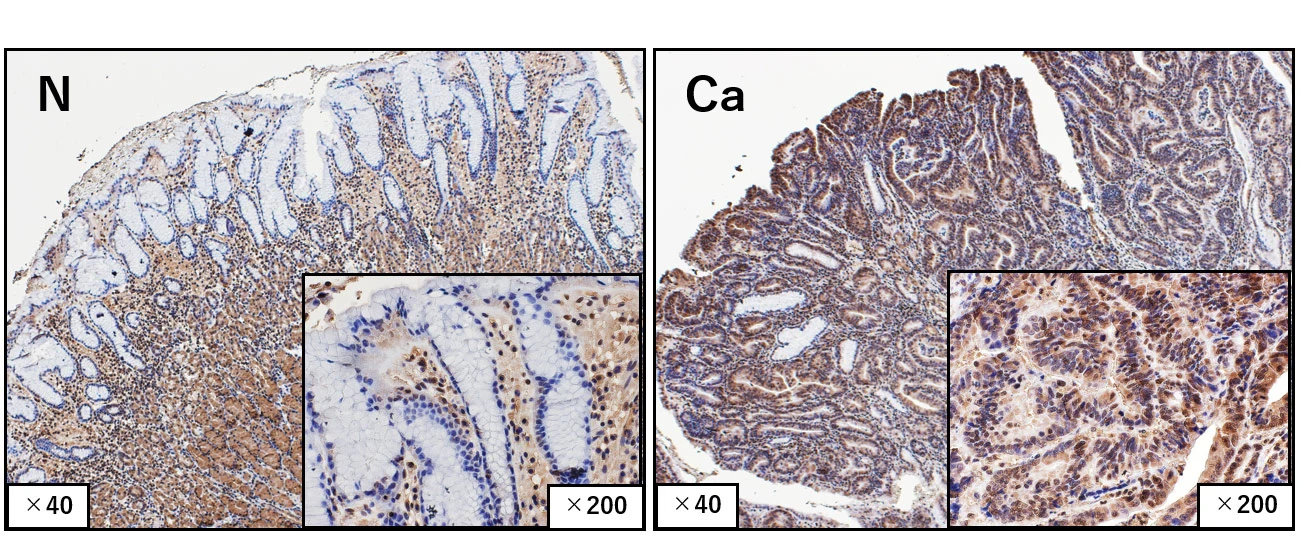
正常組織(N)と比較して、胃がん組織(Ca)でヒストンラクチル化レベルが強い
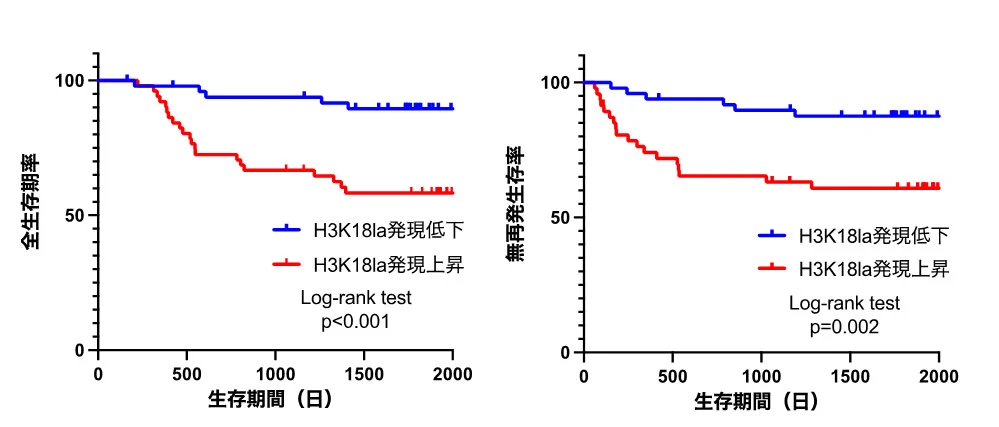
H3K18la高発現胃がん症例では全生存期間(左)、無再発生存期間(右)が短く、予後が悪い。
遺伝子発現データベースを用いた解析により、ヒストン修飾関連酵素の発現異常と胃がん患者の予後悪化との関連性を調べた結果、ヒストン脱アセチル化酵素であるSIRT1の発現低下が、胃がんの予後不良に関与していることが明らかになりました。SIRT1をヒト胃がん細胞株に強制発現させると、リジンラクチル化(panKla)およびH3K18laレベルの低下を認め、SIRT1がヒストン脱ラクチル化酵素として機能することが明らかになりました(図3)。
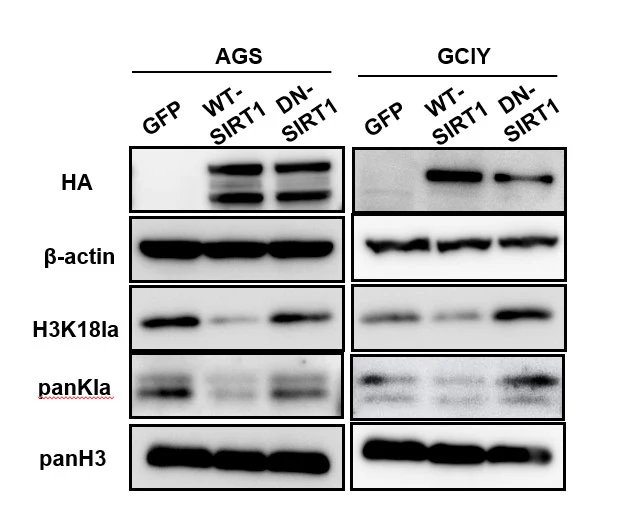
正常SIRT1(WT-SIRT1)を過剰発現させるとH3K18laレベルが低下するが、
機能消失型(DN-SIRT1)を過剰発現させてもH3K18laレベルは低下しない。
次にRNAシーケンスを用いてSIRT1により発現が低下する遺伝子の探索した結果、長鎖ノンコーディングRNAの一つであるH19を同定しました。H19は、多くの悪性腫瘍においてがん促進的な役割を持ち、解糖系の亢進にも関与することが知られています。機能解析の結果、H19遺伝子の発現は、SIRT1によるヒストン脱ラクチル化を介したエピジェネティック機構により抑制されていることが明らかにしました。
さらに、ヒト胃がん細胞においてH19発現を抑制すると、LDHA遺伝子(乳酸脱水素酵素A)の発現抑制を介して解糖系が抑制され、ヒストンラクチル化レベルの低下が認められました。また、胃がん組織では正常組織と比較してSIRT1の発現が有意に低下していることが確認されました。SIRT1発現低下はヒストンラクチル化レベル上昇を招く原因となり、H19遺伝子のエピジェネティックな発現増加を通じて解糖系が亢進し、ヒストンラクチル化レベルがさらに上昇するポジティブフィードバックループ機構が明らかになりました(図4)。
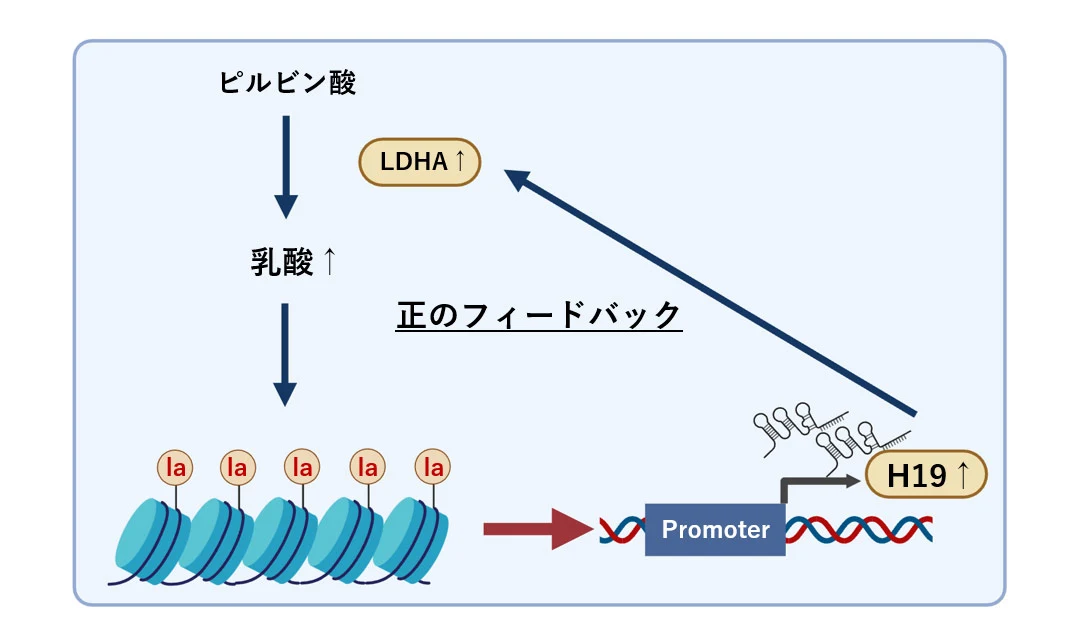
次にSIRT1活性化剤とLDHA阻害薬を併用した治療効果を検討した結果、ヒト胃がん細胞株に対しては抗腫瘍効果を示す一方、ヒト正常胃粘膜細胞株に対してはほとんど影響を与えないことが分かりました。
以上の結果から、本研究はWarburg効果に関連する悪性腫瘍の新たな発達メカニズムを解明し、ヒストンラクチル化を標的とする新たな胃がん治療法の可能性を示唆しています。
社会的インパクト
研究チームは、胃がんにおける「ヒストンラクチル化」の異常を明らかにし、これまでの化学療法とは異なる視点からラクチル化を標的とした治療法として、SIRT1活性化剤やLDHA阻害薬の併用療法が有望であることを示しました。現在、免疫チェックポイント阻害薬が標準治療として導入されていますが、依然として難治性の症例が多く、新たなバイオマーカーの発見が急務となっています。本研究では、胃がんの腫瘍増殖や進展に関わる重要な分子機構を同定することで、ラクチル化を標的とした新しい胃がん治療アプローチの可能性を示しました。
本研究は、がん細胞特有の代謝現象である「Warburg効果」とエピゲノム修飾との関係を分子生物学的に解析し、新たなバイオマーカーや治療標的を特定し、胃がん治療の新しい方向性を切り拓く重要な知見を提供することができました。今後、この発見が臨床応用されれば、難治性胃がん患者に対する治療の選択肢が大きく広がることが期待されます。
今後の展開
SIRT1活性化剤およびLDHA阻害薬は、すでに糖尿病や潰瘍性大腸炎など他疾患に対する臨床試験が実施されており、その安全性は確認されています。今後は、マウスモデルを用いてSIRT1活性化剤とLDHA阻害薬の併用療法の胃がんに対する有効性や安全性を検証することが重要です。
付記
本研究は文部科学省科学研究費補助金、国立研究開発法人日本医療研究開発機構(AMED)「次世代がん医療創生研究事業」(P-CREATE)および「肝炎等克服実用化研究事業」、高松宮妃癌研究基金研究助成金などのもとにおこなわれたものです。
用語説明
- [用語1]
- バイオマーカー:生体内の状態を示す指標となる物質や特徴で、病気の診断や予後予測、治療効果の評価に使われる。
- [用語2]
- SIRT1: ヒストン脱アセチル化酵素の一つであり、ヒストンや非ヒストンタンク質のリジン残基からアセチル基を取り除く作用を持つ。
- [用語3]
- ヒストンラクチル化:乳酸を基質としたヒストンタンパク質のリジン残基での翻訳後修飾。
- [用語4]
- 長鎖ノンコーディングRNA:200塩基以上の長さを持つ非翻訳RNAで、遺伝子発現やエピジェネティクスの調節に関与。
- [用語5]
- Warburg効果:がん細胞が酸素の十分に存在する条件でも主に解糖系を利用してエネルギーを生成する現象。
- [用語6]
- エピゲノム修飾:遺伝子変異を伴わずに遺伝子発現に影響を及ぼす現象。DNAメチル化やヒストン修飾が知られている。
- [用語7]
- ヒストン修飾:ヒストンタンパク質の特定のアミノ酸残基にメチル化やアセチル化、ラクチル化などの化学的修飾が起こると遺伝子発現が活性化または不活性化する。ヒストン修飾に関わる酵素として修飾基を書き込むWriter、読み取るreaderと消し去るeraserタンパク質が存在する。
論文情報
- 掲載誌:
- Oncogene
- 論文タイトル:
- Delactylase effects of SIRT1 on a positive feedback loop involving the H19-glycolysis-histone lactylation in gastric cancer
- 著者:
- Shu Tsukihara, Yoshimitsu Akiyama, Shu Shimada, Megumi Hatano, Yosuke Igarashi, Tomohiko Taniai, Yoshiaki Tanji, Keita Kodera, Koya Yasukawa, Kentaro Umeura, Atsushi Kamachi, Atsushi Nara, Keisuke Okuno, Masanori Tokunaga, Hiroto Katoh, Shumpei Ishikawa, Toru Ikegami, Yusuke Kinugasa, Ken Eto, Shinji Tanaka
研究者プロフィール
田中真二 Shinji TANAKA
東京科学大学 大学院医歯学総合研究科 分子腫瘍医学分野 教授
研究領域:分子腫瘍医学、消化器外科学
秋山好光 Yoshimitsu AKIYAMA
東京科学大学 大学院医歯学総合研究科 分子腫瘍医学分野 講師
研究領域:分子腫瘍医学、癌エピジェネティクス
月原秀 Shu TSUKIHARA
東京科学大学 大学院医歯学総合研究科 分子腫瘍医学分野 連携研究員
研究領域:分子腫瘍医学、消化器外科学
関連ページ
お問い合わせ
取材申込み
東京科学大学 総務企画部 広報課
- Tel
- 03-5734-2975
- Fax
- 03-5734-3661
- media@adm.isct.ac.jp