ポイント
- 膵がんでは、ヒストンシトルリン化とPAD2の発現が高い症例で、予後が不良であることが判明。
- PAD2はヒストンシトルリン化を通じて、がん細胞の増殖を促し、免疫抑制的なM2型マクロファージの浸潤を促進。
- ヒストンシトルリン化を標的とすることで、膵がんの進行と免疫回避の両方に対処する新たな治療戦略の可能性が示された。
概要
東京科学大学(Science Tokyo)大学院医歯学総合研究科 分子腫瘍医学分野の田中真二教授、秋山好光講師、梅村謙太郎大学院生らの研究グループは、同大学の肝胆膵外科学分野、信州大学 医学部外科学教室、東京慈恵会医科大学 外科学講座との共同研究において、以下の成果を明らかにしました。
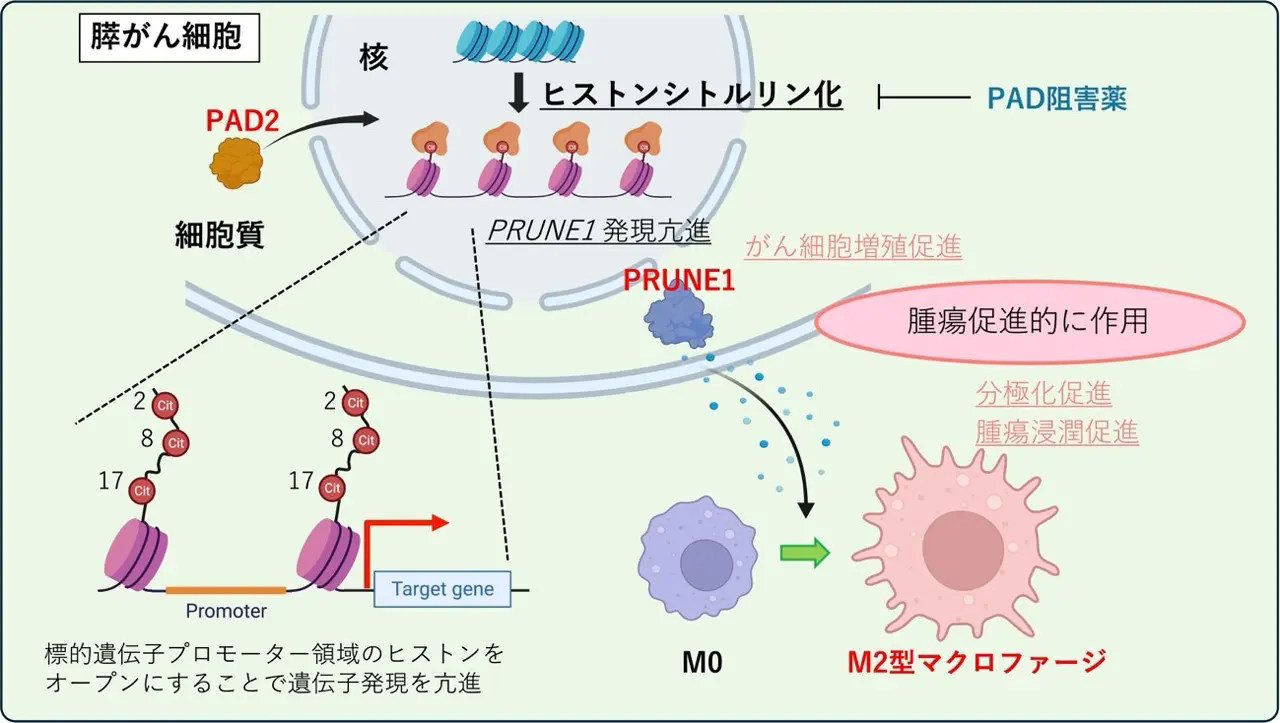
本研究では、膵がんにおいてPAD[用語1]という酵素が引き起こすエピゲノム修飾[用語2]の一つであるヒストンシトルリン化[用語3]が、がんの進行を促進することを明らかにしました。特に、膵がんで発現が亢進するPAD2ががん細胞の核内へ移行することにより、ヒストンシトルリン化を亢進させ、がん促進的遺伝子であるPRUNE1[用語4]の発現を高めることが示されました。
また、PRUNE1の発現が高まることで、がん細胞の増殖が促進されるとともに、免疫抑制的なM2型マクロファージ[用語5]が腫瘍内に集積することも判明しました。さらに、マウスモデルを用いた実験では、PAD2の働きを抑えることによってPRUNE1の発現が低下し、それを介してM2型マクロファージの腫瘍浸潤が抑制され、膵がんの進展を抑えられることが明らかとなりました。
これらの成果から、PAD2によるヒストンシトルリン化を標的としたエピジェネティック治療の開発やがん免疫療法への応用が期待されます。
本研究成果は、6月12日付(米国東部時間)で米国癌学会誌「Molecular Cancer Research」にオンライン掲載されました。
背景
膵がんは早期発見が困難で、再発や転移のリスクが高く、また抑制的な腫瘍微小免疫環境[用語6]を有することから、薬物治療への反応性が乏しく、現在も予後が極めて厳しいがんの一つです。
近年では、がんの発症や進行において、遺伝子の異常だけでなく、「エピゲノム」と呼ばれる遺伝子のスイッチ機構が重要な役割を果たしていることが明らかになってきました。特に、DNAを巻き付けるタンパク質の化学的変化である「ヒストン修飾」が、がんの性質や治療への反応性に影響を及ぼすことが注目されています。
ヒストン修飾の中でも、メチル化やアセチル化については、がん細胞の増殖や腫瘍微小免疫環境への影響が多く報告されてきましたが、シトルリン化に関する知見は限られています。
本研究では、ヒストンシトルリン化を担うPAD1/2/3/4/6のうち、膵がんにおいて高発現していたPAD2に着目しました。PAD2は本来、細胞質に多く存在しますが、特定の刺激によって核内へ移行し、遺伝子発現に影響を与えることが知られています。これまでPAD2は乳がんや皮膚がんなどでの発現異常が報告されてきましたが、膵がんにおけるヒストンシトルリン化とPAD2の役割、および腫瘍微小免疫環境への影響については、これまで明らかにされていませんでした。
研究成果
本研究では、膵がんの手術検体を用いた解析から、ヒストンシトルリン化およびPAD2の発現が強い膵がんでは、手術後の患者の予後(再発までの期間や生存期間)が短いことが明らかになりました(図2)。
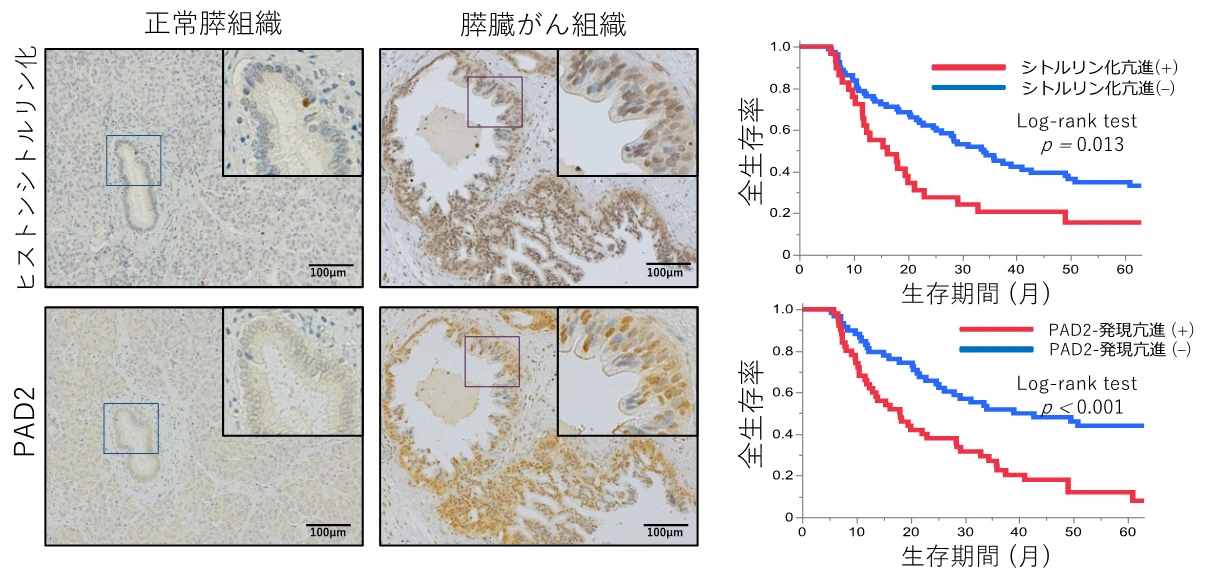
正常組織と比較して、膵がん組織ではヒストンシトルリン化およびPAD2の発現が亢進しており(左)、これらの発現レベルが高い症例では、術後の予後が不良であることが示された(右)。
また、膵がんにおいてPAD2がヒストンシトルリン化を介して複数の下流遺伝子の発現を制御していることを突き止めました。その中で、本グループはがん促進的な作用を有するPRUNE1という遺伝子に注目し、解析を行いました。PAD2が細胞質から核へ移行し、ヒストンシトルリン化を亢進することによってPRUNE1の発現が高まり、がん細胞の増殖を加速させることを発見しました。さらに、発現が亢進したPRUNE1によって、免疫抑制的なM2型マクロファージが腫瘍内に多く集積することも明らかになりました。すなわち、PAD2はヒストンのシトルリン化を介してがん細胞の遺伝子発現を変化させ、がんの悪性化と免疫からの逃避を同時に引き起こしていることが示唆されました。
そこで本グループは、膵がん細胞株においてPAD2の発現をノックダウンする、またはPAD2の働きを阻害する薬剤を用いたマウス実験を行い、PRUNE1の発現低下に伴ってM2型マクロファージの浸潤が減少し、膵がんの増殖が抑えられることを確認しました(図3)。
膵がん患者検体を用いた解析でも、核におけるPAD2発現、PRUNE1発現、M2型マクロファージの浸潤が互いに強く相関し、患者の予後不良につながることが確認されました。
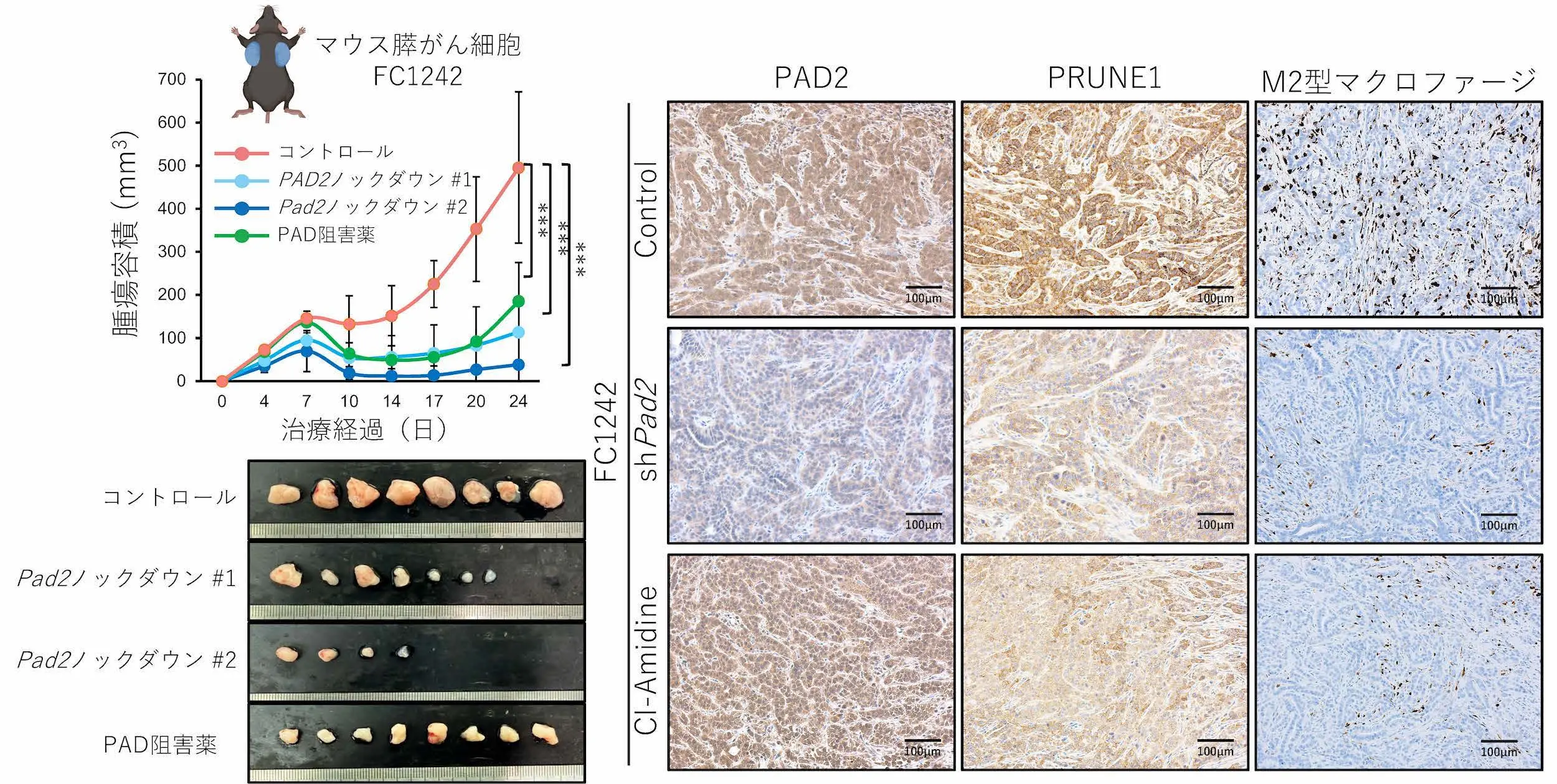
マウス膵がん細胞(FC1242)の正常免疫マウスに移植した実験において、PAD2のノックダウンまたはPAD阻害薬の投与は、腫瘍の増殖を抑制した(左)。免疫組織染色により、PAD2を抑制することでPRUNE1の発現およびM2型マクロファージ(Arginase-1陽性細胞)の浸潤が低下することが示された(右)。
社会的インパクト
膵がんは、がんの中でも特に悪性度が高く、(1)極めて進行が早いこと、(2)免疫抑制的な腫瘍微小免疫環境を有していることが、治療の難しさと予後不良の主な要因となっています。
本研究では、(1)がん細胞の増殖と、(2)がん免疫からの逃避を担うM2型マクロファージの腫瘍内浸潤の双方に関与する「PAD2-ヒストンシトルリン化-PRUNE1」経路を明らかにしました。この経路を標的とすることで、膵がんの進行と腫瘍免疫回避という2つの課題に同時にアプローチできる可能性が示されました。
本成果は、極めて予後の悪い膵がんに対する新たな治療戦略の創出につながる、重要な第一歩となることが期待されます。
今後の展開
本研究では、PAD2阻害剤が膵がんの腫瘍増大を抑制する効果に加え、抑制的な腫瘍微小免疫環境を改変し得る可能性が示唆されました。今後は、PAD2阻害剤の安全性や有効性を評価するための前臨床および臨床研究の推進が期待されます。
また、PAD2やその下流因子であるPRUNE1の発現をバイオマーカーとして活用することで、治療対象となる患者を層別化し、個別化医療への応用が可能になると考えられます。
さらに、免疫チェックポイント阻害剤[用語7]や既存の抗がん剤との併用効果を検証することも重要です。PAD2阻害によって引き起こされる腫瘍微小免疫環境の変化は、これらの治療効果を増強する可能性があり、膵がんに対する新たな複合治療戦略の確立につながることが期待されます。
付記
本研究は、文部科学省科学研究費助成事業(JP19H01055、JP23H02979、JP23K27670、JP24K02320、JP20K21627、JP22K19554)、国立研究開発法人日本医療研究開発機構(AMED)「肝炎等克服実用化研究事業」および「次世代がん医療創生研究事業」(P CREATE)、高松宮妃癌研究基金研究助成金などの支援のもとで行われたものです。
用語説明
- [用語1]
- PAD(Peptidylarginine Deiminase):アルギニン残基をシトルリンに変換する酵素群。ヒストンなどのタンパク質に対し、化学的な修飾である「シトルリン化」を引き起こす。PAD2はそのサブタイプの一つ。
- [用語2]
- エピゲノム修飾:DNAの塩基配列を変えることなく、遺伝子の働きを調節する仕組みの総称。ヒストン修飾やDNAメチル化などが含まれ、がん、発達、老化などと関連する。
- [用語3]
- ヒストンシトルリン化:ヒストンタンパク質のアルギニン残基が、PADによってシトルリンに変換される修飾。DNAの巻き付き状態を変化させ、遺伝子発現に影響を与えるエピゲノム修飾の一種。
- [用語4]
- PRUNE1:細胞の運動や増殖、がんの進行を促進するタンパク質。膵がんをはじめとする悪性腫瘍において高発現が報告されている。
- [用語5]
- M2型マクロファージ:がん組織などに集積し、免疫を抑制することでがんの進行を助けるマクロファージ(免疫細胞)の一種。免疫療法の効果を妨げる要因とされている。
- [用語6]
- 腫瘍微小免疫環境:がん組織を取り巻く免疫細胞、線維芽細胞、血管などの構成要素全体。がんの増殖や免疫回避に大きく影響する。
- [用語7]
- 免疫チェックポイント阻害剤:がんが免疫から逃れる仕組みを解除する抗がん剤。代表的なものに、抗PD-1抗体や抗CTLA-4抗体がある。
論文情報
- 掲載誌:
- Molecular Cancer Research
- タイトル:
- PAD2-Mediated Histone Citrullination Drives Tumor Progression by Enhancing Cell Proliferation and Modifying the Microenvironment in Pancreatic Cancer
- 著者:
- Kentaro Umemura, Yoshimitsu Akiyama, Shu Shimada, Megumi Hatano, Ayumi Kono, Koya Yasukawa, Atsushi Kamachi, Yosuke Igarashi, Shu Tsukihara, Yoshiaki Tanji, Koichiro Morimoto, Atsushi Nara, Masahiro Yamane, Keiichi Akahoshi, Hiroaki Ono, Akira Shimizu, Yuji Soejima, Minoru Tanabe, Daisuke Ban, Shinji Tanaka
研究者プロフィール
田中 真二 Shinji TANAKA
東京科学大学 大学院医歯学総合研究科 分子腫瘍医学分野 教授
研究領域:分子腫瘍医学、消化器外科学
秋山 好光 Yoshimitsu AKIYAMA
東京科学大学 大学院医歯学総合研究科 分子腫瘍医学分野 講師
研究領域:分子腫瘍医学、エピゲノム
梅村 謙太郎 Kentaro UMEMURA
東京科学大学 大学院医歯学総合研究科 分子腫瘍医学分野 大学院生
研究領域:分子腫瘍医学、消化器外科学
関連リンク
講師 秋山 好光
- yakiyama.monc@tmd.ac.jp