がん細胞の脂質代謝バランスの破綻が抗がん剤耐性を引き起こす機構を解明
コレステロールとスフィンゴミエリンの不均衡に着目した新しいがん治療標的の可能性
ポイント
- がん細胞が)上皮間葉転換(EMT)[用語1]を起こすと、脂質代謝のバランスが大きく変化し、抗がん剤に対する耐性を獲得することが明らかになりました。
- これまで未解明であったEMTと薬剤耐性を結びつける分子基盤について、脂質代謝という画期的な視点から明らかにした研究です。
- がん治療における新たな標的や評価法など、様々な治療戦略へと展開されることが期待されます。
概要
私たちのからだを構成する細胞の細胞膜は、コレステロールやスフィンゴミエリンなどの脂質が適切な比率で存在することで、その構造と機能が保たれています。東京科学大学(Science Tokyo)物質理工学院応用化学系の小西玄一准教授は、九州大学大学院 医学研究院生化学分野の松本惇志助教、池ノ内順一教授、愛知医科大学 病理学講座の猪子誠人 講師、愛知県がんセンターの細田和貴 遺伝子病理診断部部長、小島崇宏 泌尿器科部部長の研究グループと共同で、がん細胞が上皮間葉転換(epithelial to mesenchymal transition; EMT)を起こす過程で、脂質代謝のバランスが破綻し、それが抗がん剤耐性の獲得につながる分子機構を解明しました。
本研究では、EMTを誘導する転写因子Snailを発現したがん細胞において、スフィンゴミエリンの生合成に関わる酵素の発現が抑制され、その結果、細胞膜中のスフィンゴミエリン量が低下することを見出しました。一方でコレステロール量は大きく変化しないため、細胞内ではコレステロール/スフィンゴミエリン比が上昇します。この脂質バランスの異常により、細胞膜で過剰になったコレステロールが細胞内へ取り込まれるとコレステロール排出機構が働きます。その結果、抗がん剤が細胞外へ排出されやすくなることで、がん細胞が薬剤耐性を獲得することが明らかになりました。
さらに研究グループは、コレステロールを無害化する経路の1つである「コレステロールのエステル化」に着目しました。この反応を担う酵素ACATを阻害すると、Snailを発現する腎がん細胞では細胞増殖が選択的に抑制され、マウス移植腫瘍モデルにおいても腫瘍の成長が有意に低下することを確認しました。これらの結果は、EMTを起こしたがん細胞が抱える脂質代謝の弱点を突くことで、新たな治療戦略が開ける可能性を示しています。本研究成果は、がんの浸潤性や治療抵抗性の理解を脂質代謝の観点から前進させるものです。
本研究成果をまとめた論文は、2026年1月12日付で国際学術誌eLifeに掲載され、同誌のInsight記事として取り上げられました。
研究者からひとこと:
がん細胞が悪性化する過程では、遺伝子発現だけでなく、細胞膜を構成する脂質の比率が大きく変化します。今回の研究では、「コレステロールとスフィンゴミエリン」という脂質の組成比が、がん細胞の薬剤耐性を理解する鍵になることを示しました。脂質代謝という切り口から、これまでとは異なるがん治療の可能性を切り拓いていきたいと考えています。
(九州大学 池ノ内順一)
背景
がん細胞が浸潤・転移能を獲得する過程では、上皮細胞の性質を失い、間葉系細胞の特徴を併せ持つ状態へと変化する「上皮間葉転換(EMT)」が重要な役割を果たすことが知られています。EMTを誘導する転写因子であるSnailなどは、Eカドヘリンに代表される細胞間接着分子の発現を抑制することで、がん細胞に運動性や浸潤性を付与すると理解されてきました。
一方で、EMTはがん細胞の浸潤・転移に関与するだけでなく、抗がん剤に対する化学治療抵抗性の獲得にも寄与することが、臨床および基礎研究の両面から報告されてきました。しかし、EMTがどのような分子基盤を介して薬剤耐性を引き起こすのかについては、これまで十分に解明されていませんでした。多くの場合、EMTと薬剤耐性の関連は現象論的に捉えられており、その因果関係を説明する明確な分子機構は不明のままでした。
研究グループはこれまで、上皮細胞における細胞膜の構造や脂質組成、ならびに脂質と膜タンパク質の相互作用が、細胞機能や細胞応答を制御する重要な要素であることに着目して研究を進めてきました。細胞膜は単なる物理的な境界ではなく、シグナル伝達や物質輸送、膜タンパク質の機能制御を担う動的なプラットフォームです。このような観点から、研究グループは、EMTを起こしたがん細胞では、遺伝子発現の変化に加えて、細胞膜を構成する脂質の組成や比率そのものが変化しているのではないかと考えました。
特に、コレステロールとスフィンゴミエリンは強く相互作用し、細胞膜の秩序性や膜タンパク質の機能を支える中心的な脂質です。研究グループは、今回、この2つの脂質の「量」ではなく「比率」に着目し、EMTが細胞膜脂質バランスに与える影響を詳細に解析しました。本研究は、EMTを細胞形態や接着性の変化として捉える従来の枠組みを超え、脂質代謝の変容を通じて化学治療抵抗性が誘導される分子基盤を明らかにすることを目的として開始されました。
研究成果
本研究では、EMTががん細胞の脂質代謝および薬剤耐性に与える影響を明らかにするため、腎がん細胞をはじめとする培養細胞モデルを用いて、EMT誘導下での脂質組成変化とその機能的帰結を詳細に解析しました。
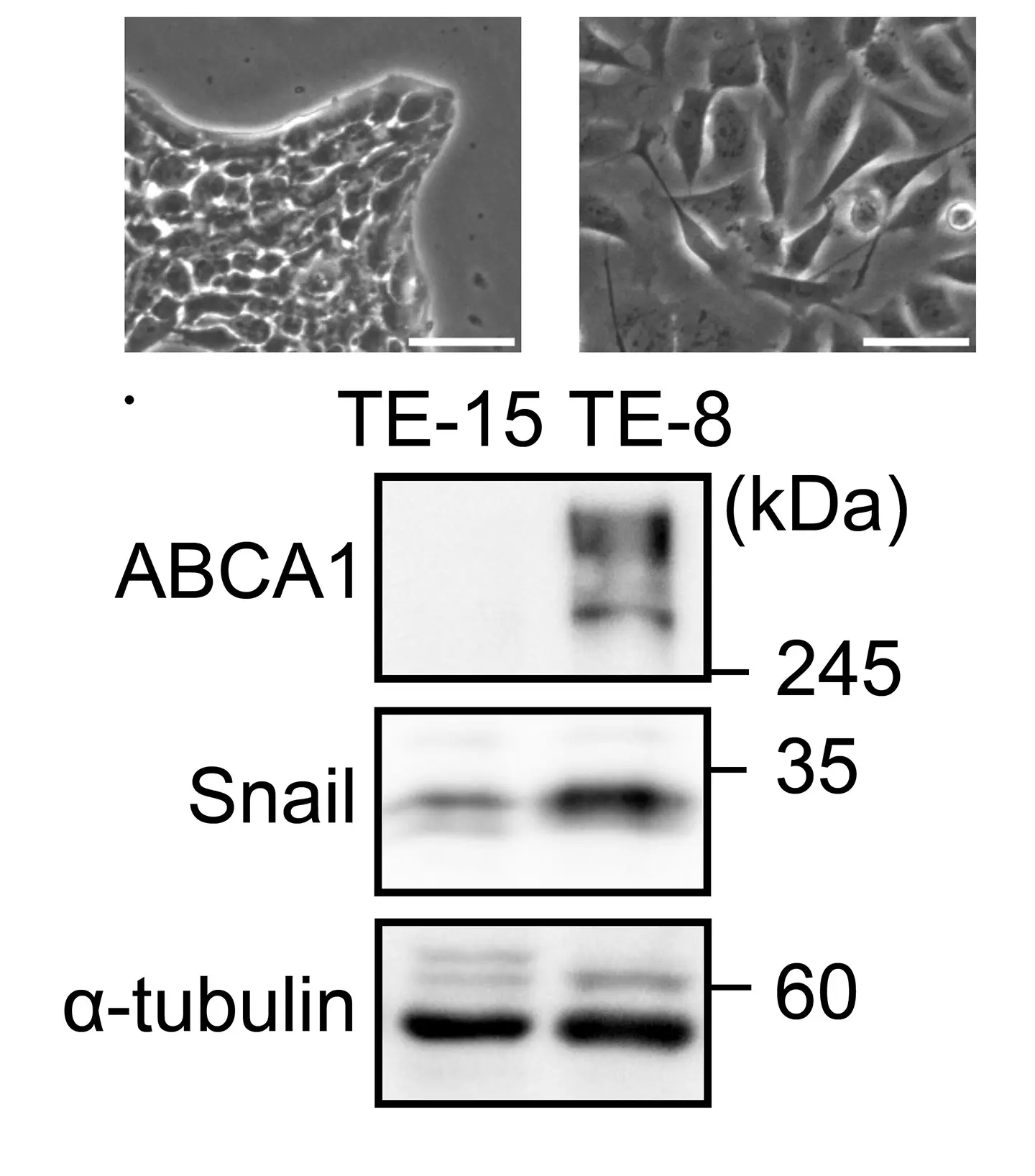
まず、EMTを誘導する転写因子Snailを発現させたがん細胞において、細胞膜脂質の組成を網羅的に解析したところ、スフィンゴミエリン量が顕著に低下していることが分かりました。この変化は、転写因子Snailによって、極長鎖脂肪酸型スフィンゴミエリン(VLCFA-SM)の合成に関与する酵素ELOVL7およびCERS3の発現が抑制されることに起因していました(参考図1)。一方で、細胞内のコレステロール総量には大きな変化が認められませんでした。以上のことから、結果として細胞膜におけるコレステロール/スフィンゴミエリン比が上昇していることが明らかになりました。
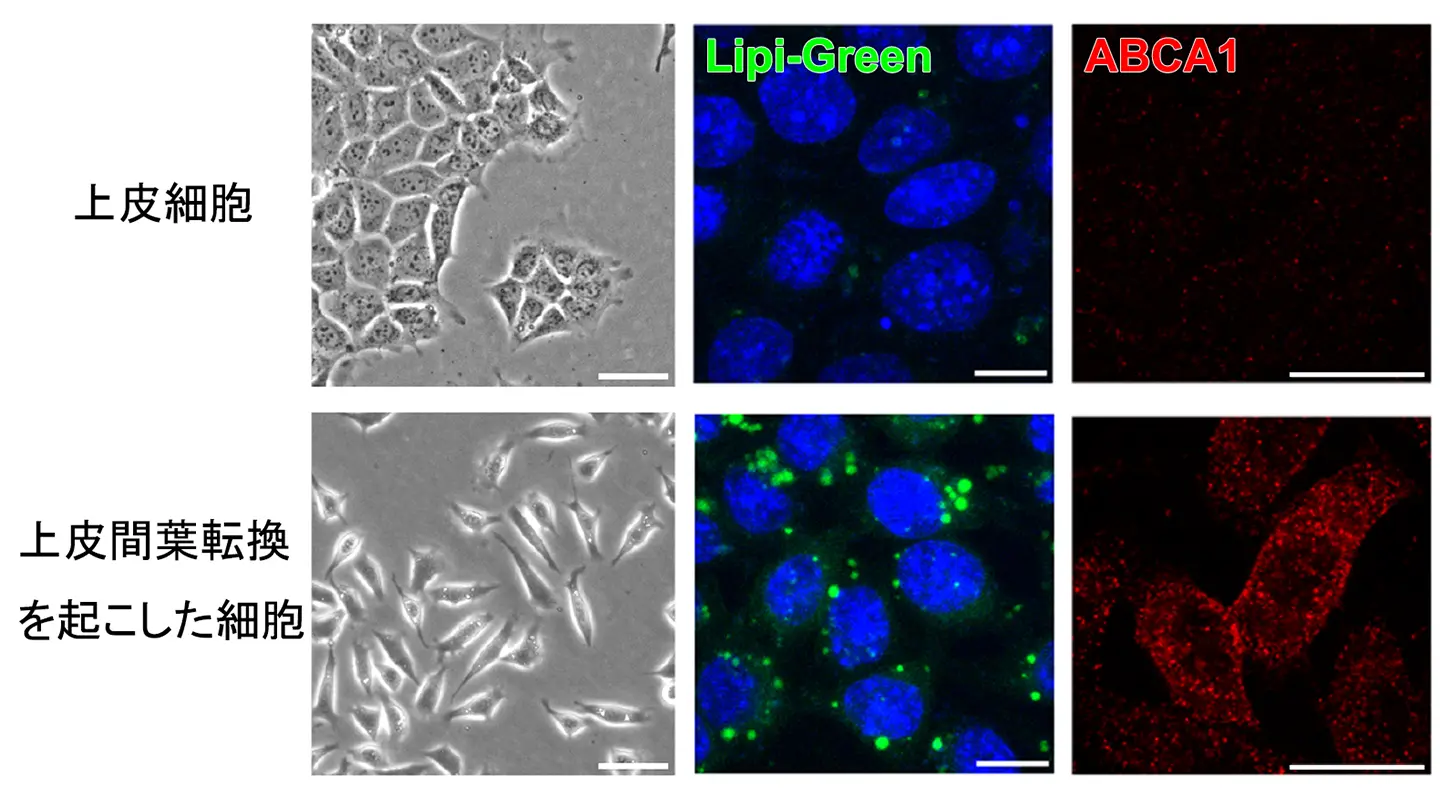
研究グループは次に、この脂質バランスの変化が何をもたらすかについて調べ、以下のことを明らかにしました。コレステロール/スフィンゴミエリン比の上昇は、細胞膜の秩序性を低下させ、スフィンゴミエリンとの相互作用を介して膜に結合・集積していたコレステロールは細胞膜に保持されなくなり、結果として、遊離コレステロールの増加を引き起こします。すると、遊離コレステロールは細胞膜から細胞内へと取り込まれ、細胞内のコレステロール代謝センサーである核内受容体LXRが活性化されます。その結果、コレステロール排出トランスポーターであるABCA1の発現が誘導され、抗がん剤が細胞外へ排出されやすい状態が形成されるということが分かりました(参考図2)。
実際に、Snailを発現したがん細胞では、複数の抗がん剤に対して感受性が低下しており、ABCA1の機能を抑制すると薬剤感受性が回復することを確認しました。これらの結果から、EMTによる薬剤耐性は、特定の耐性遺伝子の直接的な誘導ではなく、脂質代謝バランスの破綻に対する適応応答として二次的に生じることが明らかになりました。
さらに研究グループは、Snail陽性がん細胞が、増加した遊離コレステロールの毒性を回避するため、コレステロールをエステル化して脂肪滴[用語2]に蓄積する経路にも強く依存していることに着目しました。この反応を担う酵素ACATを阻害すると、Snailを発現するがん細胞では選択的に細胞増殖が抑制され、EMTを起こしていない細胞には比較的影響が少ないことが分かりました。さらに、Snail陽性腎がん細胞をマウスに移植した腫瘍モデルにおいても、ACAT阻害によって腫瘍の成長が有意に抑制されることを確認しました。これらの結果は、EMTを起こしたがん細胞が、脂質代謝の特定の経路に依存せざるを得ない「脆弱な状態」にあることを示しています。
本研究は、EMTが細胞の形態や運動性を変化させるだけでなく、細胞膜脂質バランスを破綻させることで薬剤排出機構を活性化し、結果として化学治療抵抗性を誘導するという一連の分子機構を明らかにしました(参考図3)。これは、これまで未解明であったEMTと薬剤耐性を結びつける分子機構に対し、脂質代謝という新しい視点から答えを提示するものです※1)。
脂質層の成分分析には、2024年に東京科学大学と九州大学で発表した蛍光色素が使用されています。
今後の展開
本研究により、上皮間葉転換(EMT)を起こしたがん細胞が、脂質代謝バランスの破綻という不利な状態を抱えながら生存していることが明らかになりました。これは、EMTを単に悪性化の指標として捉えるのではなく、がん細胞が特定の代謝経路に強く依存せざるを得ない状態へと追い込まれていると捉え直す視点を提供します。今後は、EMTを直接抑制することを目指すのではなく、EMTを起こしたがん細胞が依存している脂質代謝経路を標的とすることで、より選択的ながん治療戦略の構築が期待されます。本研究で示したコレステロールのエステル化経路は、その有力な候補の1つであり、既存の抗がん剤との併用療法によって、化学治療抵抗性を克服できる可能性があります。
また、コレステロール/スフィンゴミエリン比やABCA1の発現レベルといった脂質代謝指標は、がん細胞がEMT様状態にあるかどうか、あるいは薬剤耐性を獲得しているかを評価するための新しいバイオマーカーとなる可能性があります。これらの指標を用いることで、患者ごとに最適な治療法を選択する個別化医療や層別化治療への応用も期待されます。
さらに、EMTに伴う脂質代謝の再編成は、特定のがん種に限られた現象ではない可能性があります。今後は、がん種や組織特異性の違いを検討するとともに、がん微小環境や三次元組織構造の中で、この脂質代謝依存性がどのように制御されているのかを明らかにしていく必要があります。
本研究で提示した「EMTによる脂質代謝バランスの破綻を起点とした薬剤耐性」という概念は、がん生物学における従来の理解を拡張し、形態変化・代謝・治療応答を統合的に捉える新しい枠組みを提供するものです。今後、脂質代謝という切り口からEMT研究を再解釈することで、がんの浸潤性や治療抵抗性に対する新たな介入戦略が開けることが期待されます。
参考図
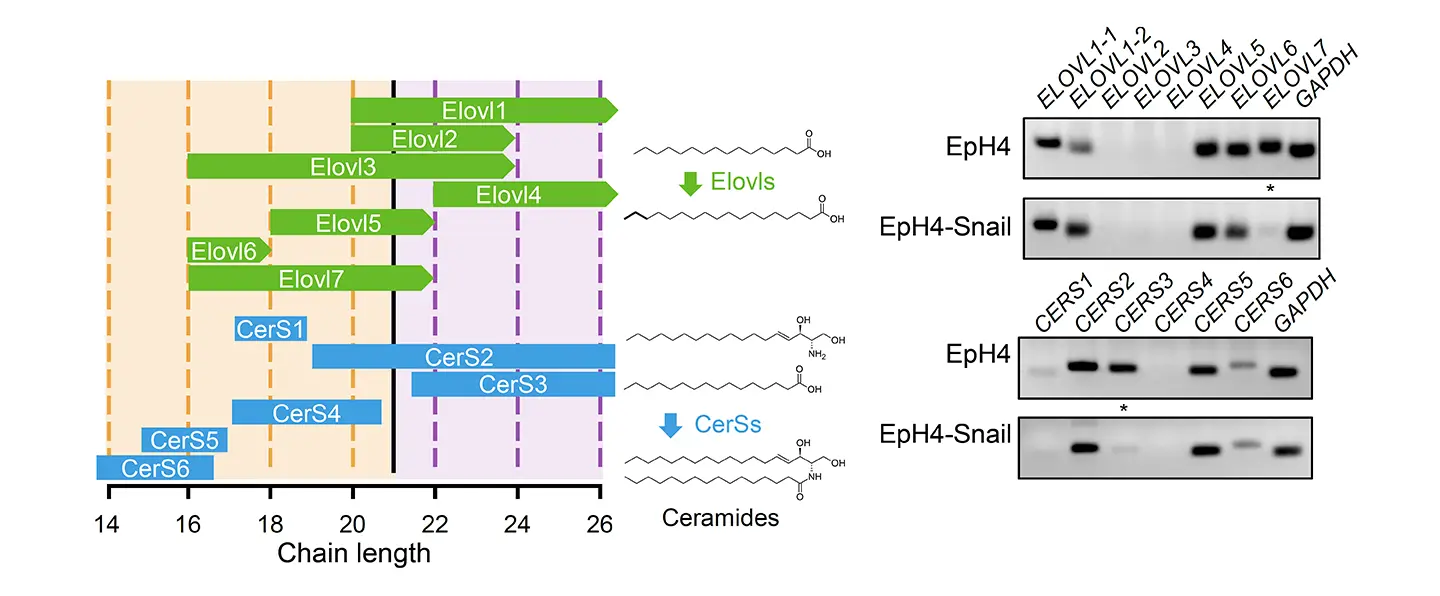
スフィンゴミエリンに含まれる脂肪酸鎖の長さは、脂肪酸伸長酵素(ELOVL)およびセラミド合成酵素(CerS)によって厳密に制御されています(左図)。特に、ELOVL7やCerS3は、極長鎖脂肪酸型スフィンゴミエリンの合成に重要な役割を担っています。右図は、マウス上皮細胞株EpH4と、EMTを誘導する転写因子Snailを発現させたEpH4-Snail細胞における、ELOVLおよびCerSファミリー遺伝子の発現を比較したものです。Snailを発現した細胞では、ELOVL7およびCerS3の発現が顕著に抑制されており、極長鎖脂肪酸型スフィンゴミエリンの合成能が抑制されることが分かりました。これらの結果は、EMTによって、極長鎖脂肪酸型スフィンゴミエリンの量が減少することを意味しています。
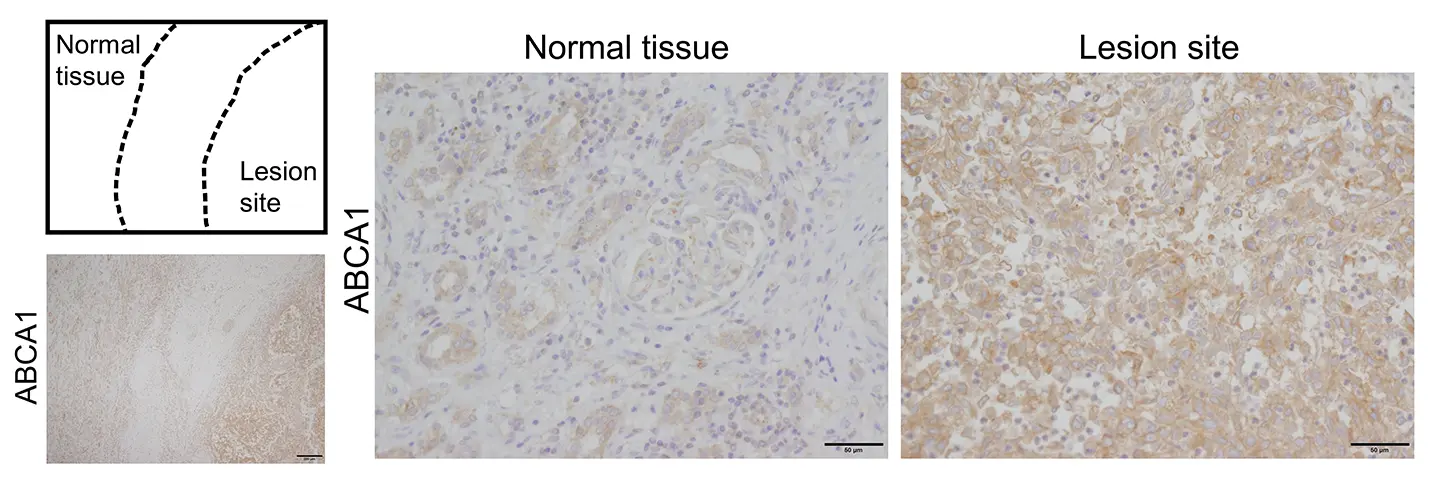
腎細胞がん(clear cell renal cell carcinoma; ccRCC、Fuhrman grade 3)患者から外科的に切除された腎組織を用い、コレステロール排出トランスポーターABCA1の免疫組織化学染色を行いました。左上図は、同一切片内における正常組織領域と病変部位の位置関係を示す模式図です。低倍率像(左下画像)では、病変部においてABCA1染色シグナルが全体的に強くなっていることが確認されます。高倍率像では、正常腎組織に比べ、腫瘍病変部においてABCA1の発現が顕著に亢進している様子が観察されました(右画像)。正常組織では、腎尿細管および糸球体における既知のABCA1発現パターンが確認されており、本染色の特異性が担保されています。これらの結果は、本研究で培養細胞モデルにおいて示されたEMTに伴うABCA1発現誘導が、実際のヒト腫瘍組織においても起こっている可能性を支持するものです。
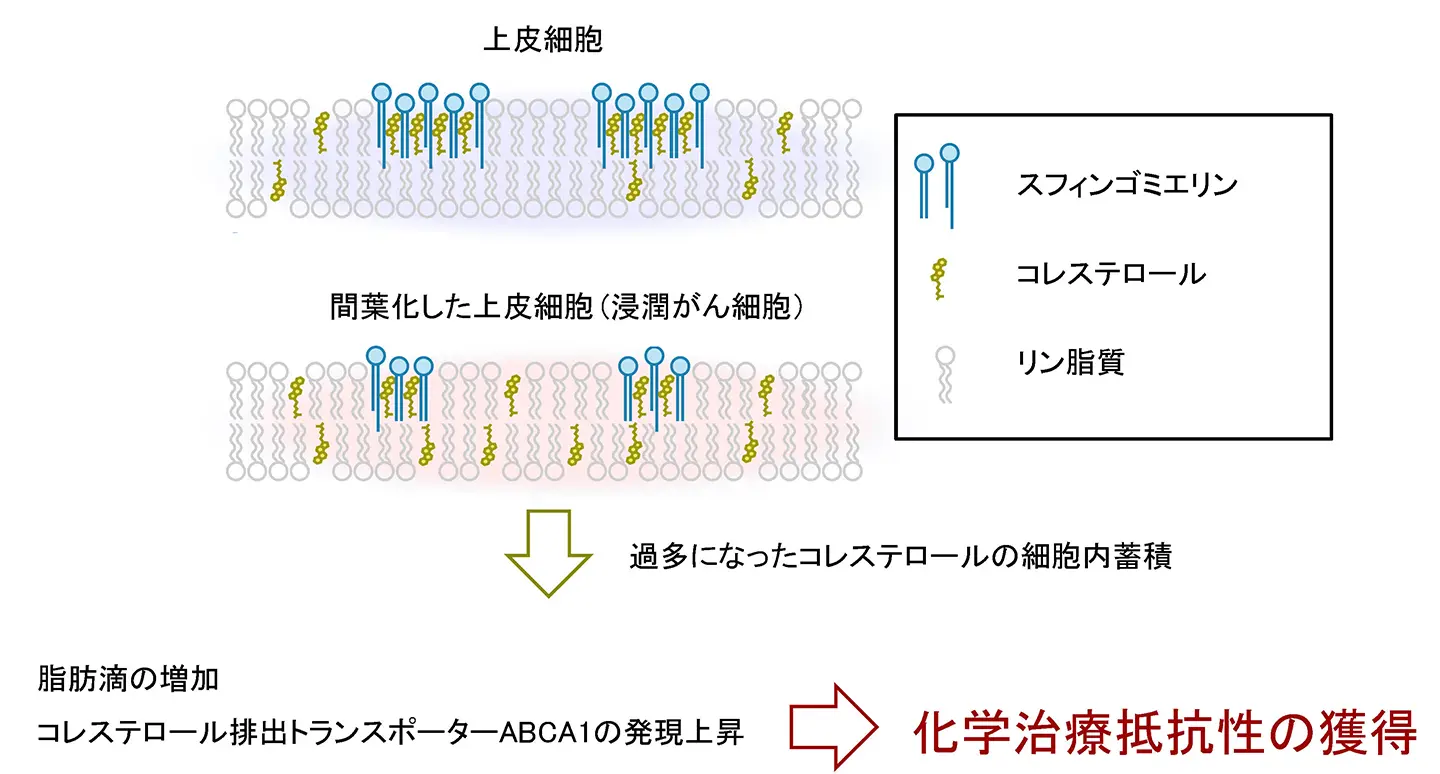
本研究で明らかになった、EMTに伴う脂質代謝変化と化学治療抵抗性獲得の分子機構を模式的に示しています。上皮細胞(EpH4)では、極長鎖脂肪酸型スフィンゴミエリン(VLCFA-SM)がコレステロールと相互作用することで、秩序だった細胞膜構造が維持されています。一方、Snailの発現によりEMT様状態へ移行した細胞(EpH4-Snail)では、VLCFA-SMの生合成が低下し、細胞膜中のスフィンゴミエリン量が減少します。その結果、スフィンゴミエリンとの相互作用を介して膜に結合・集積していたコレステロールが細胞膜に保持されなくなり、遊離型コレステロールが増加し、細胞膜の秩序性が低下します。この遊離型コレステロールの増加は、コレステロールの細胞内取り込みを促進し、細胞内コレステロールセンサーを活性化します。その下流で、コレステロールを脂肪滴として蓄積する経路が亢進するとともに、コレステロール排出トランスポーターABCA1の発現が誘導されます。ABCA1の発現によって、抗がん剤の細胞外排出が促進され、がん細胞は化学治療抵抗性を獲得します。本図は、EMTが細胞形態や浸潤能の変化にとどまらず、細胞膜脂質バランスの破綻を起点として薬剤耐性を誘導するという、本研究の中心的な概念を示しています。
付記
本研究は、AMED革新的先端研究開発支援事業 FORCE(21444781)、文部科学省 日本学術振興会 科学研究費(JP22KJ2374、 JP25K18465、JP25K22454、JP25H01325、 JP25H00994)、科学技術振興機構 創発的研究若手挑戦事業(JPMJFR204L)、小野医学研究財団等の支援を受けて行われました。
用語説明
- [用語1]
- 上皮間葉転換(epithelial-to-mesenchymal transition; EMT):上皮細胞が通常持っている細胞同士の強い接着性を失い、間葉系細胞のような運動性や可塑性の高い性質を獲得する現象です。発生過程や創傷治癒といった生理的な場面では、組織形成や修復に重要な役割を果たします。一方で、がんにおいては、EMTを起こしたがん細胞が浸潤・転移能を獲得するだけでなく、抗がん剤に対する抵抗性や、がん幹細胞様の性質を示すことが知られています。しかし、EMTがどのような分子機構を介して治療抵抗性を引き起こすのかについては、長らく不明な点が残されていました。本研究は、EMTが細胞膜脂質のバランスを変化させることで、薬剤排出機構を活性化し、化学治療抵抗性を誘導するという新しい分子基盤を明らかにしました。
- [用語2]
- 脂肪滴(lipid droplet):細胞内に存在する中性脂質(コレステロールエステルやトリアシルグリセロールなど)を蓄積する小器官です。過剰な脂質の毒性を回避するための貯蔵庫として機能するとともに、細胞の脂質代謝やストレス応答の制御に重要な役割を果たします。
論文情報
- 掲載誌:
- eLife
- タイトル:
- Chemotherapy resistance due to epithelial-to-mesenchymal transition is caused by abnormal lipid metabolic balance
- 著者:
- Atsushi Matsumoto†, Akihito Inoko†, Takuya Tanaka, Gen-Ichi Konishi, Waki Hosoda, Takahiro Kojima, Koji Ohnishi, Junichi Ikenouchi
(†:第一共同著者)
関連リンク
東京科学大学 総務企画部 広報課
- Tel
- 03-5734-2975
- Fax
- 03-5734-3661
- media@adm.isct.ac.jp