ポイント
- アルツハイマー病などの神経疾患を治療するアンチセンス核酸医薬(ASO)において、有効性を維持しながら安全性を大幅に高める新技術を開発。
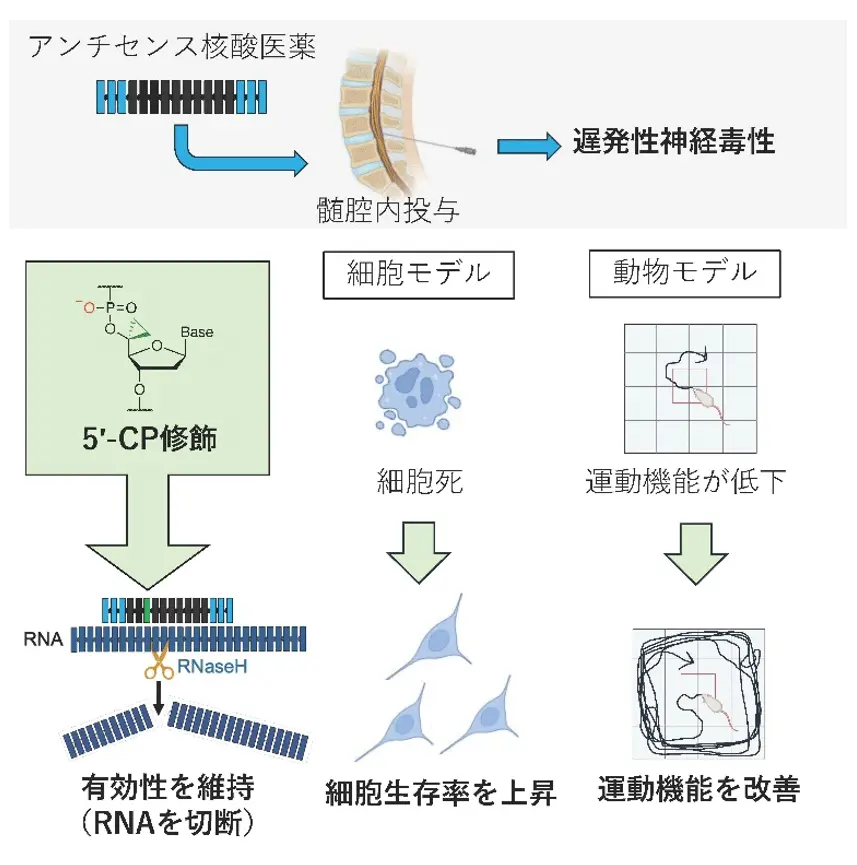
- 新規人工核酸「5′-cyclopropylene(5′-シクロプロピレン、5′-CP)」をASOの適切な部位に組み込むことで、マウス・ヒト神経細胞およびマウス・ラットを用いた実験において、創薬上の課題である遅発性神経毒性が改善するメカニズムを発見。
- 本技術により、ASOの投与量制限を緩和できる可能性があり、アルツハイマー病をはじめとする幅広い中枢神経疾患に対する治療薬開発の加速が期待される。
概要
アンチセンス核酸医薬(ASO)[用語1]は、主にRNAの働きを制御する薬であり、アルツハイマー病や筋萎縮性側索硬化症(ALS)を含む多くの神経疾患に対する新たな治療薬候補として注目されています。しかし、髄腔内投与後に遅発性で重大な神経系副作用(中枢神経毒性)が現れることが課題となっています。
東京科学大学 大学院医歯学総合研究科 脳神経病態学分野および核酸・ペプチド創薬治療研究センターの横田隆徳特任教授、吉岡耕太郎特任講師、Su Su Lei Mon(ス ス レイ モン)特任研究員、黒田隆之大学院生らの研究グループは、大阪大学大学院薬学研究科 生物有機化学分野の小比賀聡教授、山口卓男講師らのグループと共同研究で、新しい人工核酸「5′-cyclopropylene(5′-シクロプロピレン、5′-CP)[用語2]」をASOに組み込むことで、有効性を保ちながら神経系副作用を大きく軽減できることを、神経細胞およびマウス・ラットを用いた実験で明らかにしました。
さらに、副作用軽減のメカニズムを検討し、神経細胞内におけるパラスペックルタンパク[用語3]の異常な局在が関与していることを突き止めました。
本技術によりASOの安全性が向上し、将来的により多くの神経疾患に対するASOの開発につながることが期待されます。
この研究成果は、国際科学誌「Molecular Therapy - Nucleic Acids」において、2025年9月12日(現地時間)にオンライン版で発表されました。
背景
ASOは、主にRNAの機能を制御し、病気の原因となる遺伝子発現を調整する新しいタイプの薬です。日本でも、神経難病の一つである筋萎縮性側索硬化症(ALS)のうち、SOD1遺伝子に変異を有する患者向けの治療薬としてトフェルセンが承認されるなど、次世代治療法として大きな注目を集めています。
しかし、ASOを髄腔内に投与すると、神経系の副作用、いわゆる神経毒性を生じることがあり、創薬上の課題となっています。特に、投与後数日から数週間を経て現れる「遅発性」の神経障害(重度の下肢麻痺や感覚障害)は、実際の患者でも報告されており、克服すべき重要な課題です。
ASOによる毒性の一因として、ASOとタンパク質との異常な相互作用が関与することが、これまでの研究で示唆されています[参考文献1]。さらに、ASOの適切な部位に人工核酸を導入することで、この相互作用を制御し、副作用を減らせる可能性も報告されています。しかし、中枢神経系を標的とするASOにおいては、このような技術の検討は十分に行われていませんでした。
そこで本研究では、大阪大学大学院薬学研究科の小比賀教授らが開発した新たな人工核酸「5′-CP」をASOに導入し、ASOによる遅発性神経毒性を低減できるかどうかを検証しました。
研究成果
まず、神経細胞にさまざまなASOを導入(トランスフェクション)した際の細胞毒性を検討しました。さらに、マウスおよびラットを用い、脳室内または髄腔内にこれらのASOを投与し、遅発性の神経行動異常(遅発性神経毒性)を詳細に評価しました。この結果から、ASOによる遅発性神経毒性を再現できる細胞モデルおよび齧歯(げっし)類モデル(マウス・ラット)を確立しました。
次に、これらのモデルを用いた検証により、ASOの特定の位置に「5′-CP」と呼ばれる人工核酸を導入することで、有効性を維持しつつ遅発性神経毒性を低減できることを発見しました。
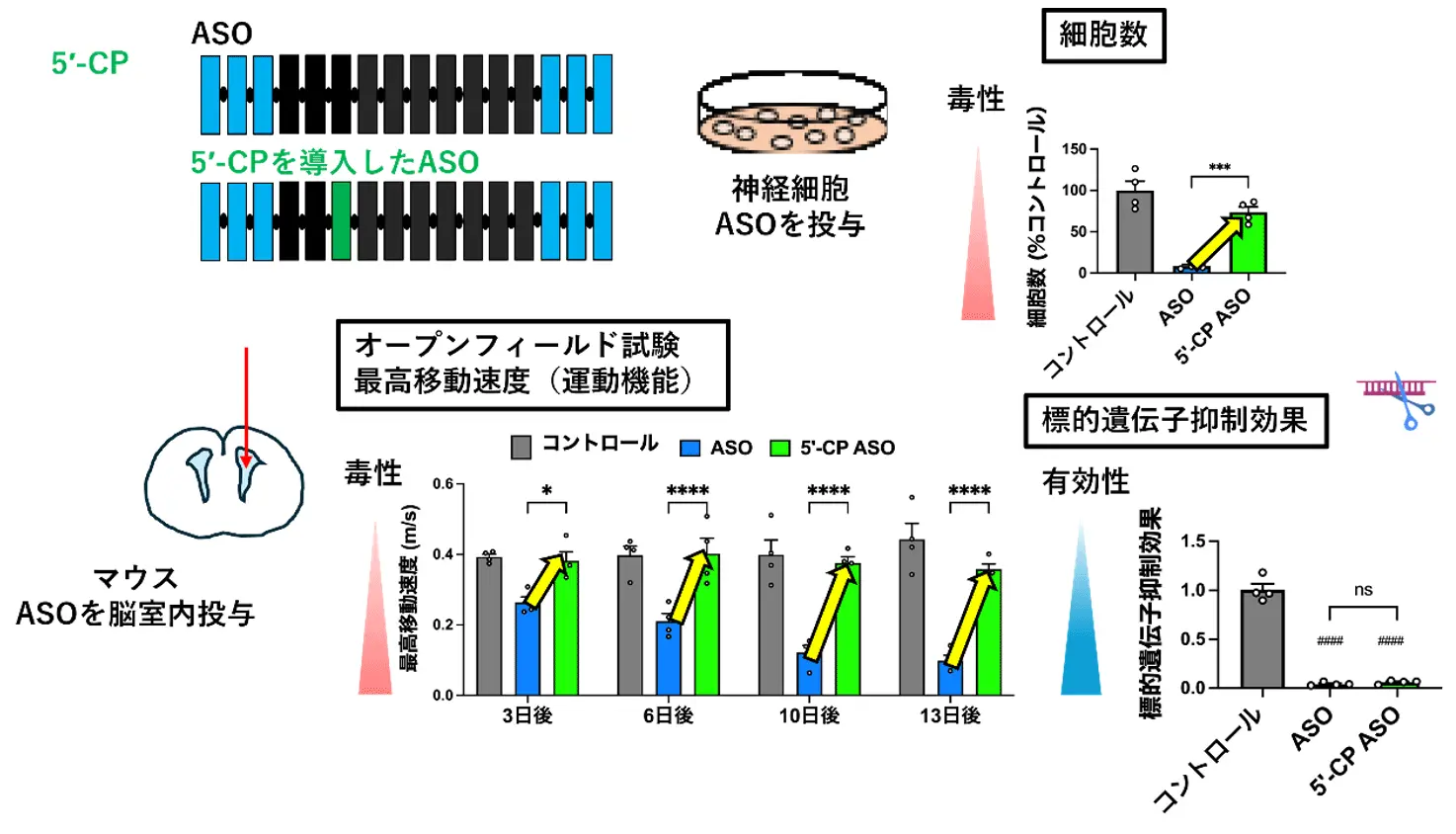
さらに、この毒性の背景には、神経細胞内でパラスペックルタンパクが本来の場所ではなく核小体に異常局在する現象が関与していることを確認しました。5′-CPの導入により、この異常局在が正常化されることも明らかにしました。
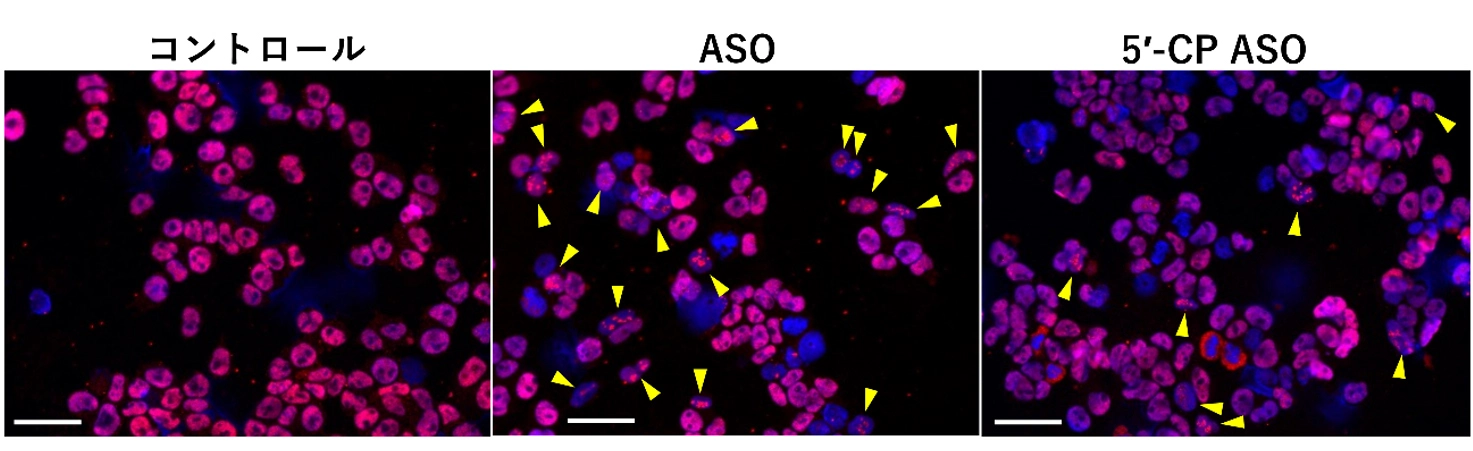
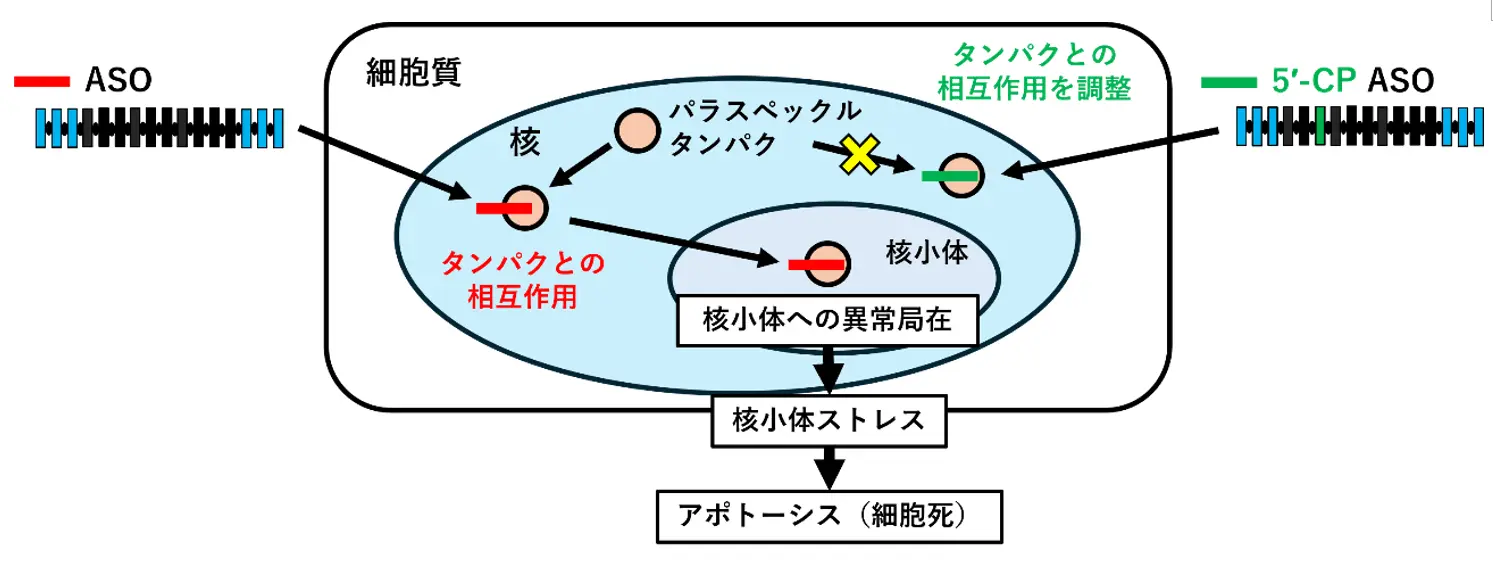
投与されたASO(赤線で表示)がパラスペックルタンパクと相互作用すると、核小体へ異常局在し、これがストレスとなってアポトーシスが生じてしまう。一方、5′-CPを導入したASO(緑線で表示)では、パラスペックルタンパクとの相互作用が調整され、核小体への異常局在が低減される。
社会的インパクト
ASOは、根本的な治療法が存在しない多くの難治性神経疾患に対する新たな治療薬として期待されています。しかし、高い有効性を得るために投与量を増やすと副作用が生じるというトレードオフの関係があり、一部の疾患では治験が中断される事例も報告されていました。このため、副作用の回避が大きな課題となっていました。
本研究では、ASOによる神経系の副作用を有効性を維持したまま回避できる可能性が示されました。これにより、ASOの投与量制限が緩和され、これまで治療が困難だった多様な神経疾患に対して、ASOを活用した新規治療薬の開発が大きく前進すると期待されます。
さらに、ASOによる神経毒性のメカニズムに迫った今回の知見は、毒性と分子構造との関係(毒性-構造相関)に関する理解を深め、ASOのさらなる技術開発の推進にも貢献すると考えられます。
今後の展開
本技術は、ASOにとどまらず、siRNA(小分子干渉RNA:small interfering RNA)など他の種類の核酸医薬にも応用可能な基盤技術であると期待されており、その適用範囲を広げるための追加検証を予定しています。今後は、こうした独自技術を活用し、特定の疾患を対象とした治療薬の開発にも積極的に取り組んでいきます。
付記
本研究は、国立研究開発法人日本医療研究開発機構(AMED)「先端的バイオ創薬等基盤技術開発事業(JP20am0401006、JP19am0401003)」、「脳とこころの研究推進プログラム(領域横断的かつ萌芽的脳研究プロジェクト、JP21wm0525032)」、国立研究開発法人科学技術振興機構(JST)「創発的研究支援事業(JPMJFR216H)」、日本学術振興会(JSPS)「科研費助成事業(基盤研究(B)JP22H02979、挑戦的研究(開拓)JP20K21882)」の支援のもとで行われました。
参考文献
- [1]
- Shen W, De Hoyos CL, Migawa MT, Vickers TA, Sun H, Low A, Bell TA 3rd, Rahdar M, Mukhopadhyay S, Hart CE, Bell M, Riney S, Murray SF, Greenlee S, Crooke RM, Liang XH, Seth PP, Crooke ST. Chemical modification of PS-ASO therapeutics reduces cellular protein-binding and improves the therapeutic index. Nat Biotechnol. 2019 Jun;37(6):640-650.
用語説明
- [用語1]
- アンチセンス核酸医薬(ASO):自身に相補的なRNA配列に結合し、その機能を調整する1本鎖の人工核酸。細胞内のRNAを直接標的とすることができ、従来の低分子医薬や抗体医薬では治療が難しい病気に対しても応用が可能なため、次世代の治療薬として注目されている。
- [用語2]
- 5′-cyclopropylene(5′-シクロプロピレン、5′-CP):大阪大学大学院薬学研究科の小比賀聡教授、山口卓男講師らが開発した、核酸分子の糖部分に導入される新しい化学修飾。糖部5′位に立体的に大きな構造を持つため、ASOとタンパク質との相互作用をより大きく変化させることが期待されている。さらに、ヌクレアーゼ(核酸分解酵素)に対する耐性を高め、ASOの生体内での安定性を向上させる効果もある。
- [用語3]
- パラスペックルタンパク:細胞の核内にある「パラスペックル」という非膜構造体を構成するタンパク質。パラスペックルは遺伝子の発現調節など、多様な細胞機能に関与しており、その構成タンパク質の欠失や異常な場所への移動が確認されると、細胞機能への悪影響が懸念される。
論文情報
- 掲載誌:
- Molecular Therapy - Nucleic Acids
- タイトル:
- Unraveling and controlling late-onset neurotoxicity of CNS-targeted antisense oligonucleotides through strategic chemical modifications
- 著者:
- Takayuki Kuroda, Kotaro Yoshioka, Su Su Lei Mon, Maho Katsuyama, Kumiko Sato, Eriko Isogai, Kie Yoshida-Tanaka, Rintaro Iwata-Hara, Takao Yamaguchi, Satoshi Obika, Takanori Yokota
研究者プロフィール
黒田 隆之 Takayuki KURODA
東京科学大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科) 大学院生
研究分野:神経内科学、核酸医薬

吉岡 耕太郎 Kotaro YOSHIOKA
東京科学大学 国際医工共創研究院
核酸・ペプチド創薬治療研究センター 特任講師
脳神経病態学分野兼担
研究分野:神経内科学、核酸医薬

ス・ス・レイ・モン Su Su Lei Mon
東京科学大学 国際医工共創研究院
核酸・ペプチド創薬治療研究センター 特任研究員
研究分野:神経内科学、核酸医薬

横田 隆徳 Takanori YOKOTA
東京科学大学 大学院医歯学総合研究科
脳神経病態学分野 特任教授/名誉教授
研究分野:神経内科学、核酸医薬

山口 卓男 Takao YAMAGUCHI
大阪大学 大学院薬学研究科 生物有機化学分野 講師
研究分野:生物有機化学、核酸化学

小比賀 聡 Satoshi OBIKA
大阪大学 大学院薬学研究科 生物有機化学分野 教授
研究分野:生物有機化学、核酸化学

関連リンク
お問い合わせ
東京科学大学 国際医工共創研究院 核酸・ペプチド創薬治療研究センター
特任講師 吉岡 耕太郎
- Tel
- 03-5803-5234
- Fax
- 03-5803-0169
- kotanuro@tmd.ac.jp