ポイント
- 投与したmRNAからのタンパク質産生が、ホルモンなどの液性因子の量に応じて調節される、新しいタイプのmRNA医薬を開発しました。
- 液性因子を検知するためのタンパク質を産生するmRNA、翻訳を制御するためのタンパク質を産生するmRNA、薬効タンパク質を産生する制御対象mRNAの3種を組み合わせることで、細胞周辺の環境に応じたタンパク質産生の自律的な制御が可能となりました。
- 症状や病態の変化に応じて、薬効タンパク質の産生量を体内で自動的に最適化できる、新しいタイプのmRNA創薬への展開が期待されます。
概要
東京科学大学(Science Tokyo)総合研究院 生体材料工学研究所の中西秀之助教(現 大阪大学 感染症総合教育研究拠点(CiDER)特任講師(常勤))と位髙啓史教授(現 大阪大学 感染症総合教育研究拠点(CiDER)教授、東京科学大学 総合研究院 核酸・ペプチド創薬治療研究センター(TIDEセンター)特命教授を兼任)は、ホルモンなどの液性因子を検知し、それに応じて投与されたmRNAからタンパク質への翻訳[用語1]が調節される、新しいタイプのmRNA医薬を開発しました。
このmRNA医薬は、液性因子の検知を担う受容体部分を変更することで、さまざまな液性因子に対応可能です。抗利尿ホルモンや疼痛関連分子など、種々の液性因子を検知し、それに応じてmRNAからのタンパク質産生量が制御できることを確認しました。また、炎症の指標となるプロスタグランジンE2[用語2]を検知対象とし、抗炎症性タンパク質を産生するmRNAを制御することで、炎症シグナルを抑制できることも示されました。
このように、日々変化する病状や病態を反映する液性因子を検知し、それに応じてmRNAからのタンパク質産生量を調節することにより、薬剤やワクチンとしての効果や安全性を高める、新たな創薬アプローチにつながることが期待されます。
本成果は、2025年6月6日(現地時間)付で、Springer Natureのオープンアクセスジャーナル「NPG Asia Materials」誌に掲載されました。
背景
mRNAはタンパク質の産生に必要な情報をコードする分子であり、細胞内に常に存在していますが、人工的に合成することもできます。更に、この人工的に合成したmRNAを投与することで、体内で薬やワクチンとして機能するタンパク質を産生させることも可能です。
この人工mRNAを利用した最初の成功例が、2020年に実用化された新型コロナウイルスワクチンです。また、mRNAは配列を変更するだけでさまざまなタンパク質を産生できるため、他の感染症に対するワクチンや、がんをはじめとする多くの疾患に対する治療薬としての応用も期待されています。
一方で、現在のmRNA医薬・ワクチンでは、細胞内に取り込まれた後のタンパク質産生を制御することはできません。しかし、これを制御できるようになれば、薬としての有効性や安全性を高める上で、重要な機能となります。特に、病状や病態を反映してmRNAからのタンパク質産生量を調節できれば、従来の創薬の枠を超えた、新しいタイプの薬やワクチンの開発につながります。
本研究ではこのような目標のもと、病態の指標となる液性因子を検知し、それに応じてmRNAからのタンパク質産生量を制御するシステムの開発を目指しました。
研究成果
このシステムは、以下の3種類のmRNAによって構成されています(図1)。
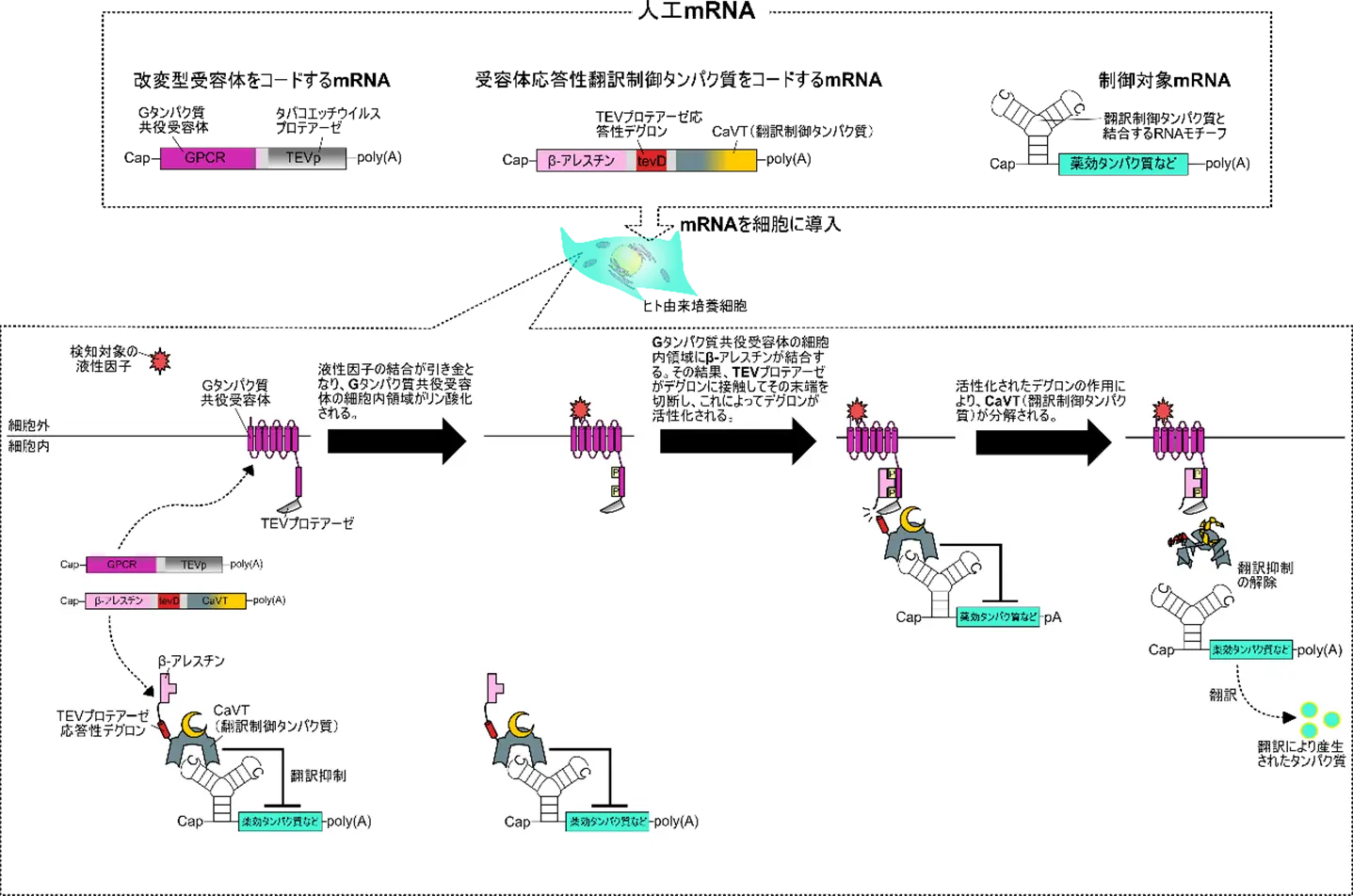
- 改変型受容体mRNA:液性因子を検知するためのGタンパク質共役受容体[用語3]と、特定のタンパク質を切断する酵素であるTEVプロテアーゼ[用語4]を融合させたタンパク質をコードするmRNAです。 Gタンパク質共役受容体には非常に多くの種類があり、検知したい液性因子に応じて適切な受容体を選ぶことが可能です。また、この受容体の細胞内領域は、液性因子を検知するとリン酸化される性質を持っており、リン酸化された領域が後述のβ-アレスチン[用語5]の結合標的となります。
- 受容体応答性翻訳制御タンパク質mRNA:β-アレスチン、TEVプロテアーゼ応答性デグロン[用語6]、および翻訳制御タンパク質CaVT[用語7]を融合したタンパク質をコードするmRNAです。β-アレスチンは、リン酸化されたGタンパク質共役受容体の細胞内領域に結合する機能を持ちます。一方、TEVプロテアーゼ応答性デグロンは、TEVプロテアーゼにより切断されることで、翻訳制御タンパク質全体を急速に分解させる役割を担います。
- 制御対象mRNA:薬やワクチンとして機能するタンパク質(薬効タンパク質)をコードするのが、この制御対象mRNAです。このmRNAにはMS2結合モチーフ[用語8]と呼ばれる領域が含まれており、前述のCaVTがこのモチーフに結合することで、翻訳を抑制または活性化します。CaVTが翻訳を抑制するか活性化するかは、制御対象mRNAの設計によって選択可能ですが、以下ではCaVTが翻訳を抑制する例に焦点を当てて解説します。
検知対象の液性因子が存在しない場合、制御対象mRNAの翻訳は、受容体応答性翻訳制御タンパク質に含まれるCaVTによって抑制されており、その結果、薬効タンパク質の産生量は低く抑えられています。
一方、改変型受容体が液性因子を検知すると、この受容体の細胞内領域が、受容体応答性翻訳制御タンパク質に含まれるβ-アレスチンと結合します。その結果、改変型受容体に含まれるTEVプロテアーゼと、受容体応答性翻訳制御タンパク質に含まれるTEVプロテアーゼ応答性デグロンが接触します。この接触により、TEVプロテアーゼ応答性デグロンの分解促進能がTEVプロテアーゼによって活性化され、受容体応答性翻訳制御タンパク質は急速に分解されます。
このようにして制御対象mRNAは翻訳抑制から解放され、薬効タンパク質の産生量が増加するという仕組みです(図1)。
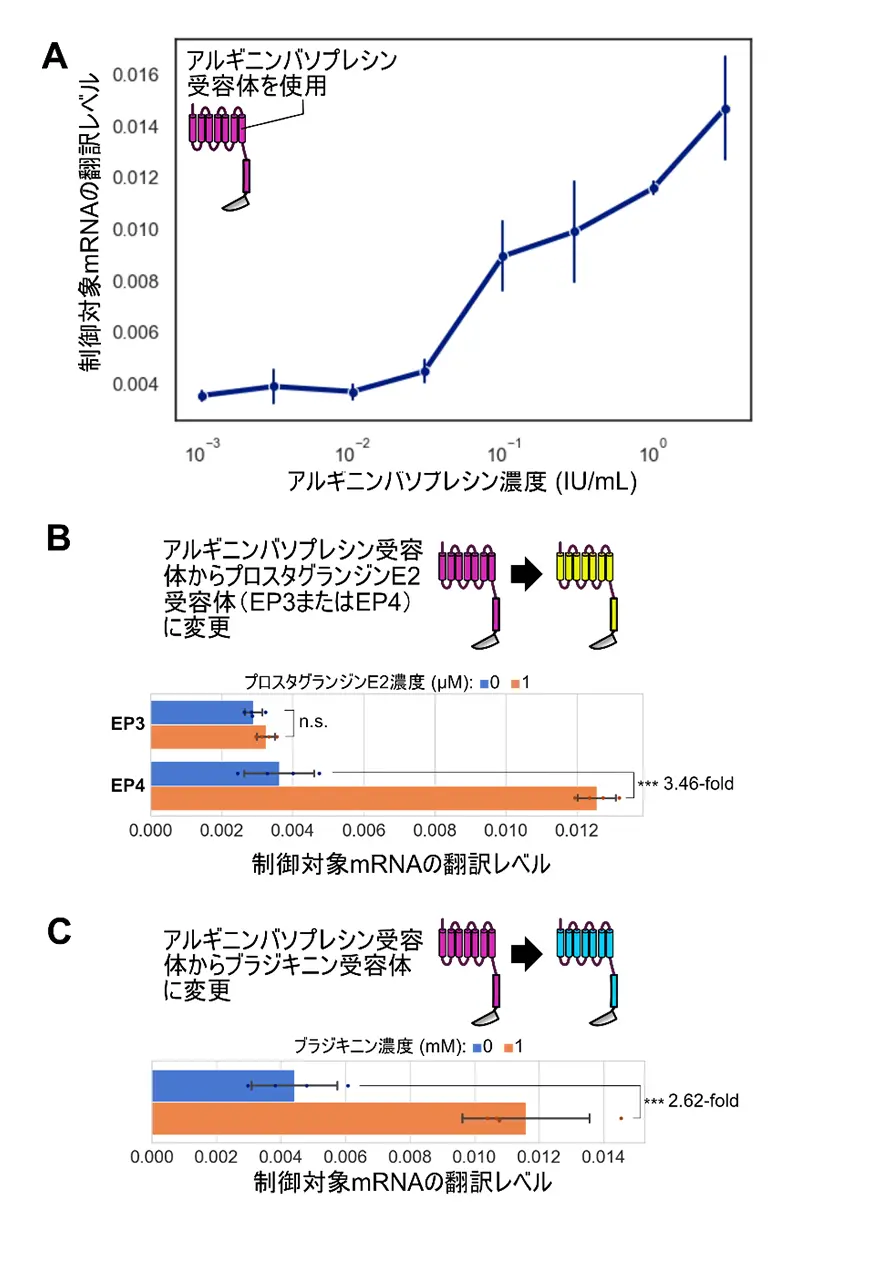
本研究では、このシステムを用いて、抗利尿ホルモンであるアルギニンバソプレシン、炎症関連分子であるプロスタグランジンE2、疼痛関連分子であるブラジキニンといった液性因子に応じて、制御対象mRNAの翻訳を制御することに成功しました(図2)。
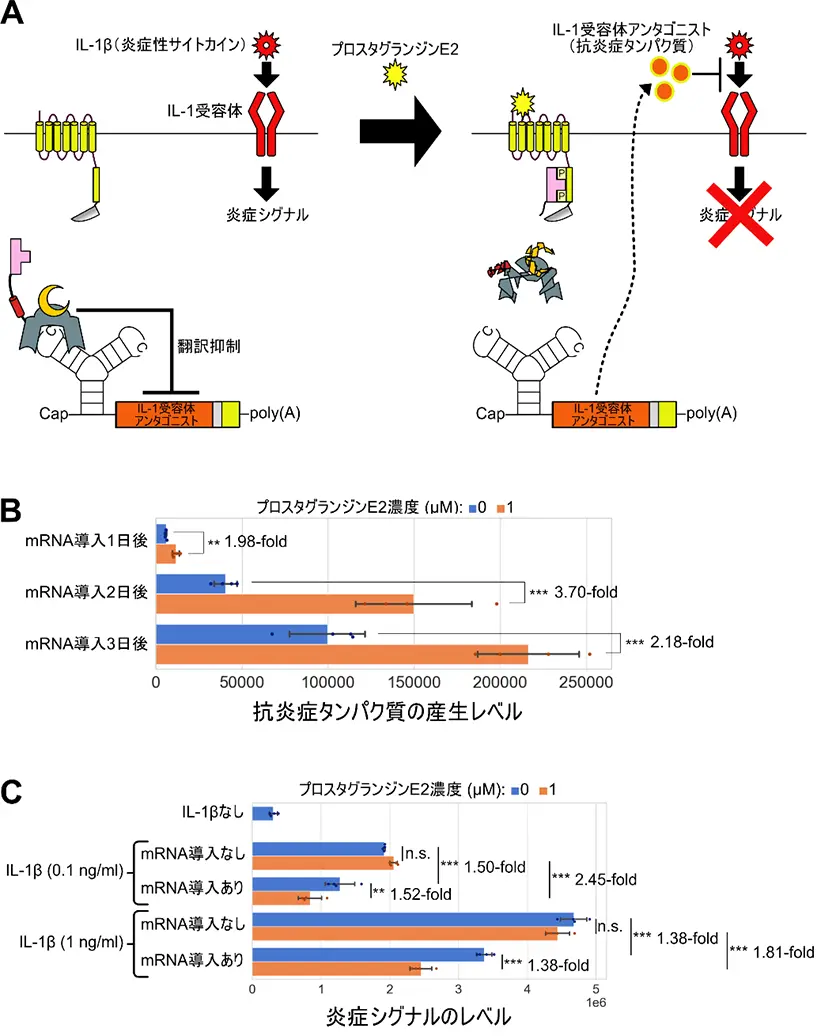
さらに、抗炎症性タンパク質をコードする制御対象mRNAを用いることで、炎症の指標となるプロスタグランジンE2に応じて抗炎症タンパク質の産生量を増加させ、これによって炎症シグナルを抑制できることを示しました(図3)。
社会的インパクト
「薬も過ぎれば毒となる」という言葉があるように、治療効果を得ながら副作用を抑えるためには、適切な量の薬を使用することが重要です。このため、症状に応じて投薬量を調節することも一般的に行われています。もしも、そうした人為的な調節を行わなくとも薬が自ら体内の状態を検知し、その効果を自動的にコントロールできるようになれば、薬の有効性と安全性を飛躍的に高める、画期的な技術となるでしょう。
本技術を応用すれば、たとえば痛みが強まったときにそれを検知して効果を強める抗炎症剤・鎮痛剤や、mRNAワクチン接種後の炎症反応を制御しつつワクチン効果を維持するシステムなどへの展開が期待されます。さらに、さまざまな疾患マーカーを検知対象とし、病態に応じて薬効をコントロールするような薬の開発にも応用可能です。
また、本システムの特長の一つとして、投与する成分が全てmRNAである点が挙げられます。そのため、すでに実用化されているmRNAワクチンと同様に、既存のmRNAの合成法や脂質ナノ粒子(LNP)を用いた投与法を活用することができます。mRNAという新たな薬の材料(モダリティ)の可能性をさらに広げる、重要な技術革新と言えるでしょう。
今後の展開
本研究では、システムの基盤技術を開発し、培養細胞を用いた実験によりその基本的な性能を明らかにしました。今後は、実験用動物を用いた評価を進め、薬やワクチンへの応用に向けた検討を本格化させていきます。
また、本技術に基づく次世代mRNA創薬の実現に向けて、製薬企業を含む研究グループを構築し、医学、原薬製造技術、DDS(ドラッグデリバリーシステム)技術を融合させた研究開発を推進していきます。
付記
本研究は、日本学術振興会(JSPS)科学研究費助成事業(JP19K20696、JP23K11843、JP23K28426)、国立研究開発法人日本医療研究開発機構(AMED)、東京医科歯科大学(現東京科学大学)医歯科学研究助成、ならびにアクセリード社の支援により実施されました。
用語説明
- [用語1]
- 翻訳:mRNAの情報を読み取って、そのmRNAがコードするタンパク質を産生する過程。人間の細胞内でもこの翻訳過程によりタンパク質が産生されている。
- [用語2]
- プロスタグランジンE2:細胞が合成する生理活性物質の一種。炎症時に合成量が増大することが知られている。
- [用語3]
- Gタンパク質共役受容体:細胞膜上に存在するタンパク質で、液性因子や光などを検知し、細胞内に情報を伝達する役割を担っている。非常に多くの種類があり、何を検知するかはGタンパク質共役受容体の種類により異なる。
- [用語4]
- TEVプロテアーゼ:植物に感染するウイルスの一種であるタバコエッチウイルス(Tobacco Etch Virus、TEV)に由来するタンパク質切断酵素であり、標的となる特定のアミノ酸配列を認識してその箇所でタンパク質を切断する。
- [用語5]
- β-アレスチン:Gタンパク質共役受容体の細胞内領域と相互作用するタンパク質。液性因子などの結合が引き金となってGタンパク質共役受容体の細胞内領域がリン酸化されると、この細胞内領域にβ-アレスチンが結合する。
- [用語6]
- デグロン:急速に分解されるタンパク質やペプチド。他のタンパク質に融合されている場合、デグロンと融合されているタンパク質もデグロンと共に分解される。TEVプロテアーゼ応答性デグロンの場合、TEVプロテアーゼによる切断が引き金となって急速分解が誘導される。
- [用語7]
- CaVT(Caliciviral VPg-based Translational activator):カリシウイルスに由来するVPgタンパク質とモチーフ特異的RNA結合タンパク質であるMS2コートタンパク質を融合させることで人工的に作製された翻訳活性化タンパク質。制御対象の人工mRNAが弱い結合モチーフを有している場合、そのmRNAの翻訳を活性化させるが、強い結合モチーフを有している人工mRNAに対しては逆に翻訳を抑制する。なお、結合モチーフ自体を持たないmRNAの翻訳は活性化も抑制も行わない。
- [用語8]
- MS2結合モチーフ:バクテリオファージに由来するMS2コートタンパク質が特異的に結合するRNAモチーフ。
論文情報
- 掲載誌:
- NPG Asia Materials
- タイトル:
- Extracellular ligand-responsive translational regulation of synthetic mRNAs using engineered receptors
- 著者:
- Hideyuki Nakanishi, Keiji Itaka
研究者プロフィール
中西 秀之 Hideyuki NAKANISHI
東京科学大学 総合研究院 生体材料工学研究所 生命機能医学分野 助教(当時)
(現 大阪大学 感染症総合教育研究拠点(CiDER)臨床生命工学チーム 特任講師(常勤))
研究分野:合成生物学、mRNA創薬、遺伝子治療

位髙 啓史 Keiji ITAKA
大阪大学 感染症総合教育研究拠点(CiDER)臨床生命工学チーム 教授
東京科学大学 総合研究院 核酸・ペプチド創薬治療研究センター(TIDEセンター) 特命教授
研究分野:mRNA創薬、遺伝子治療、バイオマテリアル、DDS、整形外科

関連リンク
更新履歴
- 2025年6月9日 誤記を訂正しました。
お問い合わせ
取材申込み
東京科学大学 総務企画部 広報課
- media@adm.isct.ac.jp
- Tel
- 03-5734-2975
- FAX
- 03-5734-3661