概要
東京科学大学(Science Tokyo) 総合研究院 自律システム材料学研究センターの丸山智也特任助教、同研究院 化学生命科学研究所の瀧ノ上正浩教授らは中央大学 理工学部の鈴木宏明教授、早川健教授、大学院 理工学研究科学生の黄之泰(コウ・シタイ Zhitai HUANG)、金子完治(当時)、米山遼太郎(当時)の研究グループと共同で、マイクロスケールの均一な生体分子凝集体を効率よく作り出す、新しい簡便な手法の開発に成功しました。本手法は、早川教授が開発した振動誘起流れ技術を基盤としており、高価な装置や複雑なマイクロ流路設計を一切必要としません。シンプルな機械的振動だけを使い、細胞環境に近い単一水相の中で凝集体の形成を精密に制御できる、汎用性の高い技術です。
脂質、DNA、タンパク質などの分子を組み合わせて人工細胞モデルをボトムアップで構築する研究は、世界的に進展しています。この分野において、液-液相分離[用語1]によって形成される「膜のない細胞小器官」である生体分子凝集体の形成を模倣する研究が精力的になされています。なかでも、DNAのナノ構造の凝集体[用語2]は、塩基配列の設計でさまざまな構造や機能をもたせることができ、新しい情報プロセッシング材料として注目されています。これらの凝集体構造を、高い信頼性で製造・制御できれば、将来の細胞置換バイオテクノロジーの発展に大きく貢献すると期待されます。しかし、生体分子凝集体の形成過程は、冬の日に窓ガラスに生じる水滴の凝縮と同様にランダムな過程であり、均一な凝集体形成の有効な方法がありませんでした。
本研究グループは、独自の振動誘起局所渦(VILV)[用語3]プラットフォームを確立し、分子凝集の制御に適用しました。この技術は、送液ポンプや複雑な流路システムを必要としません。その代わりに、標準的な圧電素子(ピエゾ)ステージを用い、PDMS(シリコーンゴム)製のマイクロピラー(微小な柱)アレイを有するシンプルなデバイスを振動させることで、安定した微小渦の配列を生成します。これらの渦は分子トラップとして機能し、DNA分子をその中心領域に捕捉・濃縮することで均一な凝集現象を誘導します。この手法は、完全な単一水相における凝集制御を実現し、デリケートな生体分子成分の活性を維持することができます。また、液滴やマイクロウェルなどの区画化を用いないため、凝集体形成後の後工程(取り出しや溶液置換、薬剤投与など)も容易です。研究グループはこれにより高度に均一なDNA凝集体を構築することに成功し、低周波の維持モードによってその位置を精密に保持できることを実証しました。
さらに、本研究グループは、本プラットフォームを用いて複合的なヤヌス・パッチ型のDNA凝集体構造の形成にも成功しており、生体材料の高度な空間制御が可能であることを実証しました。今後は、この簡便で汎用性の高い技術が、ボトムアップ合成生物学や細胞内相分離の基礎研究における標準ツールとして広く利用され、機能性人工細胞や新規スマートマテリアルの創製に貢献することが期待されます。
本研究成果は、2025年11月25日(英国時間)付で、英国王立化学会(Royal Society of Chemistry)の国際学術誌『Materials Horizons』のオンライン版で公開され、同年12月21日付で本紙に掲載されました。
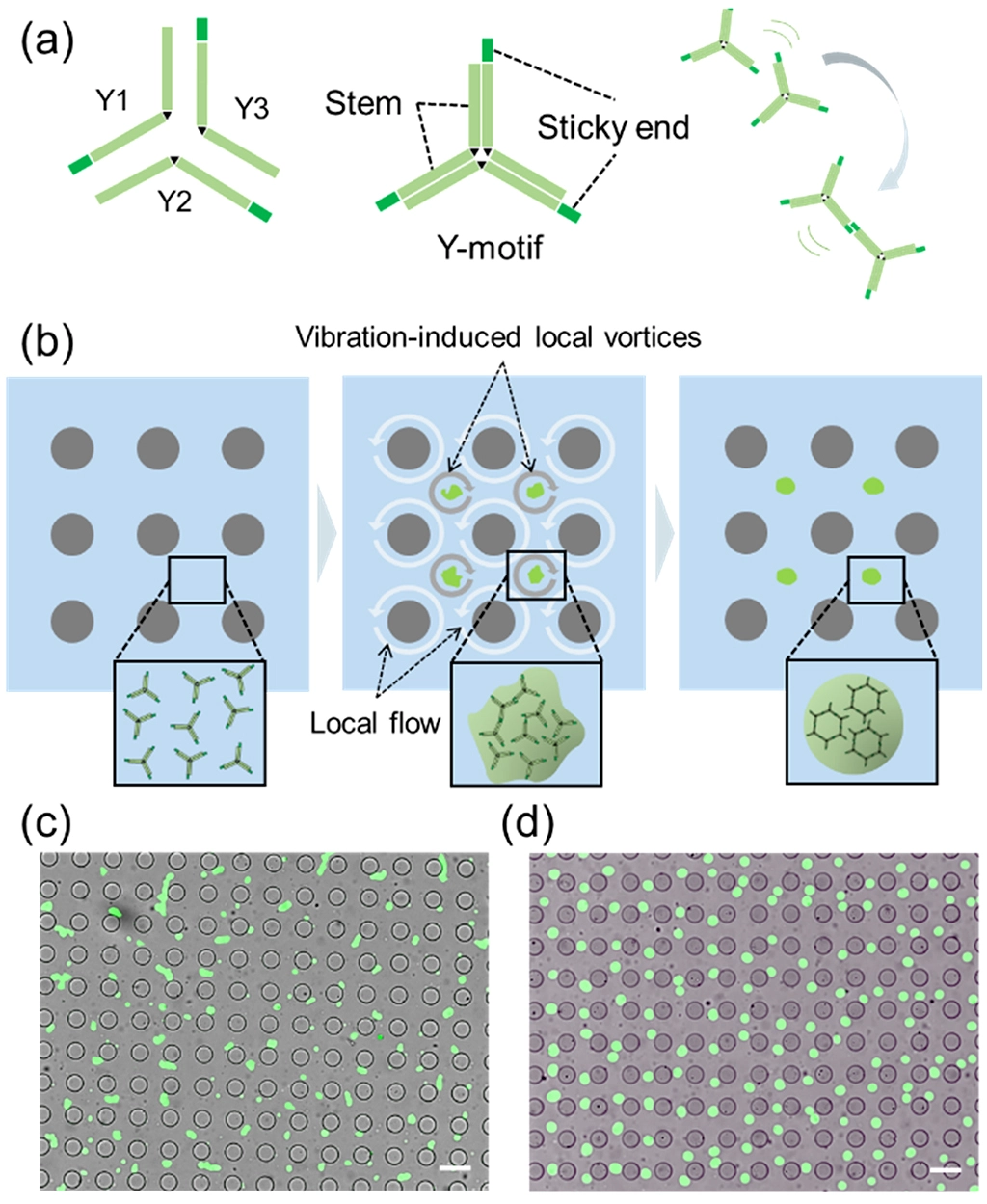
(b) VILV場内における均一凝縮体の形成過程の模式図。
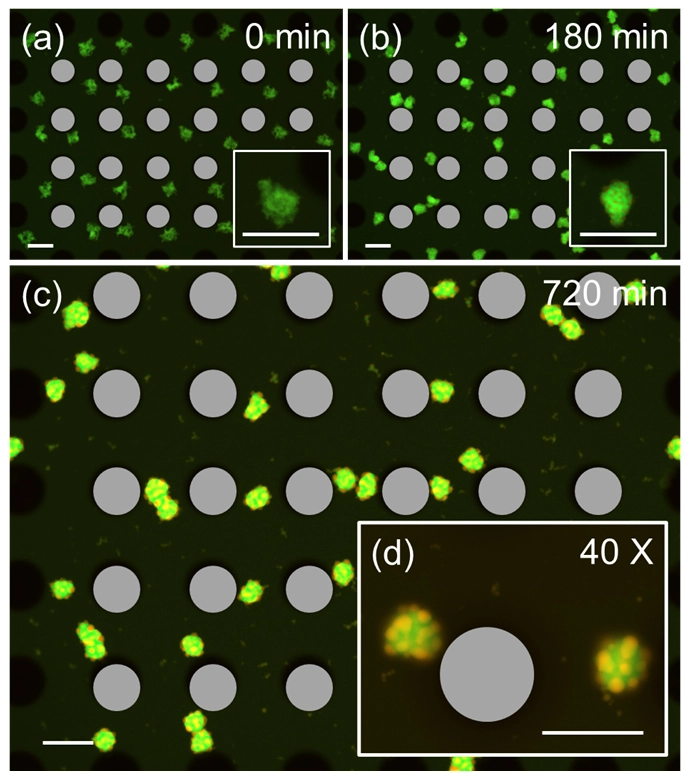
(c, d) マイクロピラー配列とDNA凝集体(緑)をそれぞれ示す、明視野観察と蛍光観察の合成画像。スケールバー = 100 µm。
(c) 振動なし4時間後の画像。(d) VIFを10分間印加後3.5時間後の画像。
背景
近年、細胞内部ではタンパク質や核酸などの生体高分子が液-液相分離によって自発的に集合し、水中でも周囲と境界を持つ凝集体を形成していることが明らかになりました。これらは膜のない細胞小器官として機能し、生体反応を制御する重要な役割を担っています。この現象に関連して、人工的に設計されたDNAナノスターなどのDNAナノ構造体からDNA凝集体をつくり、利用する研究が注目されています。DNAナノスターは、その先端にある粘着末端の設計により、凝集の強さや性質をプログラム可能です。
しかし、凝集体は、通常いろいろなサイズのものができてしまうため、その利用法に制限がありました。均一なサイズの凝集体を作製する試みもなされていましたが、課題がありました。代表的なものは、均一な油中水滴やマイクロウェル(小部屋)にDNAナノ構造を閉じ込めて凝集させる方法ですが、凝集体をとり出したり、溶液を添加したりといった後利用が困難でした。そのため、物理的な区画を使わず、簡便に、生体環境に近い水性条件下で凝集体を制御できる新しい技術が求められていました。
研究成果
本研究グループは、独自の流体制御技術である振動誘起局所渦(VILV)プラットフォームを利用し、上記の課題を解決しました(図1)。
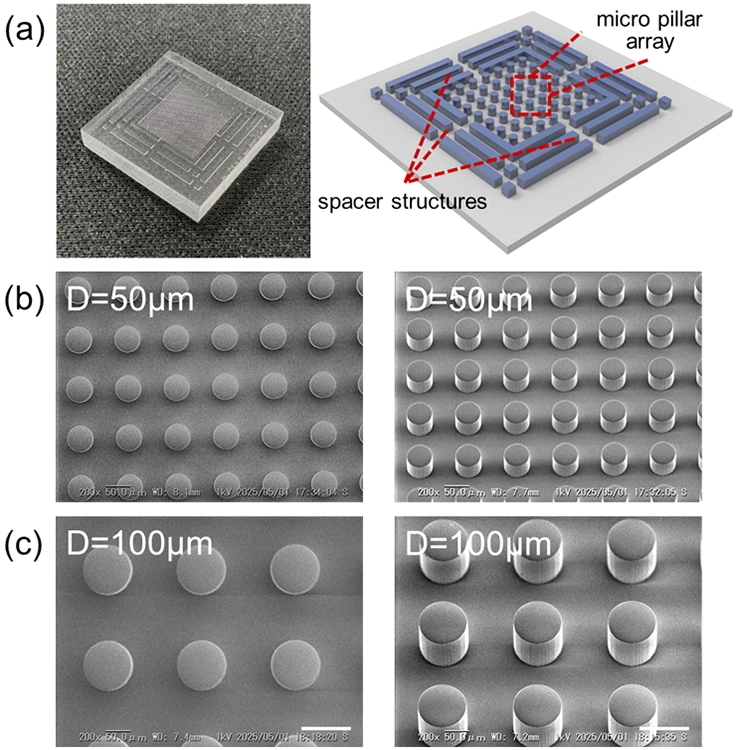
(b-e) 異なる直径のマイクロピラーアレイの走査型電子顕微鏡(SEM)画像。
(b) D = 50 µm、(c) 100 µm;トップダウン(左)および45度傾斜(右)視点。Scale bars = 100 µm。
本手法では、マイクロピラー(直径0.1mm程度の微細な柱)が配列されたチップにDNAナノスター溶液を入れ、特定の周波数で水平旋回振動を与えます。すると、ピラー周辺に均一かつ安定なマイクロ渦群が発生します。このVILVは、物理的な壁を持たない仮想的なマイクロ容器として機能します。この仮想容器内での流体力学的な作用により、分散していたDNAナノスターの小さな凝集体は渦の中心へと濃縮され、その結果、均一なサイズのDNA凝集体がアレイ状に形成されます(図2)。

Scale bars = 100 µm。
さらに本研究では、形成した凝集体の位置制御も実現しました。通常、液内の凝集体は放置すると移動し、互いに融合してしまいますが、振動を低周波数(200 Hz)に切り替える維持モードを与えることで、凝集体を渦中心に穏やかに保持し、液滴同士の融合を長時間抑制することに成功しました。また、異なる粘着末端を持つDNAナノ構造やリンカー(接続部品)としてのDNAナノ構造を加えることで、中心部に小さな別のナノ構造が付着したパッチ構造[用語4]の凝集体の構築も実証しました(図3)。この複合構造は、分子検出などの用途に利用できるため、均質な構造制御は再現性の向上につながります。
- 動画
今後の展開
本研究で確立したVILVプラットフォームは、単一水相中で、均一な生体分子凝集体の形成位置やサイズを精密に制御できる画期的な技術です。今後は、この均一な凝集体をボトムアップ合成生物学[用語5]における人工細胞凝集体のモデルとして利用することや、疾病診断における分子検出素子などへの応用が期待されます。
この研究成果の元となった研究経費(主管庁、配分機関等)
-
科学研究費補助金(文部科学省)
-
日本学術振興会(JSPS)
科学研究費助成事業(科研費) JP24K01320, JP24H01155, JP23K22725, JP20H05935, JP24K08214
-
日本学術振興会(JSPS)
-
科学研究費補助金以外の研究経費
- 公益財団法人 JKA 開発研究
- 中央大学 理工学研究所
用語説明
- [用語1]
- 生体分子凝集体(および液-液相分離、LLPS) :「膜のない細胞小器官」とも呼ばれる。タンパク質や核酸(DNAなど)が、細胞内で液-液相分離(LLPS)という物理現象によって自発的に形成する、高濃度の液滴状の分子構造体。細胞内のプロセスを組織化するために不可欠である。従来の試験管内(in vitro)での再現実験ではサイズをそろえることが困難であったが、本研究の手法は、細胞内と同じ「単一水相」環境下でその形成を精密に制御できる点に優位性があり、より生体に近い条件での解析を可能にする。
- [用語2]
- DNA凝集体:細胞内の染色体はDNAが高密度に凝集したものであり、DNA凝集体はDNAナノテクノロジーの分野でも研究・応用されている。特に、数種類の短い一本鎖DNAからなるY字型やX字型など複数のアームを持つDNAナノ構造体(DNAナノスター)の凝集体が注目されている。アームの先端に4~10塩基の粘着末端(sticky ends)を設けることで、ナノスター間の結合を精密に制御できる。これにより、分子認識などの機能を組み込みつつ、凝集と解離を制御することが可能となる。
- [用語3]
- 振動誘起局所渦(Vibration-Induced Local Vortex:VILV) :本研究グループが確立した振動誘起流(Vibration-Induced Flow: VIF)技術を基盤とし、それを発展させた技術。マイクロピラー(微小な柱)アレイを用いることで、空間的に固定された安定な渦を生成する。この渦は、壁を持たない仮想的なマイクロ区画として機能し、外部から接触することなく、分子をその中心に濃縮・捕捉することができる。
- [用語4]
- パッチ構造:中心部(コア)と、それを覆う多数の微小部分からなる構造のこと。本研究では、性質の異なるDNA凝集体をパッチ状に形成させることに成功した。
- [用語5]
- ボトムアップ合成生物学:既存の生物を改変するのではなく、DNA、タンパク質、脂質などの基本的な生体分子を部品として組み合わせ、試験管内で細胞のような機能を持つシステム(人工細胞)をスクラッチから構築しようとする研究分野。
論文情報
- 掲載誌:
- Materials Horizons, Royal Society of Chemistry
- タイトル:
- A platform for the formation of uniform DNA condensate droplets using vibration-induced local vortices
- 著者:
- Zhitai Huang, Kanji Kaneko, Ryotaro Yoneyama, Tomoya Maruyama, Takeshi Hayakawa, Masahiro Takinoue, Hiroaki Suzuki
- DOI:
- 10.1039/D5MH01304F
研究者
鈴木 宏明 Hiroaki Suzuki
中央大学 理工学部 精密機械工学科 教授
瀧ノ上 正浩 Masahiro Takinoue
東京科学大学 総合研究院 化学生命科学研究所 教授
丸山 智也 Tomoya Maruyama
東京科学大学 総合研究院 自律システム材料学研究センター 特任助教
早川 健 Takeshi Hayakawa
中央大学 理工学部 精密機械工学科 教授
関連リンク
東京科学大学 総合研究院 化学生命科学研究所
教授 瀧ノ上 正浩
東京科学大学 総務企画部 広報課
- media@adm.isct.ac.jp
- Tel
- 03-5734-2975
- FAX
- 03-5734-3661