ポイント
- 光の波長スイッチングで流動性が可逆的に変化するDNA液滴を作製
- 光応答性の有無をDNAの配列に応じて変えられる液滴で、駆動モードを切り替えられるDNAマイクロ流れを実現
- インテリジェント流体ベースの診断チップや流体型分子コンピュータへの応用に期待
概要
東京科学大学 情報理工学院 情報工学系の瀧ノ上正浩教授、鵜殿寛岳特任助教と東北大学 大学院工学研究科 ロボティクス専攻の野村M.慎一郎准教授らの研究チームは、照射した光の波長[用語1]に応じて流動性を制御できる、DNA[用語2]からなる液滴を構築し、「DNA液滴分子ロボット」への応用に成功しました。
生物の細胞では、液–液相分離[用語3]で形成される液滴が、細胞の構造と機能の制御、さらには病気の発現などにも関与しています。近年では、人工的に合成されたDNAが液–液相分離して形成される「DNA液滴」の研究が進められています。その背景には、この液滴はプログラマブルな分子[用語4]であるDNAがベースであるため、配列設計を通じて生体内の液–液相分離液滴のさまざまな挙動を再現、制御できることがあります。DNA液滴の流動性制御は、分子ロボットの駆動に関わるだけではなく、分子コンピュータの演算結果をアクチュエーションに結びつける役割もあります。しかし、これまでDNA液滴による分子コンピュータの報告はありましたが、DNA液滴の流動性を制御する技術はありませんでした。
本研究では、光照射によって「ゲル」(固い)–「液体」(流動的)–「分散」(溶けている)という相状態[用語5]の間を可逆的に変化するDNA液滴において、マイクロ流れを実現しました。さらにこのDNA液滴のマイクロ流れにより駆動される微小流体ロボットを構築し、その挙動を実証しました。
本研究の光制御DNA液滴は、駆動と演算を統合させた流体型DNAコンピュータとして、情報工学(生体分子コンピュータ)や生物医工学(流体型診断チップ)、機械工学(流体型ロボット)などへの応用が見込まれます。また、情報を塩基配列に自在に書き込めるDNAを用いる点で、水や油などのプログラムできない分子材料を用いる従来のマイクロ流体工学[用語6]とは一線を画した、インテリジェントな微小流体に立脚したマイクロ流体工学の可能性が拓けたといえます。
本成果は、5月14日付(現地時間)の「Nature Communications」誌に掲載されました。

背景
タンパク質、RNAなどの生体高分子は、細胞内で相互作用を通じて液体の性質を持つマイクロ構造体である液滴を形成します。この現象は液–液相分離として知られ、近年の細胞生物学でさかんに研究されています。液滴は主に、ストレスなどへの刺激応答性、化学反応の制御、細胞内小器官の形成などに関与することが判明しており、液滴の物性変化が病因を誘発することも示唆されています。この液–液相分離の研究は合成生物学の分野にも波及しています。これまでに、DNAの柔軟な配列設計を通じて、任意のプログラマブルな微小構造と機能を形成するDNAナノテクノロジーに立脚して、人工的なDNA液滴を構築し、高機能化させる研究が、本研究グループをはじめ国内外の研究室で進められています。特に、DNAの配列認識能を演算や知覚機能の実装に活用した分子ロボットや分子コンピュータへの展開が期待されています。
代表的なDNA液滴の作製方法ではまず、複数のDNA一本鎖を塩基対形成ルールにしたがい自己集合させて、3本以上の分岐を持つナノ構造体(モチーフと呼ばれる)を形成します(図2a)。その分岐の末端には粘着末端(SE)と呼ばれる一本鎖が突き出ています。このSEには、他の配列と結合しやすい相補的[用語7]な配列を持つものと、結合しにくい直交[用語7]関係にある配列を持つものがあるとき結合しません。相補的なSEを持つモチーフは相互に結合して、より大きなネットワーク状のマイクロ構造体を形成します。ただしこの構造体は、SE同士の結合が互いにくっついたり離れたりを繰り返すような、緩やかな構造体として設計されています。その結果、高い流動性を持つDNA液滴が構築されます。さらにDNA液滴は、互いに相補的なときは融合しませんが、直交関係にあるとき互いに融合しないで離れようとする性質を持ちます[参考文献1]。ただし、直交関係にある液滴の両方に結合するリンカーDNA[用語8]を介在させると、両者は融合します[参考文献1、2、3]。
これまでのDNA液滴の研究には、配列の直交性を利用した区画構造を持つ液滴の構築や[参考文献1]、リンカーDNAの介在により複数のDNAが融合した液滴が酵素やRNA(DNAと同じ核酸分子)などの分子的な入力に応答して分離状態へ変化するといった動的な構造変化[参考文献1、2、3]など、構造的な側面に着目するものが多くありました。また、DNAやRNAの塩基配列を選択的に認識できる能力を利用した論理演算[参考文献2]や、入力された分子の濃度と反応速度の対応関係を利用した濃度比較[参考文献3]など、知覚的な側面に着目する研究もありました。しかし、制御や駆動といったロボティクスを成り立たせるために必須である、流動性などの要素については報告されていませんでした。
研究成果
今回、「DNA液滴が遠隔操作によりマイクロ流れを実現する」ことをコンセプトとして、「精確で扱いやすい光照射により、DNA液滴が流動性を変えて流れ場を生じさせる」という挙動の実現を目指しました。DNAに光応答性を付与するために、光の波長に応じて立体構造を変化させてDNAの結合と乖離をスイッチングできるアゾベンゼンを、モチーフ分岐端のSEに修飾しました(図2a)。この光スイッチングにより、SEの結合と乖離を可逆的に切り替えることで、DNAの相分離凝集体の流動性を変化させることを基本的な制御原理としました(図2b)。
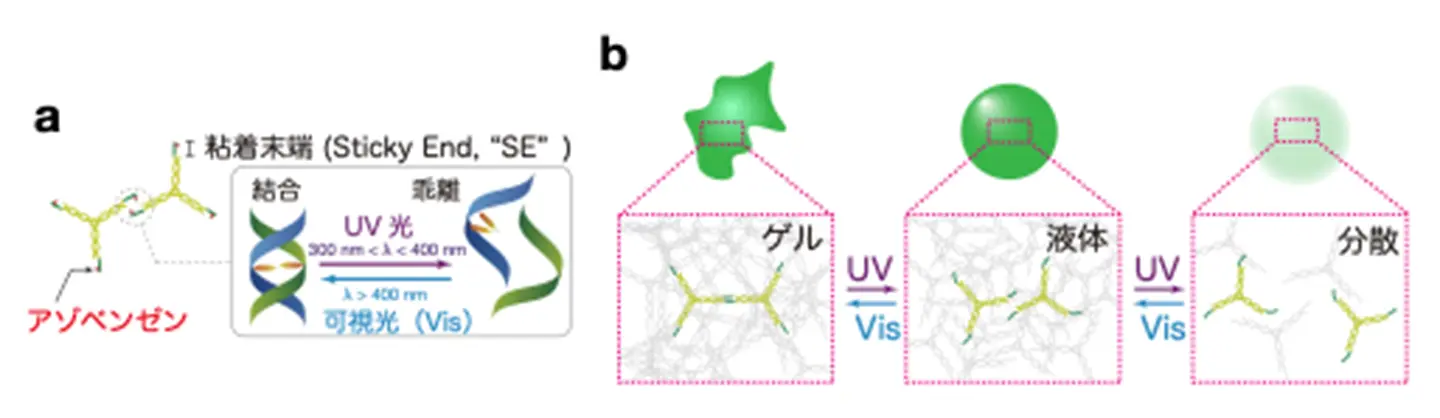
DNA相分離凝集体の流動性を光で制御
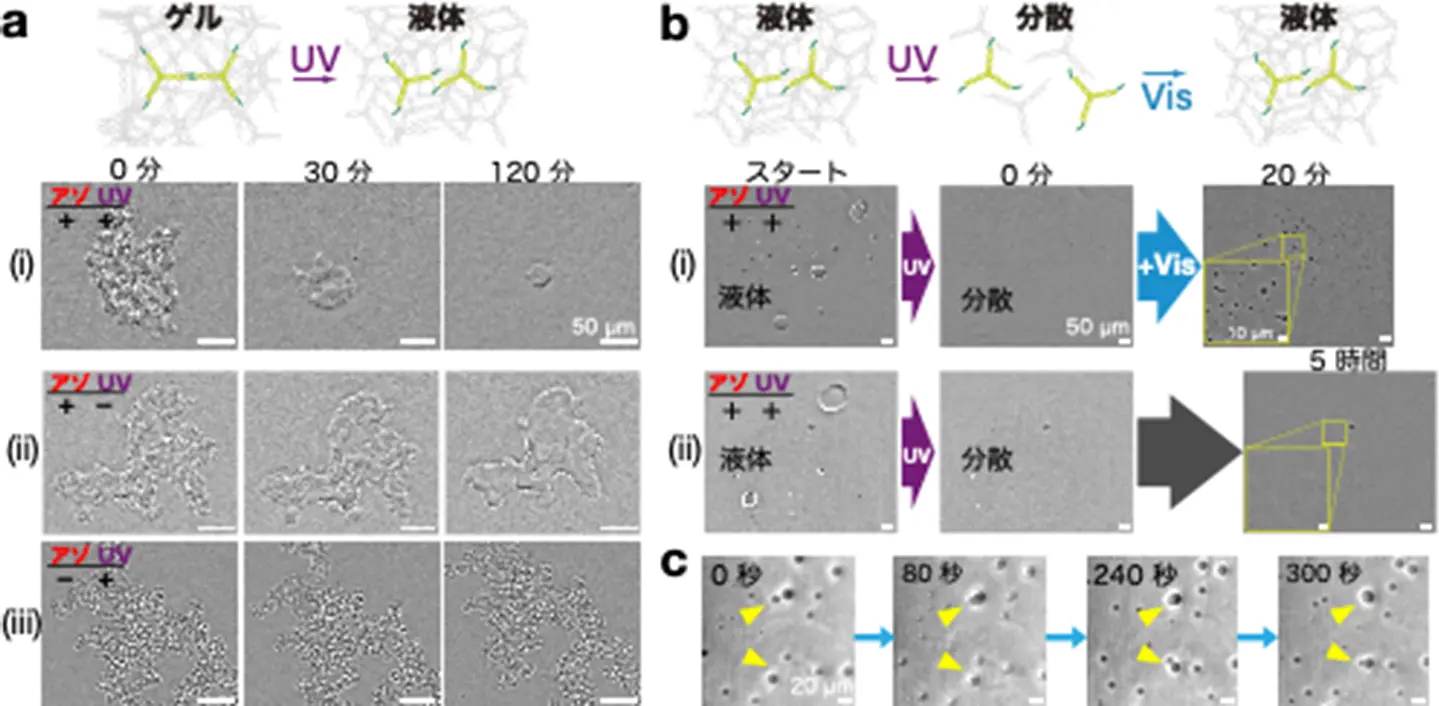
本研究ではまず、アゾベンゼン修飾モチーフから固いゲル状態のDNA凝集体を形成しました。これにUV光(365 nm)を照射すると、表面の凹凸がなくなり、なめらかな液滴へと変化しました(図3a(i)、(ii)、(iii)と比較)。これは流動性が高くなったためです。
次に、可視光の効果を確かめるために、DNAが液体状態をとる温度まで加熱し、UV光を当ててから、いったん分散(溶解)させて初期状態としました。これに可視光(440 nm)を照射してしばらくすると、丸い液滴が再び出現しました(図3b(i)、(ii)と比較)。再出現した粒子は互いに融合することも確認され、液体状態であることが示されました(図3c)。このように、光応答性DNA凝集体は、光の波長に応じて可逆的に「ゲル」–「液体」–「分散」の間で相状態を変えることから、その流動性を光でスイッチできることが確かめられました。
図3. 光でDNA凝集体の相状態を可逆的に変える。(a)UV照射の効果。アゾベンゼン修飾とUV照射の両方があるときだけ、スポンジ状の凝集体は丸くなる。流動性が増加し表面張力が現れる。(b)可視光の効果。UVで分散させた後に、可視光を当てると再び液滴が現れる。(c)可視光で再出現した液滴は互いに融合する。黄色のマーカーが指す粒子に注目。液体である証拠。
アゾベンゼンの挿入位置に応じてモードが変わるDNAマイクロ流れの実現
次に、光の照射をより強くして急激な相変化を起こすことで、DNAのマイクロ流れの実現を目指しました。ここでは、直交関係にある2種類のDNAを対象とし、一方はアゾベンゼンが修飾された光応答性ありのDNA、もう一方は修飾していない光応答性のないDNAとしました(図4a)。その理由としては、(1)光応答性がないDNA凝集体をトレーサー粒子[用語9]として活用できること、(2)異なる相変化をする2種類のDNAを空間的にカップリングさせることで、DNAマイクロ流れによる流体力学的な作用が可能となるという点が挙げられます。空間的にカップリングさせるために、本来はくっつかない2種類のDNAのどちらにも結合するリンカーDNAを介在させて、相互に付着するようにしました(図4b)。アゾベンゼンのSE内での挿入位置と個数が異なる3種類の凝集体を用意し、DNAマイクロ流れに与える効果を調べました。
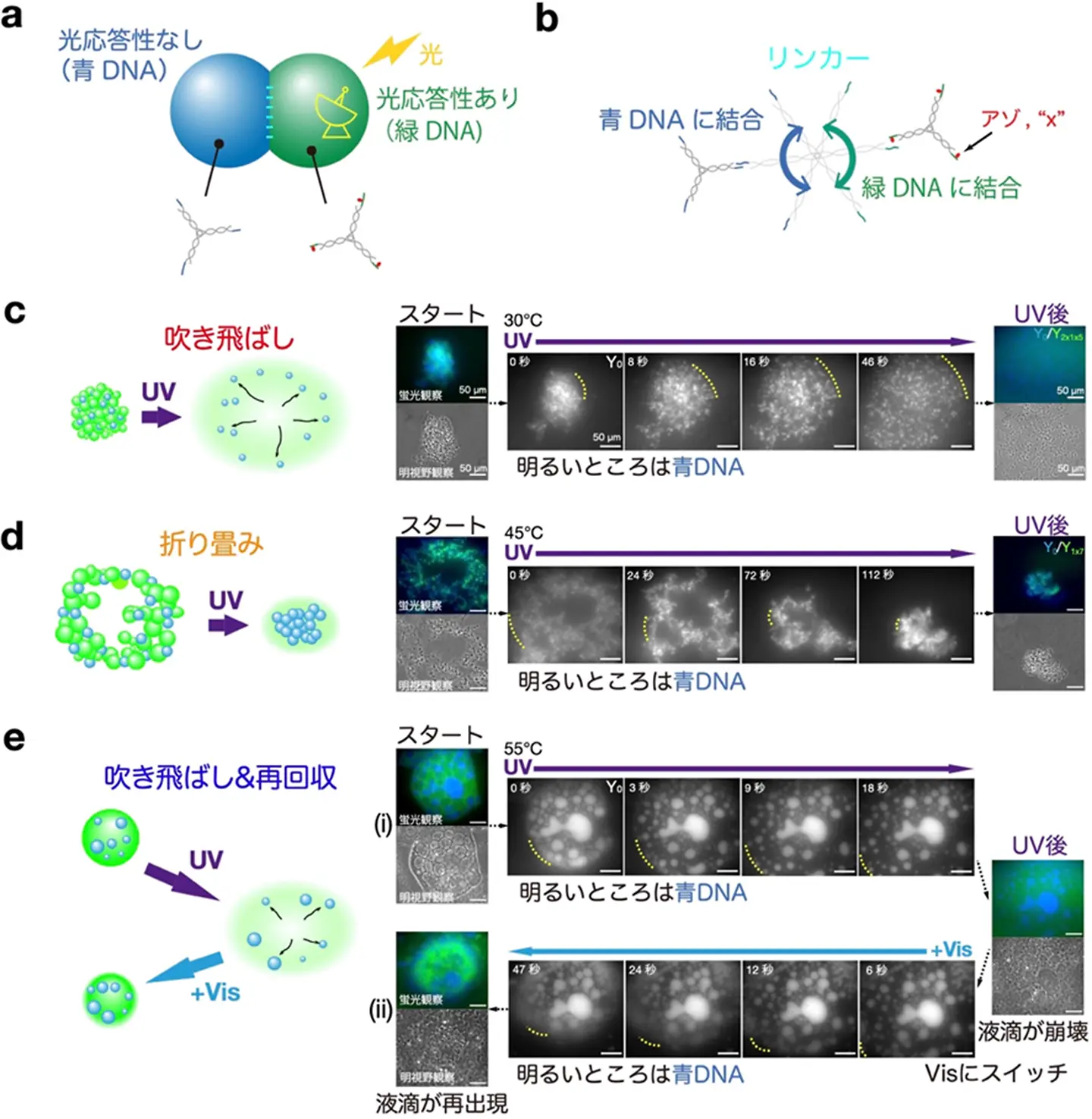
アゾベンゼンの挿入位置、温度、光の照射条件のさまざまな組み合わせを調べた結果、光照射で起こる流れには主に3つのモードがあることが分かりました。スタートの状態は、光応答性DNAゲル粒子(緑DNA)と光応答性なしDNAゲル粒子(青DNA)が同じ凝集体の中に共存した状態であります。1つ目のモードでは、UV光照射下で緑DNAゲルが固い「ゲル」状態から急激に「分散」状態へ変化する結果、強い拡散流れが起こり、青DNAゲル粒子をロケット噴射のように外側に弾き飛ばします(図4c)。
2つ目のモードでは、緑DNAがUV光照射により「ゲル」から「液体」へと変化して流動性を持ようになり、空間的に広がっていた青DNAがコンパクトに折りたたまれるような流れが起こります(図4d)。これは、「ゲル」→「液体」相変化の結果、流体が持つ表面張力的な効果が出現して、全体のボリュームを減らそうとするためと考えられます。
3つ目のモードでは、液滴の崩壊と再構成が周期的に繰り返すサイクル流れが生じます(図4e)。最初の状態では、緑DNA液滴の中に青DNA液滴が封入されています。これらはいずれも「液体」でありますが、そこにUV光を照射すると、緑DNA液滴が「液体」から「分散」状態へと変化し崩壊し、中の青DNA液滴が放出されます(図4e(i))。次に可視光に切り替えると、緑DNAは「分散」から「液体」へと戻るため、液滴が再構成されるような流れが生まれます(図4e(ii))。
こうした凝集体では、アゾベンゼンの挿入位置はたった2塩基分しか変わらず、個数も1個か2個かの違いしかないですが、光応答性DNAのマイクロ流れは劇的にモードが切り替わることが分かりました。
光スイッチングを局所化させて方向性を持つ泳動挙動を実現
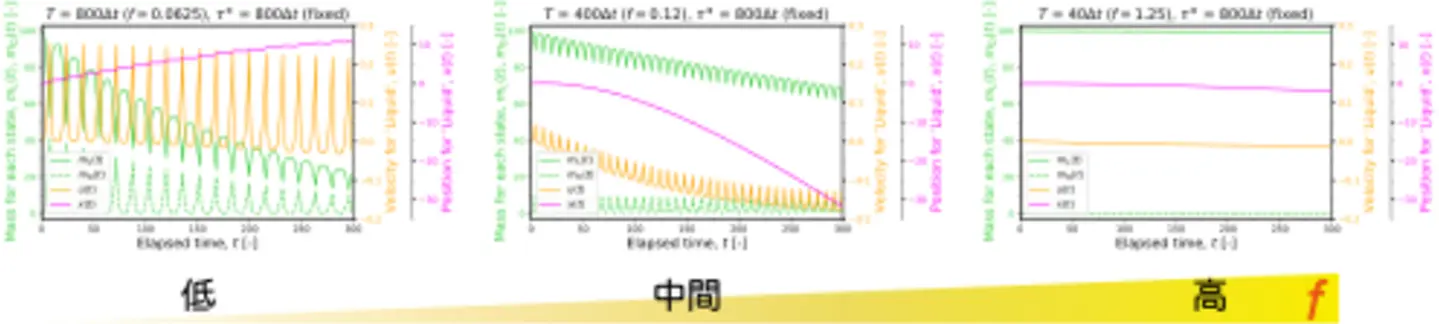
ここまでは、光をDNA凝集体よりも広い領域に照射していたため、対称的な流れ場が生じています。UV–可視光の切り替えでサイクルする流れ(図4e)を方向性のある駆動にするためには、非対称性を入れる必要があります。そこで、DNA液滴の一部だけに照射領域を限定する特殊な装置を使って、非対称的なマイクロ流れを作りました。また、波長の切り替え周波数(1秒あたりに何回切り替わるか)を幅広く調べて、その効果を調べました。切り替え周波数が低い場合には、照射領域とは反対側の方向に進むクラゲのような泳動が観察されました(図5a)。一方、より高い切り替え周波数では、照射領域と同じ側に向かって、パックマンのように口を開いたり閉じたりしながら進む泳動が見られました(図5b)。切り替え周波数に対して最大移動距離をプロットすると、特定の切り替え周波数を境に「クラゲ」泳動から「パックマン」泳動に切り替わることが判明しました。なお、極端に高い切り替え周波数では泳動が見られませんでした(図5c)。また、それぞれの泳動モードの時間発展をみると、「クラゲ」泳動は初め速く移動するが持続力が短いです。一方、「パックマン」泳動では、ステップあたりの移動幅は小さいが持続力があることが分かりました(図5d)。
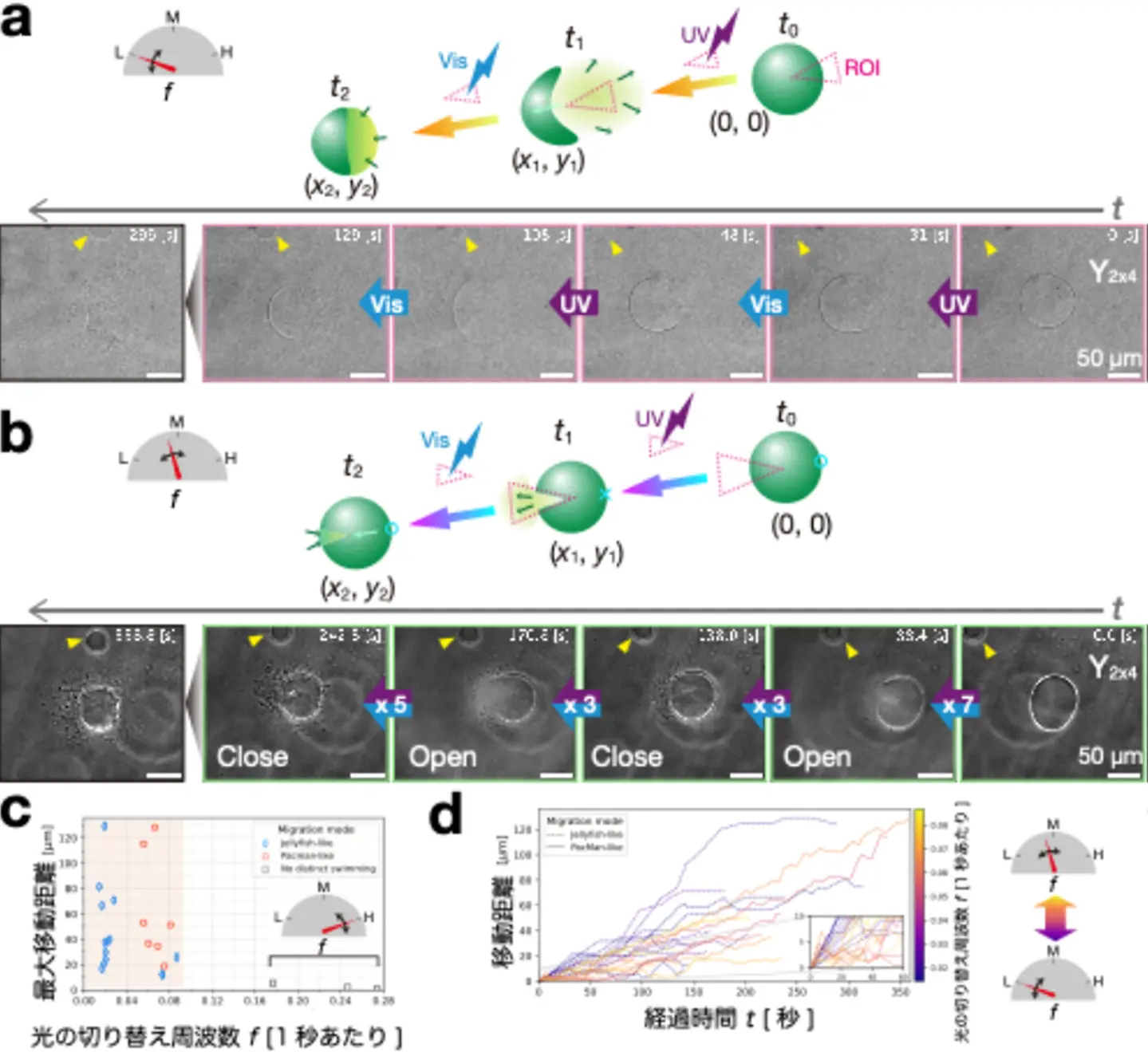
次に応用として、泳動するDNA液滴に荷物を運ばせる実験を行いました(図6)。光応答性DNA液滴(緑色)に光応答性のないDNAゲル粒子(青色)を封入し、局所的光スイッチングによる泳動により運ばせました。「クラゲ」泳動では、液滴は開いた後方部分で荷物DNAを引きずるように運搬していく様子が見られました(図6a)。「パックマン」泳動でも、液滴が荷物DNAゲル粒子を中に閉じ込めながら運搬することができました(図6b)。成功確率は、「パックマン」泳動の方が10倍ほど高かったです。

こうした切り替え周波数依存性を持つ泳動のメカニズムを明らかにするために、数値シミュレーションでモデル化しました。簡単化のため、実際に見られた3次元的な挙動ではなく、1次元的な動き(前後の単純な動き)に限定してモデル化を行いました。UV光と可視光の切り替えにより、DNAが「液体」と「分散」状態の間をシャトル輸送されるという質量輸送モデルをベースにして、拡散による質量散逸を加味したモデルを構築しました。泳動の向き(切り替え周波数を増加させると向きが反転する)、持続時間(周波数が低いほど持続時間が短い)、1ステップあたりの移動幅(周波数が低いほどステップ幅が大きい)に関して、実験結果の傾向と一致するシミュレーション結果が得られました(図7)。
このことから、光の切り替え周波数が質量輸送にともなうエネルギーの散逸と交換のバランスを決めていることが明らかとなりました。エネルギーの散逸と交換のバランスが切り替わる周波数のしきい値 f をマイクロ流れの拡散係数から見積もったところ、 f ~ 0.07 [s -1]が得られました。この値は、「クラゲ」泳動と「パックマン」泳動が切り替わる周波数領域(図5c)と一致しています。
社会的インパクト
本研究では、プログラマブルなDNA液滴を、光照射による遠隔操作という扱いやすい方法で駆動することに成功しました。これまではDNA液滴の構造や知覚に焦点をあてる研究が多かったという背景を考えると、今回の研究で、制御や駆動というロボティクスの必須要素を実現できたことは、インテリジェントな流体型ロボット開発における大きな前進であります。
類似研究であるハイドロゲルや分子モーターと比較すると、前者では流れや表面張力の作用に起因する動的な挙動が期待できず、後者ではDNAのようなプログラマビリティがなく、直接的な制御も不可能です。こうした点から、今回の研究には従来の研究にはないインパクトやオリジナリティがあると言えます。
今回のインテリジェントな流体型ロボットを利用すると、柔軟なDNAの配列設計や分子修飾を通じて、流体力学的な効果をプログラマブルな作用として操ることができます。例えば、今回構築したDNA液滴のDNA配列に、特定の分子や細胞に特異的にくっつくDNA配列を埋め込めば、泳動しながらターゲットとなる細胞や分子だけを拾いながら、検出、診断、治療などを行うマイクロ流体ロボットが実現できます。また、特定の分子が感知されたときだけ、表面張力的な効果により微小構造物を折り紙のように折りたたむ操作も可能となります。他にも、DNAから構成された人工的な筋肉やポンプなど、機械工学、医療、農業、情報科学などさまざまな分野への応用が期待されます。
映画やSF小説などには、典型的なロボットのイメージとは異なる、つるんとした抽象的な外見をした、知性を備えた流体が、人知を超えた科学のモチーフとして登場することがあります(「ターミネーター2」や「三体」など)。今回の研究成果は、現実の科学がそのような想像上の流体型ロボットへ近づく一歩となりました。
今後の展開
今回の研究では手動による単一液滴の操作にとどまりましたが、今後は多数の液滴を機械的な手法で同時に操作できるようになれば、液滴型ロボット群にはるかに複雑で大規模な仕事を実行させることが可能となります。そのためには、人工知能(AI)を活用して、液滴のサイズに応じた光の切り替え周波数や、照射領域のサイズなどの複数のパラメータの最適化を学習させる必要があります。そうすれば、光照射に対する液滴の反応からAIによるリアルタイムな条件設定が可能となります。
付記
本研究成果は、MEXT/JSPS科研費(JP20H00619、JP20H05935、JP24H00070、JP20H05701、JP22K14528)、JST先端国際共同研究推進事業(ASPIRE, JPMJAP24B4)、学術振興会特別研究員奨励費(JP19J112959、JP22J00940)、Human Frontier Science Program (HFSP, RGP0016/2022-102)の支援のもとで得られた成果です。
参考文献
- [1]
- Sato et al., Sci. Adv., “Sequence-based engineering of dynamic functions of micrometer-sized DNA droplets” (2020): 「DNA液滴」の形成と制御に成功(東工大ニュース2020年6月12日)
- [2]
- Gong et al., Adv. Func. Mat., “Computational DNA Droplets Recognizing miRNA Sequence Inputs Based on Liquid–Liquid Phase Separation” (2022): 液滴の分裂によって、がんの可能性の有無を示す「DNA液滴コンピュータ」の開発に成功(東工大ニュース2022年6月6日)
- [3]
- Maruyama et al., Nat. Comm., “Temporally controlled multistep division of DNA droplets for dynamic artificial cells” (2024): 人工細胞の分裂のタイミングや順序の制御による分子コンピューティングを実証(東工大ニュース2024年10月4日)
用語説明
- [用語1]
- 光の波長:光は電磁波の1つで「波」の性質を持つ。空間を伝わる波の1つの山と次の山の距離を波長という。波長に応じて光の色が決まる。単位はnm(ナノメートル)で、1 nmは1 mの109分の1。紫外(UV)光は400 nm未満の波長、可視光はそれ以上の波長帯域を指す。
- [用語2]
- DNA:生命の遺伝情報を格納できる生体分子。4種類の塩基が鎖状に連なっている。2本の鎖が対となって結合すると、よく知られた二重らせん構造をとる。4種類の塩基の間には、アデニン(A)はチミン(T)と、グアニン(G)はシトシン(C)と結合し、塩基対を形成するというルールがある。
- [用語3]
- 液–液相分離:空気中の水分子が結露して水滴となるように、水溶液中で、混和しやすい高分子同士が相互作用を通じて集合し、混和しにくい高分子同士が排斥し合うことで、流動性を持つ液体状の構造が分離すること。細胞機能の維持に不可欠で、液滴の物性とさまざまな病気との関連性が明らかになりつつある。
- [用語4]
- プログラマブルな分子:DNAでは、塩基対形成ルールを利用することで、DNA構造体の形状・機能・挙動を自在にプログラムできる。この分野はDNAナノテクノロジーと呼ばれ、国内外で広く研究されている。
- [用語5]
- 相状態:分子の相互作用により形成された相分離凝集体の流動性に関わる状態。水分子の場合は、「氷」–「液体」–「気体」の3状態をとる。DNAでは、それぞれ「ゲル」–「液体」–「分散」状態に相当する。
- [用語6]
- マイクロ流体工学:微細加工技術の進展にともない、髪の毛程度の微小な流路の作製が可能となった。流路中に水や油などの液体を流して、溶液の混合、単一なサイズを持つ液滴の作製、細胞のふるい分けなどさまざまな微小流体操作が可能。
- [用語7]
- 配列の相補性と直交性:塩基対形成ルールのもとで、互いに結合しやすい配列のことを相補性があるという。逆に、互いに結合させないように設計された相補性のない配列どうしを直交関係にあるという。
- [用語8]
- リンカーDNA:直交関係にある2種類のDNAモチーフの両方に結合することができるナノ構造体(図4b)。異なるDNAの間で界面活性剤のように働く。
- [用語9]
- トレーサー粒子:流れを実験的に評価する際に、流体の中に混ぜて流れ場を追跡(トレーシング)するための粒子。粒子の移動に対する画像解析から流れ場に関する定量的なデータを取り出す。
論文情報
- 掲載誌:
- Nature Communications
- タイトル:
- Remote-controlled mechanical and directional motions of photoswitchable DNA condensates
- 著者:
- Hirotake Udono, Shin-ichiro M. Nomura, Masahiro Takinoue(鵜殿寛岳、野村M.慎一郎、瀧ノ上正浩)
研究者プロフィール
鵜殿 寛岳 Hirotake UDONO
東京科学大学 情報理工学院 情報工学系 特任助教
研究分野:分子ロボティクス、DNA/RNAナノテクノロジー、人工細胞、分子コンピュータ、マイクロ流体工学
野村 M. 慎一郎 Shin-ichiro M. NOMURA
東北大学 大学院工学研究科 ロボティクス専攻 分子ロボティクス研究室 准教授
研究分野:分子ロボット、DNAナノテクノロジー、人工細胞、オートマター
瀧ノ上 正浩 Masahiro TAKINOUE
東京科学大学 情報理工学院 情報工学系 教授
研究分野:生物物理学、分子コンピューティング、人工細胞、DNA/RNAナノテクノロジー、分子ロボティクス
関連リンク
お問い合わせ
取材申込み
東京科学大学 総務企画部 広報課
- media@adm.isct.ac.jp
- Tel
- 03-5734-2975
- FAX
- 03-5734-3661