ポイント
- 副腎皮質細胞が、リン脂質 PI(3,4,5)P3の異常な蓄積によって脂肪細胞様に分化する現象を、世界で初めて実証しました。
- 内因性のリン脂質シグナルが、細胞の運命を決定づける分子スイッチとして働くことを明らかにしました。
- 本成果は、副腎を標的としたリン脂質シグナル制御による老化・ストレス応答への新しい介入戦略の可能性を示しました。
概要
東京科学大学(Science Tokyo) 総合研究院 難治疾患研究所 病態生理化学分野の柳井翔吾 日本学術振興会特別研究員(PD)、佐々木純子教授(キャリアアップ)、佐々木雄彦教授らの研究チームは、副腎皮質細胞が脂肪細胞様に分化転換する現象を、シグナル伝達リン脂質 PI(3,4,5)P3[用語1]の蓄積が誘導することを明らかにしました。副腎はストレス応答の主要なエフェクター臓器であり、通常は成熟脂肪細胞を含みませんが、まれに副腎脂肪腫が認められ、その成因は不明でした。
本研究では、副腎皮質で PI(3,4,5)P3 を分解する酵素 PTEN/SHIP2 を同時に欠損させたマウスを作製し、PI(3,4,5)P3 の蓄積がAKT経路[用語2]の持続活性化と転写因子 PPARγ[用語3]の異所性発現を介して、副腎皮質 X-zoneの細胞を脂肪細胞様に転換させることを実証しました。これにより、副腎に本来存在しない脂肪組織が出現する分子機構を動物モデルで再現し、内因性リン脂質シグナルが細胞運命を非遺伝的に制御することを示しました。
さらに、この知見は、ストレス応答や老化と内分泌代謝の接点に位置する副腎を標的とした、脂質シグナル制御に基づく介入の可能性を示唆します。
本成果は、9月9日付(米国東部時間)の米国科学アカデミー紀要「Proceedings of the National Academy of Sciences」に掲載されました。
背景
副腎はストレス応答や代謝調節に不可欠なコルチゾールなど、生命維持に必須のホルモンを産生する臓器であり、その正常な機能は全身の恒常性維持に直結しています。通常、副腎には脂肪細胞やその前駆細胞は存在せず、内分泌器官として特化した構造を持っています。しかし、臨床では副腎に脂肪組織が出現する「副腎脂肪腫」と呼ばれる良性腫瘍が報告されてきました[参考文献1]。この腫瘍は比較的まれな疾患とされますが、画像診断技術の発展に伴い偶発的に発見される機会が増えており、内分泌疾患の臨床現場においても一定の重要性を持ち始めています。
一方で、副腎に本来存在しない脂肪細胞がなぜ出現するのか、その発症メカニズムは長らく不明でした。実験動物でも同様の病態を再現するモデルは存在せず、分子基盤を明らかにすることは困難でした。そのため、臨床現場では診断がついても治療は外科的切除に依存せざるを得ず、分子機構に基づく新しい治療戦略の開発には至っていませんでした。
このように、副腎脂肪腫の研究は、病態理解という医学的課題に加え「細胞の運命を決定する内因性因子は何か」という基礎生命科学上の根本的な問いにも直結します。脂質シグナルが細胞分化や運命決定にどのように関与するかを解明することは、がん研究や再生医療といった社会的インパクトの大きい分野への波及も期待され、本研究を推進する強い動機となりました。
研究成果
研究チームは、細胞膜リン脂質 PI(3,4,5)P3 を分解する酵素 PTEN と SHIP2 を副腎皮質で特異的に同時欠損させたマウスを作製し、副腎における PI(3,4,5)P3 の異常蓄積を再現しました。その結果、副腎皮質細胞は通常のステロイド産生細胞としての特徴を失い、細胞増殖や代謝制御に関わる主要なシグナル伝達経路であるAKT経路が持続的に活性化するとともに、転写因子 PPARγが異所性に発現し、脂肪細胞様の形質を獲得することが観察されました(図1)。
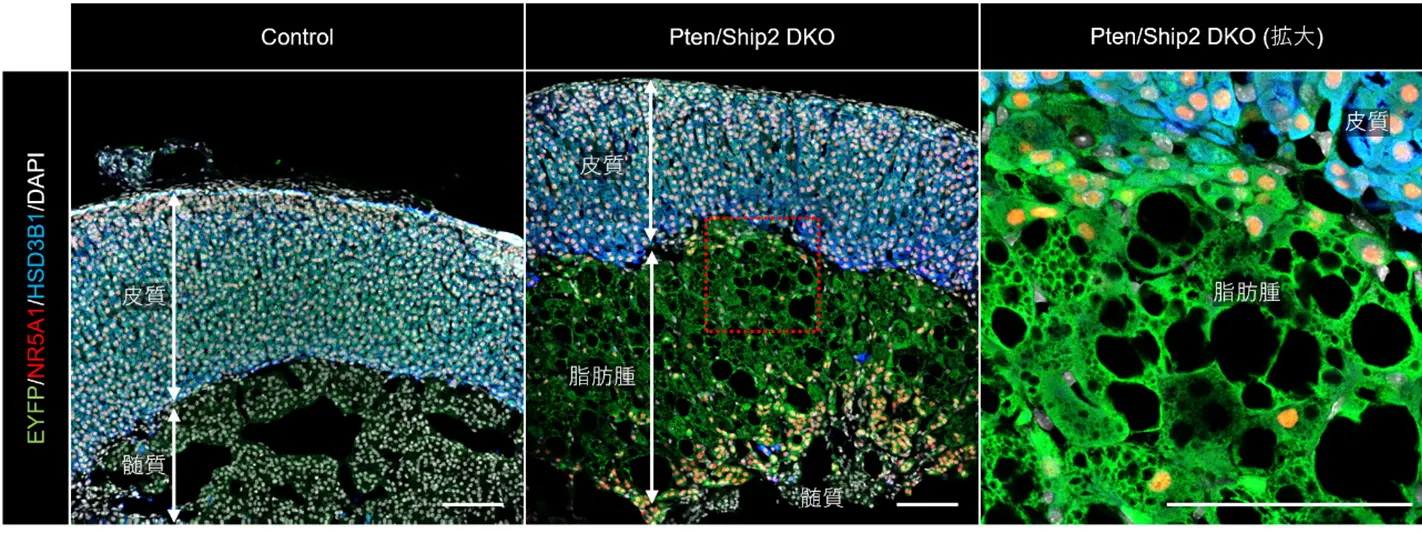
さらに、詳細な細胞系譜解析(lineage tracing)を行った結果、この脂肪細胞様に転換した細胞が副腎皮質の X-zone細胞 に由来することが明らかになりました(図2)。X-zoneはマウスの加齢や性ホルモンの影響で変化する領域として知られていましたが、脂肪腫形成に直接関与することが示されたのは今回が初めてです。
次に、この現象が実際にAKT経路に依存しているかを検証するため、三重遺伝子改変(トリプルノックアウト)解析を実施しました。その結果、AKT経路を抑制することで脂肪腫形成が阻止されることが明らかとなり、PI(3,4,5)P3 の異常蓄積が AKT–PPARγ 転写制御を介して副腎脂肪腫形成を駆動する因果関係が直接的に証明されました。
本研究は、これまで実験動物では再現できなかった副腎脂肪腫の形成過程を忠実にモデル化し、脂質シグナルが細胞運命を転換させる分子基盤を明らかにした点で、大きな意義を持ちます。
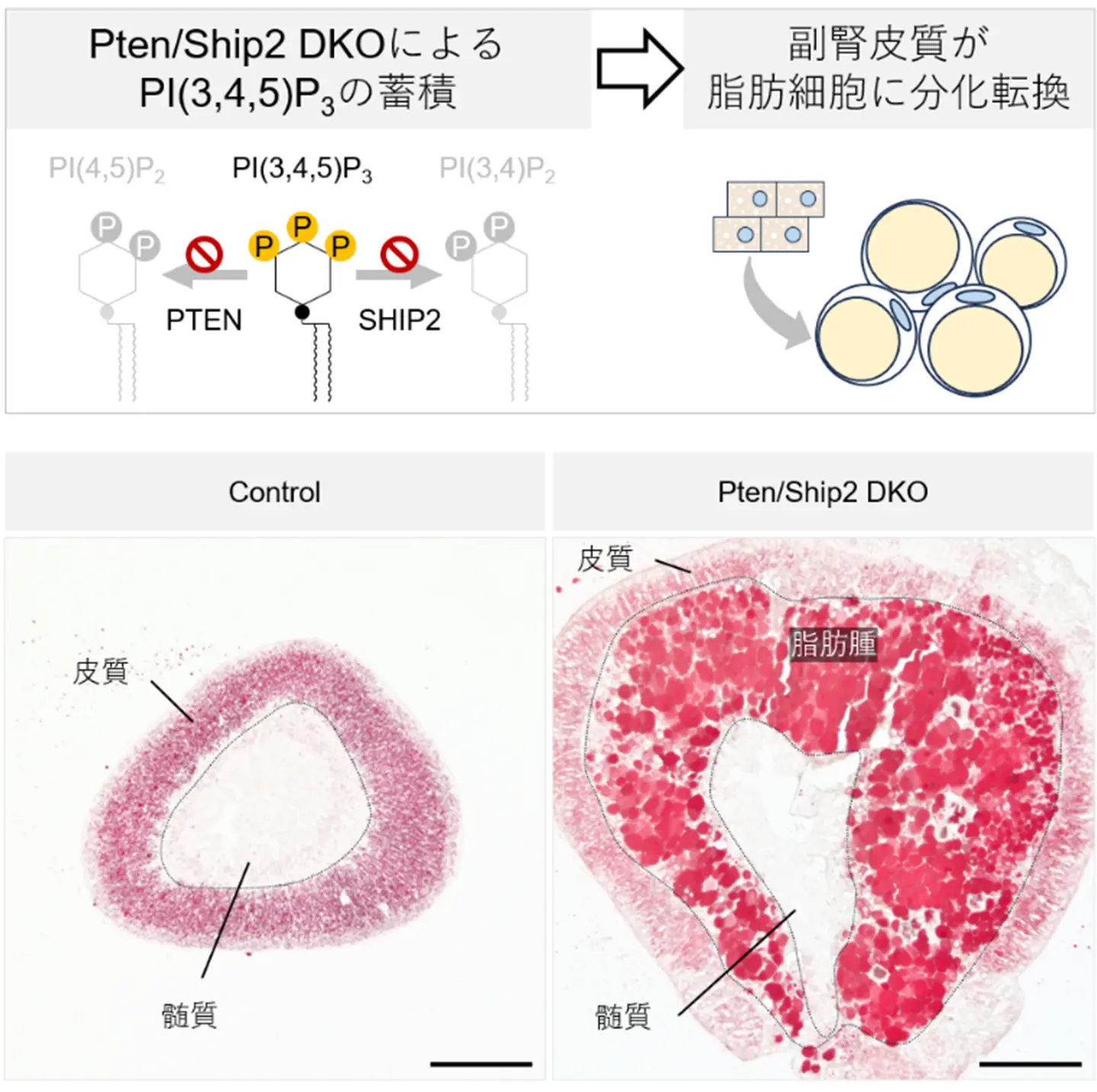
(下)副腎は皮質と髄質から構成される組織であるが、 Pten/Ship2を欠損した副腎では大量の脂肪細胞(脂肪腫)が皮質と髄質の境界部に出現した。
社会的インパクト
本研究は、細胞運命を非遺伝的に制御できる内因性脂質シグナルの存在を初めて実証したものであり、再生医療やがん研究に新たな概念を提示します。副腎はストレス応答の中枢的な臓器であり、代表的なホルモンであるコルチゾールは、ストレスに対する生体の適応、血糖値の維持、免疫応答の調節など、多方面にわたって恒常性を支える重要な役割を担っています。また、社会的ストレスや慢性的な心理的負荷が副腎機能を変化させ、うつ病や不安障害、生活習慣病など幅広い疾患のリスクを高めることも知られています。
このような副腎に脂肪組織が生じる「副腎脂肪腫」の発症メカニズムを分子レベルで初めて明らかにしたことは、単なる希少疾患の理解にとどまらず、ストレス応答と内分泌機能の破綻がどのように病態形成に結びつくかを考える上で大きな意味を持ちます。さらに、従来は外科的切除しか選択肢がなかった副腎脂肪腫に対して、PI3K–AKT–PPARγ 経路を標的とした分子治療という新しい戦略を提示した点でも重要です。本研究は、基礎研究の成果を社会的課題の解決へとつなげる可能性を切り拓くものです。
今後の展開
本研究で明らかにした PI(3,4,5)P3/AKT を軸とする脂質シグナルによる細胞運命転換は、副腎脂肪腫の枠を超え、老化や社会的ストレスが内分泌–代謝系に及ぼす影響の理解にも直結すると考えられます。とりわけ、高齢化に伴い視床下部–下垂体–副腎(HPA)軸の反応性やコルチゾール[用語4a]の日内リズムが乱れ、慢性的な社会的ストレスにアロスタティック・ロード(allostatic load)[用語4b]が増大し、代謝・免疫・神経系の脆弱性が高まることが報告されています。これにより、超高齢社会・ストレス社会における健康寿命延伸という課題との接点が一層明確になっています[参考文献2]。
今後は、副腎が担うストレス応答と脂質シグナルのクロストークを、加齢に伴う内分泌環境の変化や生体ロバストネスの低下と結びつけて検証し、慢性的な社会的ストレスが PI(3,4,5)P3/AKT 経路と転写ネットワーク・エピジェネティクス・代謝恒常性をどのように再配線するのかを、多層オミクスと操作実験によって明らかにします。さらに、副腎以外の臓器における病的脂肪化や脂肪腫でも同様のメカニズムが作動するかを横断的に評価し、脂質シグナルを介した細胞リプログラミングを一般原理として定式化することを目指します。
これにより、PI3K–AKT–PPARγ 経路の段階的制御点を標的とした治療戦略の開発と、バイオマーカーの創出による層別化・予防介入への道が拓かれます。
付記
本研究は、国立研究開発法人日本医療研究開発機構(AMED)CREST「根本的な老化メカニズムの理解と破綻に伴う疾患機序解明」、日本学術振興会 科学研究費助成事業(23KJ0833、24K19302、24K02220、23K27319)の支援を受けて実施されました。また、文部科学省 共同利用・共同研究拠点事業、難治疾患共同研究拠点、学際領域展開ハブ形成プログラム「多階層ストレス疾患の克服」(JPMXP1323015483)、高深度オミクス医学研究拠点整備事業、セコム科学財団 一般研究助成の支援を受けました。
参考文献
- [1]
- Calissendorff, J., Juhlin, C.C., Sundin, A., Bancos, I., Falhammar, H. Adrenal myelolipomas. Lancet Diabetes Endocrinol 9, 767–775 (2021)
- [2]
- Lupien SJ, McEwen BS, et al. Effects of stress throughout the lifespan on the brain, behaviour and cognition. Nature Reviews Neuroscience (2009)
用語説明
- [用語1]
- PI(3,4,5)P3:Phosphatidylinositol 3,4,5-trisphosphate。細胞膜で働くシグナル伝達リン脂質。PI3Kにより産生され、ストレス応答や受容体刺激に応じてその量が増減する。
- [用語2]
- AKT経路:細胞の増殖・代謝・生存を調節する主要なシグナル経路。AKTはPI(3,4,5)P3に直接結合して細胞膜へリクルートされ、活性化後に多様な基質タンパク質をリン酸化して機能を制御する。
- [用語3]
- PPARγ:Peroxisome Proliferator-Activated Receptor γ。脂肪細胞分化を司る“マスターレギュレーター”として知られる転写因子。
- [用語4a]
- HPA軸とコルチゾール:視床下部–下垂体–副腎(HPA)軸はストレス応答の中枢であり、コルチゾールは代謝や免疫を調節するホルモン。加齢や社会的ストレスによりHPA 軸の日内リズムや反応性が乱れると、生体負荷(アロスタティック・ロード)が増大し、疾患リスクが高まる。
- [用語4b]
- アロスタティック・ロード:[用語4a]参照
論文情報
- 掲載誌:
- Proceedings of the National Academy of Sciences of the United States of America
- タイトル:
- Adrenal lipoma formation via PI(3,4,5)P3/AKT-dependent transdifferentiation of adrenocortical cells into adipocytes
- 著者:
- Shogo Yanai, Junko Sasaki, Hyeon-Cheol Lee-Okada, Fumiya Takahashi, Yuto Kikuchi, Shin Morioka, Toshiyoshi Yamamoto, Katsuya Yuguchi, Miko Oikawa, Hiroaki Kajiho, Takashi Baba, Chikako Yokoyama, Ken-Ichirou Morohashi, Akira Suzuki, Takehiko Yokomizo, Takehiko Sasaki
研究者プロフィール
柳井 翔吾 Shogo YANAI
東京科学大学 総合研究院 難治疾患研究所
日本学術振興会特別研究員(PD)
研究分野:発生生物学、分子生物学

佐々木 純子 Junko SASAKI
東京科学大学 総合研究院 難治疾患研究所 教授(キャリアアップ)
研究分野:生化学、分子生物学

佐々木 雄彦 Takehiko SASAKI
東京科学大学 総合研究院 難治疾患研究所 教授
研究分野:生化学、分子生物学
関連リンク
更新履歴
- 2025年10月9日 研究者プロフィールのローマ字表記を変更しました。