ポイント
- 指定難病である遺伝性疾患ネフロン癆(ろう)において、Hippoシグナルが腎線維化の進行に関与し、Hippoシグナル阻害剤で抑制できることを解明。
- ネフロン癆の最多原因であるNPHP1遺伝子を欠損させたiPS細胞から腎臓オルガノイドを作製し、疾患モデルを確立。
- NPHP1欠損腎オルガノイドは正常と比べて線維化が起こりやすく、その線維化にはHippoシグナル異常があることを確認。
- Hippoシグナル阻害剤が新たな治療薬候補となる可能性を示し、臨床応用への道を拓く成果。
概要
東京科学大学(Science Tokyo) 大学院医歯学総合研究科 腎臓内科学分野の蘇原映誠准教授、須佐紘一郎講師、鈴木健文大学院生らの研究チームは、ヒトiPS細胞から作製した腎オルガノイドモデルを用い、動物モデルでは再現が難しかったネフロン癆の疾患モデルを構築しました。さらに、このモデルを用いてネフロン癆の病態を解明し、新規治療薬候補の抽出にも成功しました。
ネフロン癆は、腎臓が線維化して腎機能が低下する遺伝性疾患で、小児の末期腎不全の5~10%を占めるとともに、成人の慢性腎臓病の原因としても近年注目されています。しかし、これまで有効な治療法は見つかっておらず、人工透析や腎移植を避けることが難しいのが現状です。今回の研究成果は、世界で初めてヒト由来のネフロン癆疾患モデル上で治療薬の効果を示したものであり、今後の実際的な治療薬開発につながることが期待されます。
本成果は、9月19日(現地時間)に「Stem Cell Research & Therapy」誌に掲載されました。
背景
遺伝性腎疾患であるネフロン癆は、腎臓の尿細管細胞の機能異常によって腎臓が線維化し、腎機能が低下する指定難病です。原因遺伝子の中でもNPHP1の変異が最も多いことが知られていますが、動物モデルでの再現が難しく、研究開発を阻んできました。
ネフロン癆は小児の末期腎不全の5~10%を占める重要な疾患である一方、成人の末期腎不全患者を対象に遺伝子検査を行った結果、0.5%の症例でNPHP1欠損によるネフロン癆が背景にあることが判明したとの報告もあります。そのため、成人の慢性腎臓病の原因としても注目されています。
しかし、これまでに数十種類のネフロン癆原因遺伝子が同定されているにもかかわらず、病態解明は依然として途上であり、有効な治療法も確立されていません。そのため、病気の進行を抑えることができず、人工透析や腎移植といった腎代替療法を避けることが難しいのが現状です。
研究成果
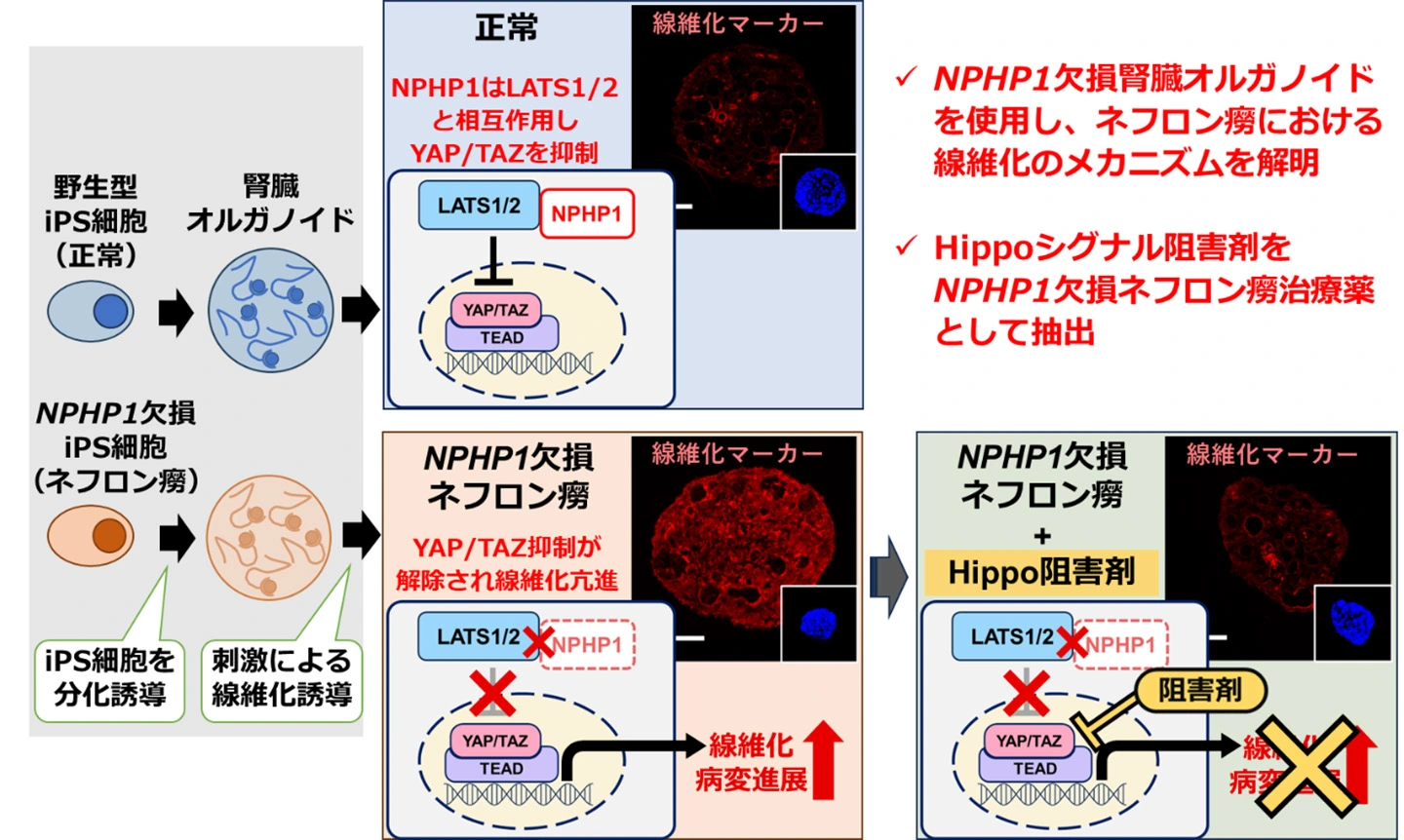
NPHP1欠損ネフロン癆は動物モデルでの再現が難しいため、ヒト細胞を用いた疾患モデルの開発が必要であると考えました。そこで、遺伝子改変技術であるCRISPR/Cas9システムを用いて、ネフロン癆の主要な原因遺伝子であるNPHP1を完全に欠損させたヒトiPS細胞株を作製しました[参考文献1]。さらに、このNPHP1完全欠損iPS細胞からミニチュア腎臓である「3次元腎オルガノイド」を分化誘導し、ヒト細胞によるネフロン癆の疾患モデルを確立しました。
このNPHP1完全欠損腎オルガノイドを解析したところ、遺伝子変異のない正常腎オルガノイドと比較して早期に線維化が惹起されることが明らかとなりました。また、炎症性サイトカインによる刺激を加えた場合にも、正常腎オルガノイドに比べて線維化が容易に生じることが確認されました。これらの結果は、腎臓への後天的ストレスの程度によって疾患の進展に差が生じることを示唆しており、実際の患者における重症度の個人差を説明できる可能性があります。
さらに、NPHP1タンパク質がHippoシグナル経路の構成分子であるLATS1/2と結合する点に着目して解析を行った結果、NPHP1完全欠損腎オルガノイドでは線維化の進行とともにHippoシグナル下流遺伝子の転写活性が異常に亢進していることが判明しました。
そこで、Hippoシグナルを阻害する薬剤を投与し、NPHP1完全欠損腎オルガノイドの線維化が抑制されるかを検討しました。その結果、複数のHippoシグナル阻害剤で線維化が有意に抑制され、治療薬候補となりうることが示唆されました。これらの薬剤の中には、すでに他疾患の治療に臨床使用されているものも含まれていました。
社会的インパクト
本研究により、NPHP1欠損ネフロン癆においてHippoシグナルが線維化の進展に関与すること、そしてHippoシグナル阻害剤が治療薬候補となることを世界で初めて明らかにしました。本成果は、これまで有効な治療法が存在しなかったネフロン癆研究に大きな意義を持つ報告です。さらに、既に臨床で利用されている薬剤の有効性が確認されれば、早期の社会実装につながる可能性があります。
今後の展開
今後は、さらなる候補薬剤の同定を進めるとともに、臨床試験の実施に向けた検討を行う予定です。
付記
本研究は、国立研究開発法人日本医療研究開発機構(AMED、JP21ek0310018、JP22ek0310018、JP23ek0310018、21ek0109554h0001、22ek0109554h0002、23ek0109554h0003、24gm6910017h0001、24ek0310023h0001、19ek0109304h0002)、文部科学省科学研究費助成事業(19K17699、21K08223、24K11426、19H03672、24K02465、22K19518、23K19610、24K19143、19H01049)、公益財団法人武田科学振興財団、および公益財団法人上原記念財団の支援を受けて行われました。
参考文献
- [1]
- Generation of NPHP1 knockout human pluripotent stem cells by a practical biallelic gene deletion strategy using CRISPR/Cas9 and ssODN:Y Nakano, K Susa, E Sohara et al., In vitro cellular & developmental biology. Animal: 2022; 58: 85-95
論文情報
- 掲載誌:
- Stem Cell Research & Therapy
- タイトル:
- iPSC-based drug discovery identified the Hippo signaling pathway as a therapeutic target in the fibrosis of NPHP1-deficient nephronophthisis
- 著者:
- Takefumi Suzuki1, Koichiro Susa1, Hiroaki Kikuchi1, Yuta Nakano1, Tomoki Yanagi1, Yu Hara1, Tamami Fujiki1, Fumiaki Ando1, Shintaro Mandai1, Yutaro Mori1, Takayasu Mori1, Hiroaki Iwasa2, Yutaka Hata3, Shinichi Uchida1, Eisei Sohara1
- 所属:
- 1 東京科学大学 医歯学総合研究科腎臓内科学分野
2株式会社ペルセウスプロテオミクス
3 社会医療法人駿甲会甲賀病院予防医療センター
研究者プロフィール
鈴木 健文 Takefumi SUZUKI
東京科学大学 大学院医歯学総合研究科 腎臓内科学分野 大学院生
研究分野:慢性腎臓病、iPS細胞

須佐 紘一郎 Koichiro SUSA
東京科学大学 大学院医歯学総合研究科 腎臓内科学分野 講師
研究分野:慢性腎臓病、iPS細胞

蘇原 映誠 Eisei SOHARA
東京科学大学 大学院医歯学総合研究科 腎臓内科学分野 准教授
研究分野:慢性腎臓病、遺伝性腎疾患、嚢胞性腎疾患

関連リンク
お問い合わせ
東京科学大学 大学院医歯学総合研究科 腎臓内科学分野
講師 須佐 紘一郎
- ksusa.kid@tmd.ac.jp
- Tel
- 03-5803-5214
- Fax
- 03-5803-5215
東京科学大学 大学院医歯学総合研究科 腎臓内科学分野
准教授 蘇原 映誠
- esohara.kid@tmd.ac.jp
- Tel
- 03-5803-5214
- Fax
- 03-5803-5215