ポイント
- 低免疫原性iPS細胞由来肝臓オルガノイドと顆粒球・単球吸着カラムを組み合わせた、世界初の体外肝機能補助循環システムUTOpiA[用語1]を開発
- UTOpiAシステムを用いることで肝障害軽減、肝機能補填、肝再生促進などの複合的な効果が発現
- 致命率の高い慢性肝不全急性憎悪や急性肝不全モデルに対し、大幅な生存率の改善に成功
- 数年以内の臨床試験に向けて開発が進展、将来的に革新的な再生医療等製品の実用化が期待
概要
東京科学大学 大学院医歯学総合研究科の山口仁美医師(博士後期課程学生)、同 総合研究院 ヒト生物学研究ユニットの武部貴則教授(大阪大学 大学院医学系研究科 教授/同ヒューマン・メタバース疾患研究拠点 副拠点長)、大阪大学大学院医学系研究科の米山鷹介講師らの研究グループは、iPS細胞由来のオルガノイドを組み込んだ肝機能補助療法「UTOpiAシステム」を開発しました。
肝硬変などの慢性肝不全の患者が感染症や消化管出血、アルコール多飲など何らかの誘因により発症し、28日以内に急激に肝機能が低下する疾患である慢性肝不全急性憎悪(ACLF: Acute-on-chronic liver failure)は、致命率が高く、臓器移植以外の効果的な治療法の確立が大きな課題となっていました。
今回、研究グループは、顆粒球・単球アフェレーシス(GMA)[用語2]と、HLA遺伝子を改変したヒトiPS細胞[用語3]由来肝オルガノイド(iHLC)を組み合わせた全血体外循環システム「UTOpiA」を開発しました。ラットACLFおよび急性肝不全モデルにおいて、UTOpiAの治療効果を検証した結果、昏睡の軽減、高アンモニア血症や高ビリルビン血症の改善、全身性炎症の抑制が確認され、生存率を大幅に改善できることが判明しました。さらに、治療を受けた動物の肝臓において、再生応答が促される効果を認めました。
以上の結果から、UTOpiAは抗炎症作用と代謝・合成機能、再生促進作用などを同時に提供することで、重症肝不全に対する新しい治療手段となり得ることが示唆されました。今後、数年内に臨床試験への移行を予定しており、将来的には重症度が高い肝不全の患者救済に資する革新的な再生医療等製品の開発が期待されます。
本研究成果は、欧州科学誌「Journal of Hepatology」に、10月2日(木)16時(日本時間)に公開されました。
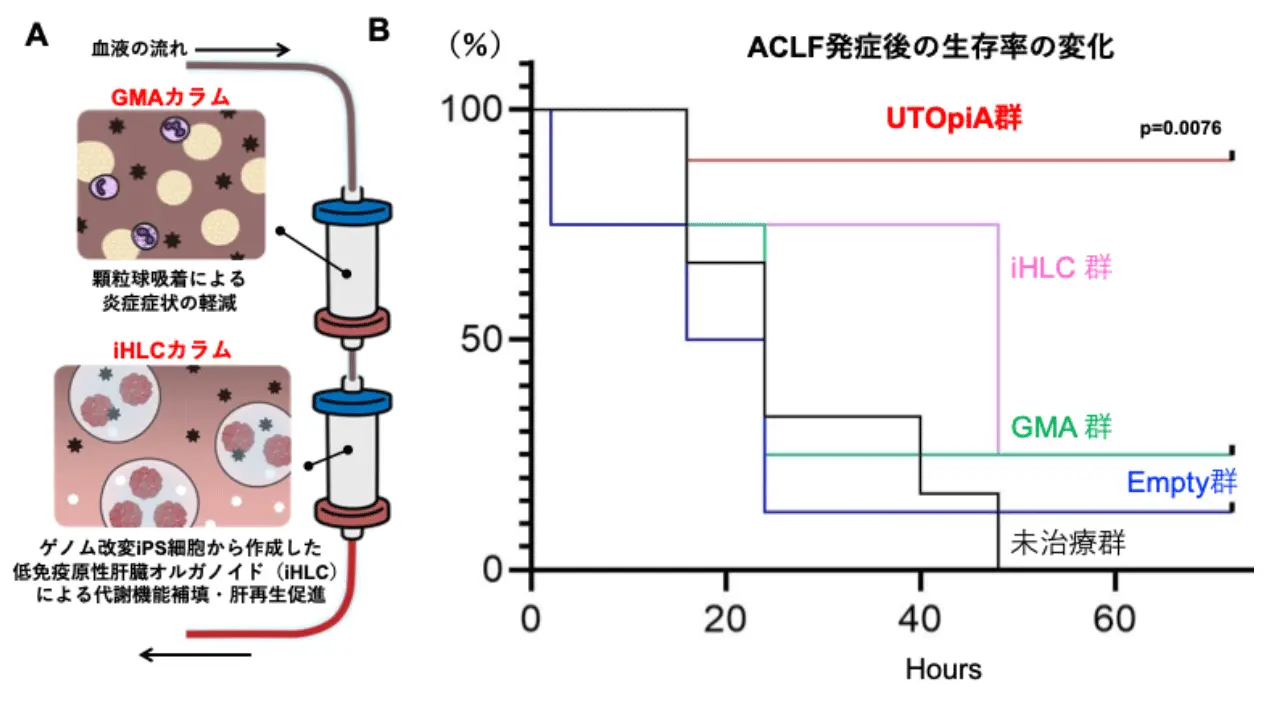
A.UTOpiAの構成要素と概念図
B.慢性肝不全急性憎悪に対する治療効果
武部貴則教授のコメント
本研究の発端は、肝臓領域で強みを持つグローバル製薬企業のエグゼクティブと、肝再生医療の可能性を意見交換したことでした。その後、山口さんが素晴らしい予備データを取得し、米山さんの指導のもと、多くのチームメンバーの尽力により具現化へとつながりました。肝移植以外に有効な治療選択肢が乏しい現状を打破する挑戦の一歩として、未来の患者救済につなげるため臨床開発を加速したいと考えています。
背景
慢性肝不全急性憎悪(ACLF: Acute-on-chronic liver failure)は、もともと肝硬変などの慢性肝臓病を持つ人に急激な悪化が起こり、複数の臓器が機能不全に陥る危険な病気です。肝硬変などの慢性肝不全の患者が感染症や消化管出血、アルコール多飲など何らかの誘因により発症し、28日以内に急激に肝機能が低下する疾患です。重症度が高い場合の生存率は約20%と低く、効果的な治療法の確立が課題でした。特に、集中治療の研究は進んでいますが、この病態で起きる重大な全身性炎症反応症候群や肝機能不全を根本的に治療する方法が確立されていないのが現状です。
現在のところ肝移植が唯一の根治治療とされていますが、提供できる臓器が不足しており、多くの患者が移植を待つ間に命を落としています。これまでにも血液を体外で処理して炎症を抑えたり、人工的に肝臓の機能を補ったりする治療法が試みられてきましたが、炎症を抑えることは困難で、肝臓の代謝を十分に補える仕組みを同時に備えたものはありませんでした。
研究の内容
今回、研究グループは、顆粒球・単球アフェレーシス(GMA)と、新たに作製したiPS細胞由来の肝細胞を含むオルガノイド(iHLC)を組み合わせた体外循環システム「UTOpiA」を開発しました。このシステムは、炎症を引き起こす白血球を除去する役割を持つGMAカラムと、拒絶反応を起こしにくいようにゲノム編集したiHLCをアルギン酸ゲルでカプセル化して充填したカラムの、2つを直列に接続した構成となっています(図2)。
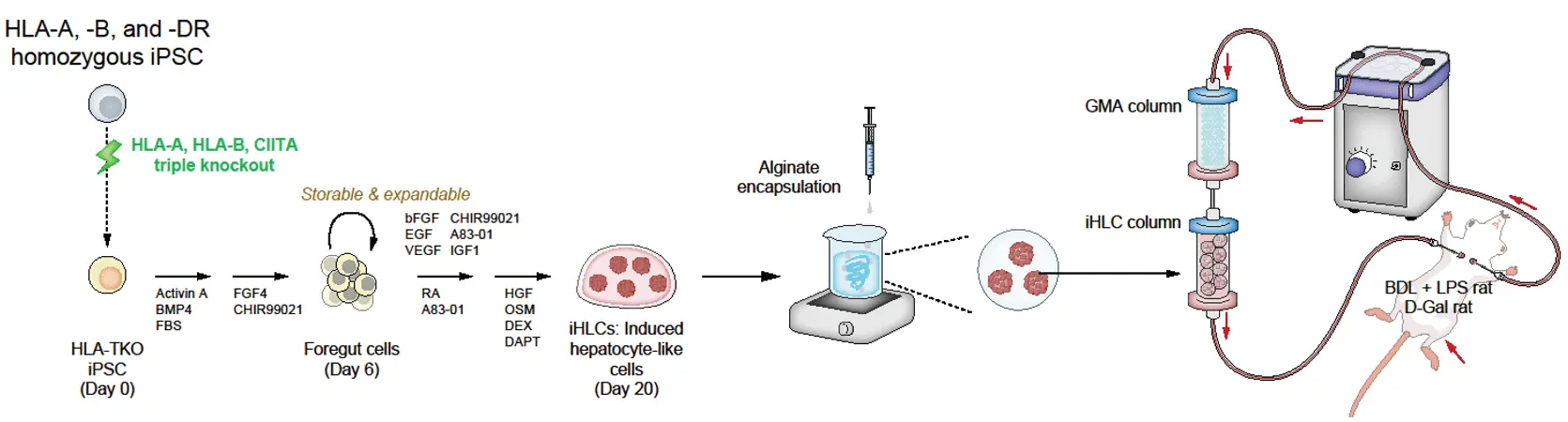
本研究グループは、まず、拒絶に関わるHLA-A, B, CIITAの3つの遺伝子を除去したヒトiPS細胞からiHLCを作製しました。iHLCは、アルブミンの産生、ビリルビンの取り込み、尿素回路の機能など、主な肝機能を備えていることに加え、免疫を刺激するHLA分子の発現が低く抑えられることが確認されました。次に、人工イクラなどの成分に用いられるアルギン酸を用いてiHLCを小さなゲル状のカプセルに包むことで、血液を安全に接触させる方法を考案しました。このゲルを充填したiHLCカラムとGMAカラムを直列につなぐことで、血液を直接還流できる体外循環システムを構築し、UTOpiAと命名しました。
UTOpiAの治療効果は、2つの動物モデルによって確認されています。まず、肝胆管結紮(BDL)によって作製した肝硬変モデルのラットに対して、リポ多糖(LPS)を腹腔内投与して急性発症を誘導し、ヒトの重度肝不全に近い状態(ACLFモデル)を用いて検証しました。その結果、何も治療しない群では48時間以内に生存率が10%以下まで低下するのに対して、UTOpiAで治療を行った群の生存率は88.9%まで改善しました。(図1)。さらに腎障害の指標(クレアチニン値)の改善、昏睡状態、肝機能、高アンモニア血症、高ビリルビン血症、全身性炎症などの症状が軽減されることを示しました。UTOpiA治療後には肝臓のダメージを示す血液指標(AST、ALT、アンモニアなど)の上昇が抑制され、肝組織の損傷も軽減しました。同様の効果は、急性肝不全を引き起こす別のラットモデル(D-ガラクトサミンモデル)においても認められました。
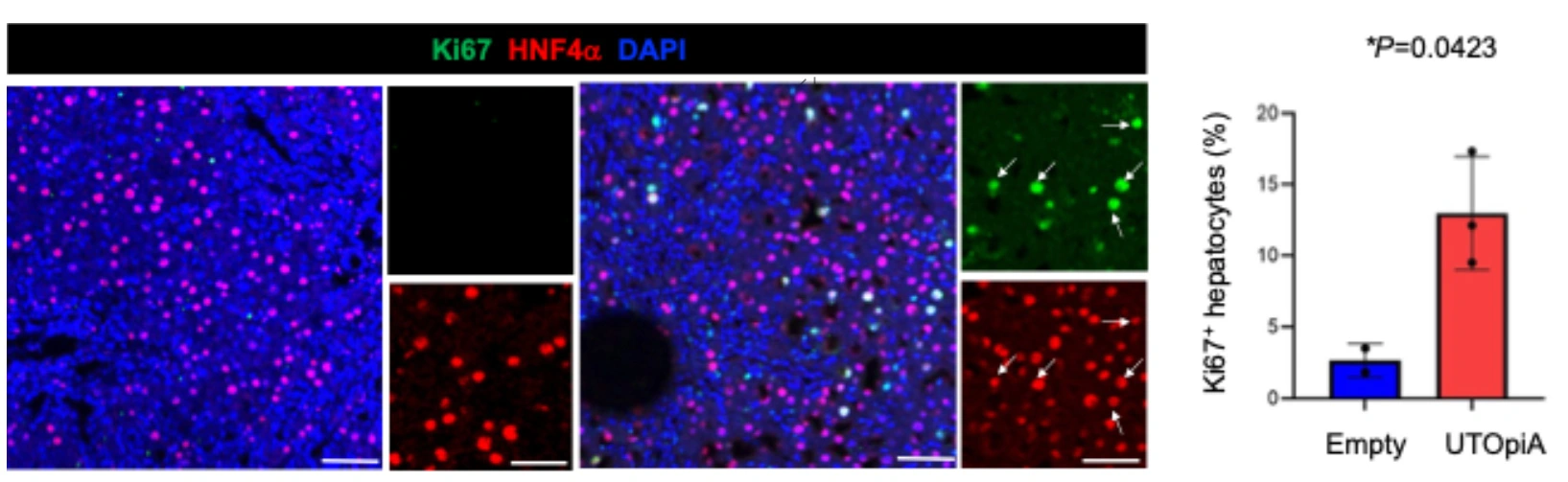
興味深いことに、UTOpiAの治療後には、肝不全モデル動物の肝細胞の代謝やエネルギー産生機能が回復することが判明しています。例えば、網羅的な遺伝子発現解析の結果からは、主にアミノ酸や脂肪酸の代謝に関わる遺伝子が活性化されていました。さらに、血中のHGF(肝細胞成長因子)の濃度が上昇し、壊死した細胞の周囲が回復していることから、UTOpiAにはACLF状態の肝臓に対して肝細胞の増殖を促し、損傷した組織の再生を助ける効果もあることが明らかになりました(図3)。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果により、UTOpiAの体外循環システムが死亡率の高いACLFをはじめとする重症肝不全に対する革新的な治療法となることが期待されます。現在は、製品化に向けて大量製造方法の確立や、大動物試験でのシステム検証に取り組んでおり、数年以内の臨床試験の開始を見込んでいます。
付記
なお、本研究は、主として、以下の期間の事業の研究の一環で行われました。
日本医療研究開発機構(AMED)
- 再生・細胞医療・遺伝子治療実現加速化プログラム「機能強化型肝臓オルガノイドを用いたUTOpiAシステムの開発」
- 肝炎等克服実用化研究事業「細胞死耐性化オルガノイドを搭載した人工肝臓システムによる末期肝不全の治療法開発」
用語説明
- [用語1]
- UTOpiA:Universal Tandem Optimized iHLC with Apheresis Systemの略。横浜市立大学発認定ベンチャーKanzo Biomedicines, Inc.(米国)が開発に携わっている。
- [用語2]
- 顆粒球・単球アフェレーシス(GMA):顆粒球と単球は白血球の一種で、体内に侵入した細菌やウイルスを貪食して分解したり、アレルギー反応に関与したりすることで知られています。GMAはこれらを血液成分から体外で除去(アフェレーシス)するもので、UTOpiAで重要な役割を果たしています。
- [用語3]
- iPS細胞:人工多能性幹細胞(induced pluripotent stem cell)のこと。体細胞に特定因子(初期化因子)を導入することにより樹立される、ES細胞に類似した多能性幹細胞です。山中伸弥教授グループの研究により、世界で初めて2006年にマウス体細胞を、 2007年にヒト体細胞を用いて樹立に成功しました。
論文情報
- 掲載誌:
- Journal of Hepatology
- タイトル:
- Reversal of ACLF and ALF using whole blood extracorporeal system combining HLA-depleted liver organoids with granulocyte-monocyte apheresis
- 著者:
- Hitomi Yamaguchi, Yosuke Yoneyama, Kentaro Ichimura, Kanae Ohtsu, Mika Soen, Chiharu Moriya, Maki Kumagai, Rob Myers, G Mani Subramanian, Takanori Takebe
関連リンク
お問い合わせ
大阪大学 大学院医学系研究科 教授/ヒューマン・メタバース疾患研究拠点 副拠点長
東京科学大学 総合研究院ヒト生物学研究ユニット 教授 武部 貴則
- ttakebe.ior@tmd.ac.jp
東京科学大学 総務企画部 広報課
- Tel
- 03-5734-2975
- Fax
- 03-5734-3661
- media@adm.isct.ac.jp