ポイント
- 温度調整によって細胞分離条件を自在に変えられる「可変型細胞分離チップ」を開発。
- 微細に配置された温度応答性ハイドロゲル「PNIPAM」の利用により、臨界径を変調。
-
細胞診断・がん検出・再生医療などの用途ごとの細胞分離条件に柔軟に対応。
概要
東京科学大学(Science Tokyo) 総合研究院 未来産業技術研究所の西迫貴志准教授、菅野佑介助教、工学院機械系機械コースのJIANG Ze(キョウ・タク)大学院生らの研究グループは、温度応答性ハイドロゲル「PNIPAM(ポリ(N-イソプロピルアクリルアミド))[用語1]」を用いた可変臨界径型DLD(Deterministic Lateral Displacement)[用語2] マイクロ流体デバイス[用語3]を開発し、標的細胞に応じた分離条件の切り替えを温度制御のみで行うことができる新たな細胞分離技術を確立しました。
今回開発したデバイスでは、熱伝導性の高いシリコン基板とペルチェ素子[用語4]を用いた高精度温度制御により、マイクロピラー構造のサイズ(臨界径[用語5])を温度に応じて動的に変化させることができます。その結果、1台のデバイスでありながら分離モードを切り替えることで異なる細胞サイズに対応することが可能となり、従来の「1条件=1デバイス」という制約を打破しました。がん細胞を含む血液サンプルを用いた実証実験では、25 °Cでは17.6 μmのMCF-7細胞を高純度に分離し、37 ℃ では分離せず混合状態を維持するなど、温度に明確に依存する分離性能を示しました。
本技術は、がん診断、再生医療、細胞治療などの分野で求められる、細胞サイズに応じた柔軟な処理や選別を、コスト効率よく実現するための革新的なプラットフォームとなる可能性があり、今後のバイオ・メディカル応用への展開が期待されます。
本研究成果は、英国王立化学会発行「Lab on a Chip」オンライン版で9月9日に先行公開され、12月21日付掲載号のバックカバーに採用されました。

掲載号のバックカバーに採用
背景
細胞分離は、がん診断や再生医療、免疫解析、単一細胞ゲノミクスなど、さまざまなバイオメディカル分野において不可欠な技術です。多様な細胞が混在する生体サンプルから、特定の細胞種を高精度に分離・回収することは、疾患の早期発見や治療法の開発、さらには創薬研究の効率化に直接的に寄与します。
従来の細胞分離技術として、抗体を用いた細胞表面マーカーに依存する方法が多く用いられてきましたが、コストや処理時間がかさむ、細胞にダメージが加わる、といった課題を抱えています。細胞表面マーカー依存型の手法に対して、細胞の物理的なサイズや機械的特性に基づくマイクロ流体デバイスによるラベルフリー細胞分離[用語6]技術は、迅速かつ非侵襲的に標的細胞を抽出できる点で、近年特に注目されています。中でもDeterministic Lateral Displacement (DLD) は、細胞のサイズに応じて流路内で異なる経路へと誘導する受動型の分離法であり、マイクロスケールの高精度分離を可能にします。しかし、従来のDLDデバイスは臨床応用において重要な、“異なるサイズの細胞を同一チップ上で可変的に分離する”といった柔軟性に乏しいという課題がありました。
研究成果
本研究では、温度制御によって臨機応変に分離サイズ(臨界径)を切り替えられる細胞分離プラットフォームを世界で初めて実現しました。具体的には、ポリ(N-イソプロピルアクリルアミド)(PNIPAM)と呼ばれる温度応答性高分子を微細構造体(マイクロピラー)として配列し、20~40℃の範囲で流路内の温度を制御することで、細胞サイズに応じた選択的分離が可能になりました(図1, 2)。
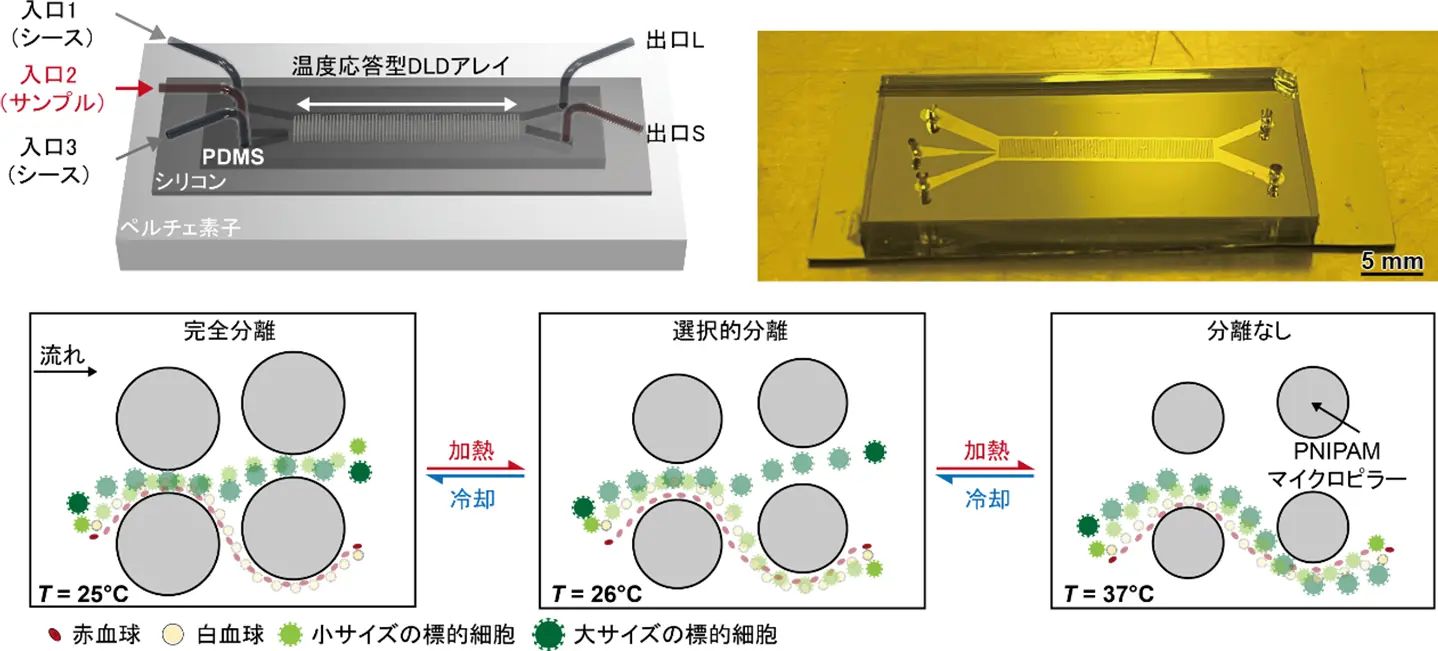
完全分離モードでは赤血球と白血球と細胞(大・小)を分けることができ、選択的分離モードでは大サイズ細胞のみを分離できることを実証
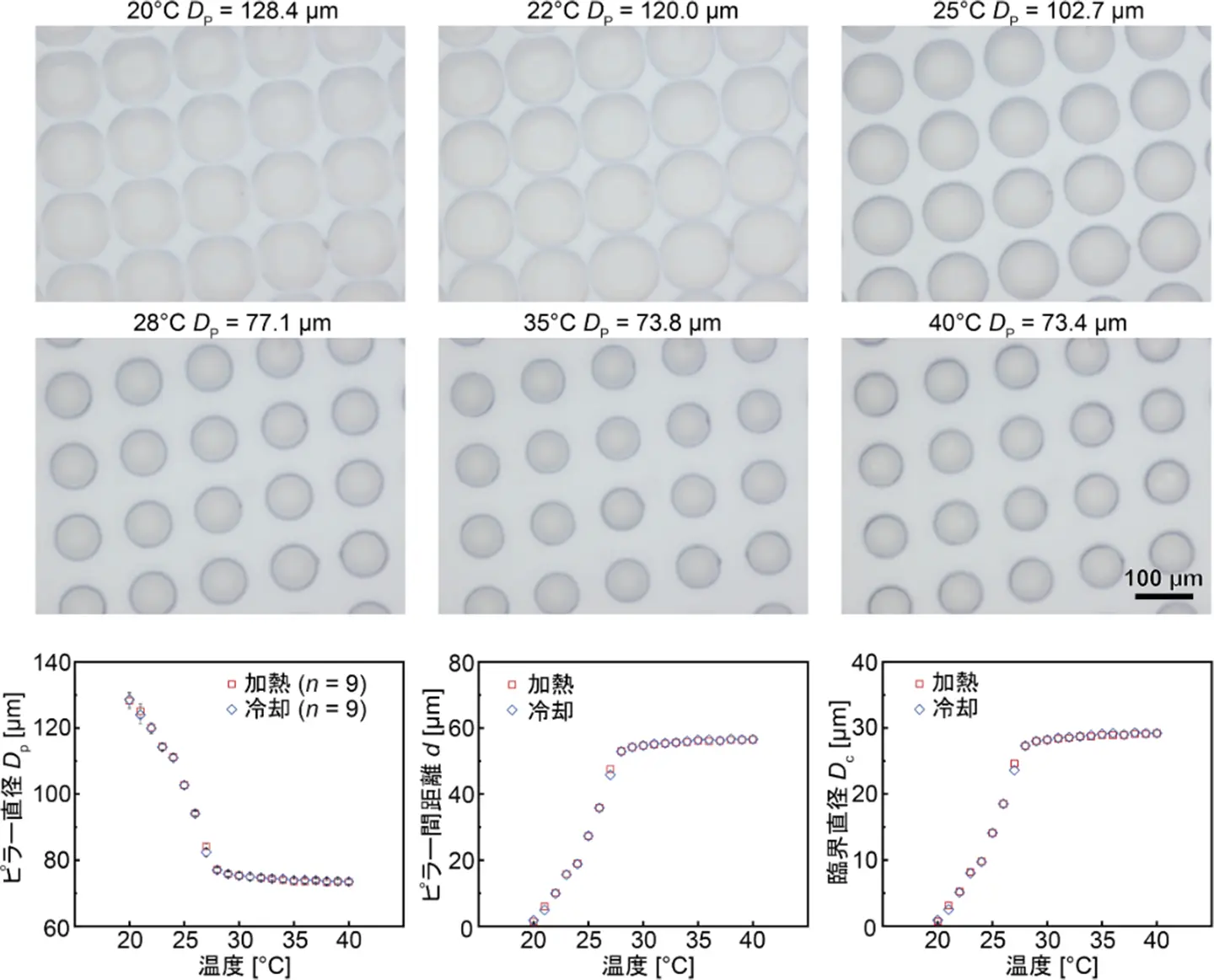
ヒト乳がん細胞MCF-7を含む血液試料を用いた実験において、3段階の分離モード(完全分離・選択的分離・分離なし)を実証し、細胞の生存率も高く保たれることを確認しました(図3)。さらに、デバイス基板にシリコンを採用し、ガラスよりも優れた熱応答性を得ることで、高速かつ均一な温度制御も達成しています。

社会的インパクト
がん細胞や希少細胞の高精度分離の実現は、早期診断、治療方針の決定、個別化医療の推進に不可欠です。本技術は、抗体やラベルを使わず、細胞サイズという物理的特性だけを用いて、柔軟に分離モードを変化させられる点で、従来の限界を超える有力な細胞分離手段となります。
また、温度制御という非侵襲的かつ簡便な操作により、同一デバイスで複数の分離条件を実現できることから、現場対応型の診断機器や次世代のラボ・オン・チップ技術としての応用が期待されます。再生医療やシングルセル解析など、バイオ・メディカル分野全体への波及効果も大きいと考えられます。
今後の展開
今後は、以下の展開を視野に入れています:
- より多様な細胞種や病態への対応:希少細胞や疾患特異的なサイズ分布を持つ細胞群への適用
- 多段階温度制御による連続分離の実現:チップ内で複数温度ゾーンを形成し、より複雑なサンプルの高次分離に挑戦
- 工業化・臨床応用に向けたスケールアップ:量産対応チップ設計や実装技術の開発
- AI画像解析との統合:リアルタイムでの細胞分類・判別との組み合わせによる高度診断ツールの開発
このように、本技術は「柔軟性」「非侵襲性」「高スループット性」を兼ね備えた革新的な細胞処理基盤として、今後のバイオ医療イノベーションを支える重要な要素技術となることが期待されます。
付記
本研究は、科学研究費助成事業(24K21696)の助成を受けて行われました。
用語説明
- [用語1]
- PNIPAM(ポリ(N-イソプロピルアクリルアミド)):温度によって水中での膨張・収縮を繰り返す温度応答性高分子。約32°Cを境に親水性から疎水性に転じる相転移特性を有し、細胞工学やドラッグデリバリーに応用される。
- [用語2]
- DLD(Deterministic Lateral Displacement):マイクロスケールの柱構造を用いて、粒子や細胞をサイズ依存的に分離するマイクロ流体技術。粒子サイズに応じてバンプモード(横方向移動)またはジグザグモード(直進)に分岐させる手法であり、連続分離や高純度精製に適している。
- [用語3]
- マイクロ流体デバイス:微細加工技術により製造される、内部に微小流路構造を有するチップ型デバイス。微量な液体操作を高精度に制御可能であり、ラボ・オン・チップとしてバイオ・医療・化学分野で幅広く利用されている。
- [用語4]
- ペルチェ素子:電流を流すことで一方の面を加熱し、他方の面を冷却する熱電変換素子。小型かつ応答性に優れた温度制御手段として、冷却器や温調機構として広く使用される。
- [用語5]
- 臨界径:DLD構造において、粒子がバンプモードに移行するかジグザグモードを維持するかを分ける閾値サイズ。この臨界径を基準として、対象粒子のサイズに応じた分離挙動が決定されるため、DLD設計における重要なパラメータである。
- [用語6]
- ラベルフリー細胞分離:細胞に蛍光標識や抗体などのタグ(ラベル)を付けずに、物理的特性(大きさ、形状、密度、電気的性質など)に基づいて分離を行う技術。前処理が少なく細胞への影響が小さいため、生細胞の回収や下流解析に適しており、診断・再生医療・創薬スクリーニングなど多くの応用が期待されている。
論文情報
- 掲載誌:
- Lab on a Chip
- タイトル:
- Tunable cell separation using a thermo-responsive deterministic lateral displacement device
- 著者:
- Ze Jiang, Yusuke Kanno and Takasi Nisisako
- DOI:
- 10.1039/d5lc00783f
研究者プロフィール
西迫 貴志 Takasi Nisisako
東京科学大学 総合研究院 未来産業技術研究所 准教授
研究分野:マイクロフルイディクス

菅野 佑介 Yusuke Kanno
東京科学大学 総合研究院 未来産業技術研究所 助教
研究分野:電気化学バイオセンサ

キョウ・タク Ze Jiang
東京科学大学 工学院機械系機械コース 大学院生
研究分野:マイクロフルイディクス
