ポイント
- 骨リモデリングを制御する新しい因子Fam102aを発見。
- Fam102aが骨芽細胞分化を促進する仕組みを解明:Runx2およびRbpjlの核内局在を調整。
- 骨粗鬆症などの骨代謝疾患における新たな治療法の基盤となる可能性を提示。
概要
東京科学大学(Science Tokyo)※ 歯学部の中島友紀教授、同大学 大学院医歯学総合研究科 分子情報伝達学分野の林幹人准教授、および東京慈恵会医科大学 整形外科学講座の斎藤充講座担当教授、山下祐助教らによる研究チームは、骨を壊す細胞である破骨細胞[用語1]と骨をつくる細胞である骨芽細胞[用語2]の網羅的な遺伝子発現解析を行い、骨リモデリングを制御する因子としてFam102aを同定しました。骨リモデリングとは、骨が常に新しく作り替えられる過程のことで、破骨細胞や骨芽細胞による相互作用で行われています。本研究では、この因子が骨芽細胞の分化を制御する仕組みを解明し、骨粗鬆症などの骨代謝疾患に対する新たな治療法の基盤となる可能性を提示しています。
破骨細胞と骨芽細胞は起源が異なるため、これまで両者の細胞分化に共通して関与する因子の報告はほとんどありませんでした。この課題に対し、研究チームは網羅的遺伝子発現解析[用語3]により同定したFam102aが破骨細胞と骨芽細胞の両方の細胞分化を制御することで骨代謝に重要な役割を持つことを見出しました。また、Fam102aは骨芽細胞の分化に不可欠な転写因子であるRunx2とRbpjlの核内局在を制御することで、骨芽細胞の分化を制御する仕組みを解明しました。
本研究で明らかになった骨リモデリング因子Fam102aを標的とした治療法は、従来の骨吸収または骨形成のいずれか一方を主なターゲットとした骨粗鬆症[用語4]治療とは異なり、骨代謝を包括的に調整する新たなアプローチとなる可能性があり、新規の治療法への応用が期待されます。
本研究成果は、2025年1月2日付(英国時間)の「Nature Communications」誌に掲載されました。
- 2024年10月1日に東京医科歯科大学と東京工業大学が統合し、東京科学大学(Science Tokyo)となりました。
背景
骨は常に新しくつくり替えられており、この過程は「骨リモデリング」と呼ばれます。骨リモデリングは、骨を破壊する破骨細胞や骨を形成する骨芽細胞などによる細胞間コミュニケーションによって相互に制御されています。この骨リモデリングの破綻は、骨粗鬆症に代表されるさまざまな骨疾患の原因となります。
これまで、破骨細胞や骨芽細胞への分化を制御する分子メカニズムについて多くの研究が報告されています。しかし、破骨細胞は造血幹細胞に由来し、骨芽細胞は間葉系幹細胞に由来するため、その起源が異なります。このため、両者の細胞分化に共通して関与する因子についての報告はほとんどありませんでした。その結果、破骨細胞と骨芽細胞の両方の細胞分化を共に制御する因子の存在を探る視点での研究は、これまで十分に行われていませんでした。
研究成果
研究グループは、骨の破壊と形成を司る各細胞におけるマスター転写因子を欠損させた細胞を用いた網羅的遺伝子発現解析の結果から、両細胞の分化を制御すると考えられる共通因子を新たな「骨リモデリング因子」として同定し、その生体内における役割や細胞内における分子メカニズムを報告しました。
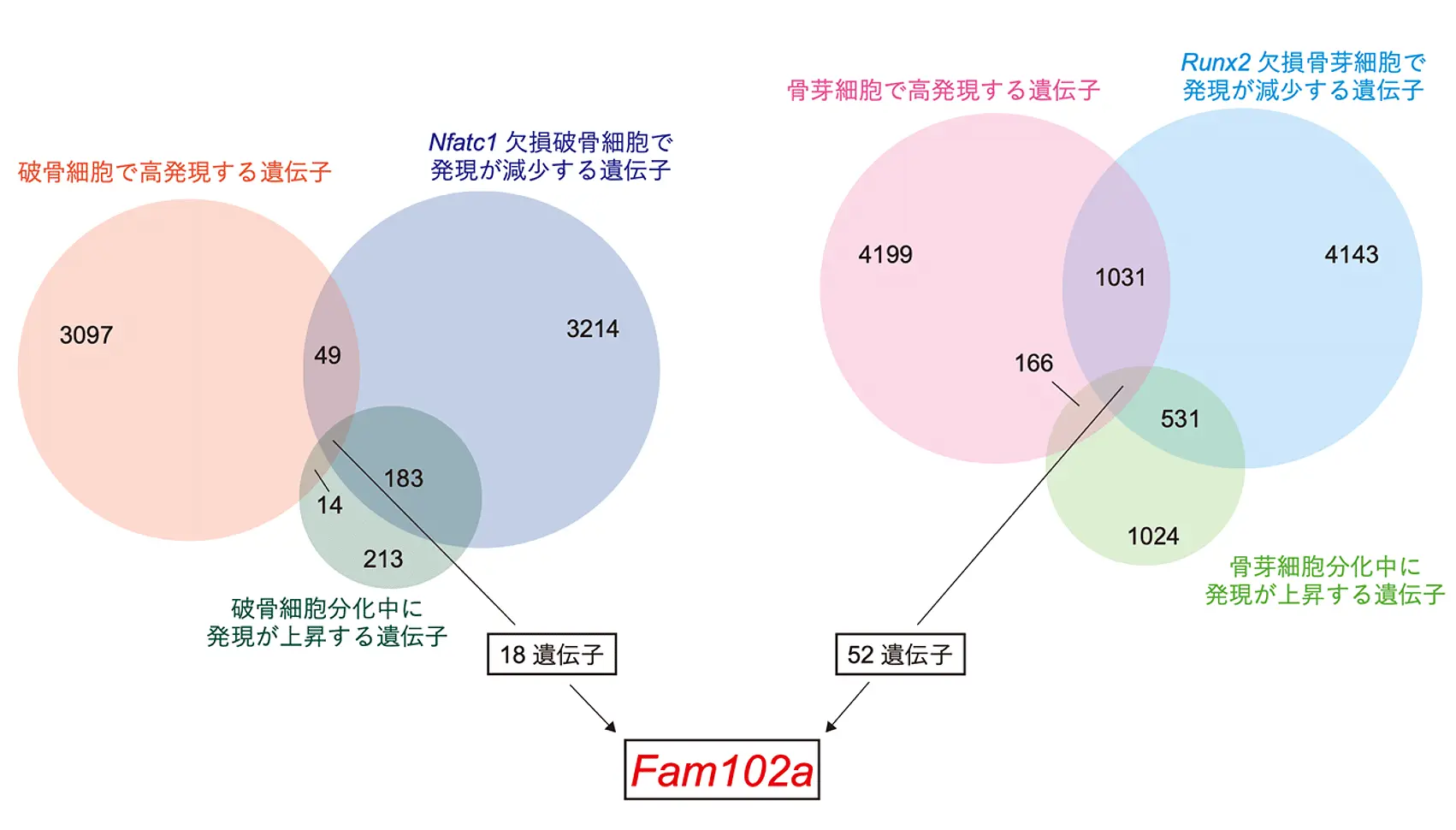
まず、破骨細胞分化のマスター転写因子であるNFATc1を欠損した破骨細胞と、骨芽細胞分化のマスター転写因子であるRunx2を欠損した骨芽細胞を用いて、網羅的遺伝子発現解析を実施しました。その結果、破骨細胞と骨芽細胞の両方の分化に関わる新規遺伝子としてFam102aを同定しました(図2)。
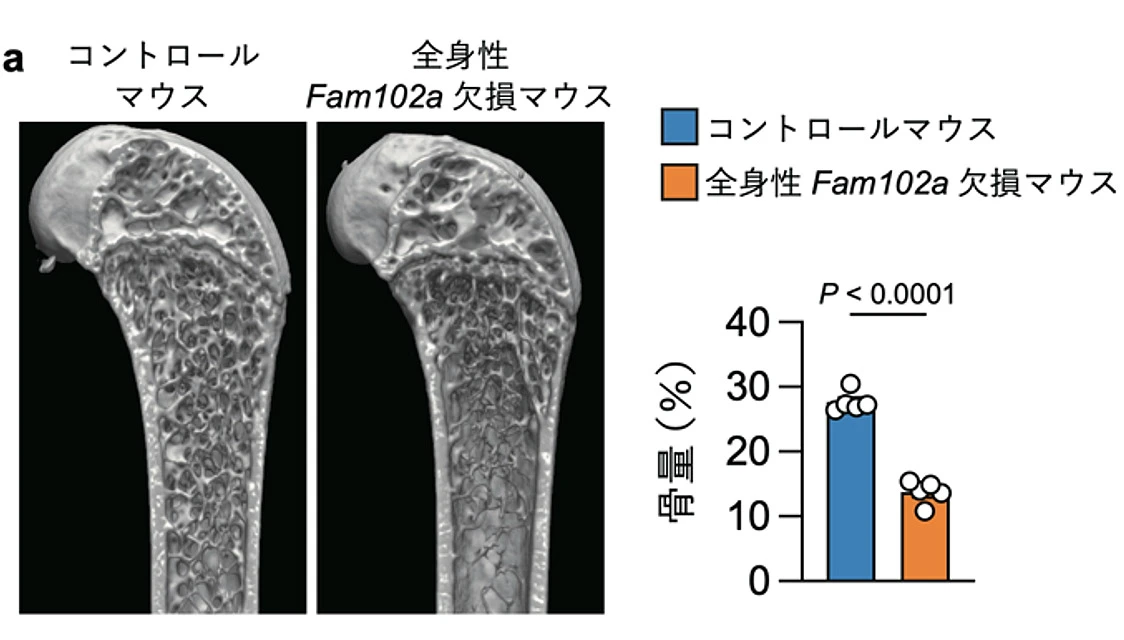
次に、Fam102a欠損マウスを新たに作製し、これらの骨を用いた解析を行い、Fam102aが破骨細胞と骨芽細胞の両方の細胞分化を正に制御していることが明らかになりました。Fam102aを全身で欠損したマウスでは、骨形成の著しい低下により骨量が顕著に減少していたことから(図3a)、Fam102aが生体内で特に骨芽細胞において重要な機能を果たしていることが示されました。
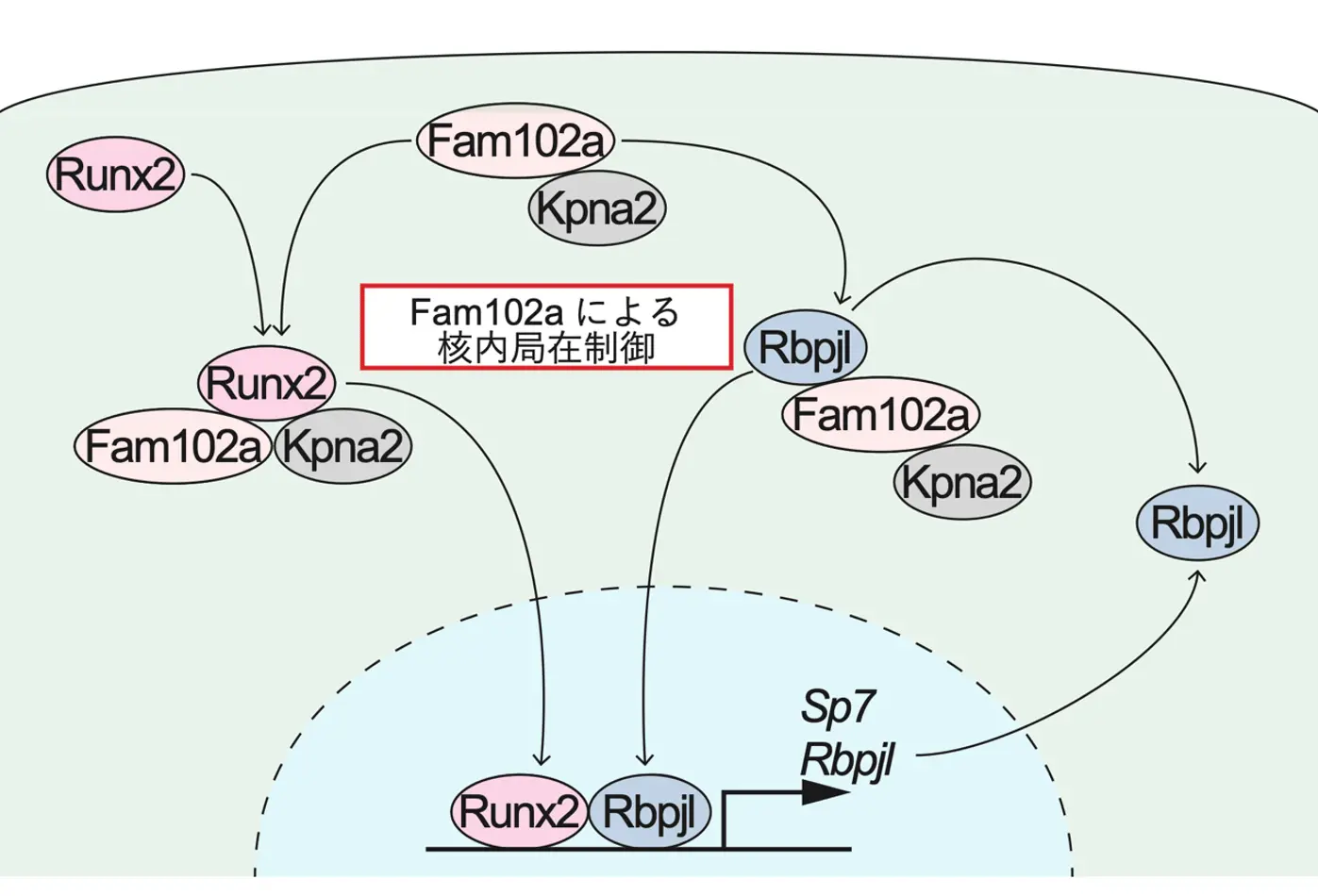
また、Fam102aが骨芽細胞の分化を制御するメカニズムを探索するため、Fam102a欠損骨芽細胞を用いて網羅的遺伝子発現解析を行った結果、骨芽細胞分化のもう一つのマスター転写因子であるOsterixを含む、Runx2によって制御される遺伝子の発現が減少していることが判明しました。その原因を調査したところ、Fam102aがRunx2の核内局在を制御することで骨芽細胞の分化を正に制御していることが示されました。
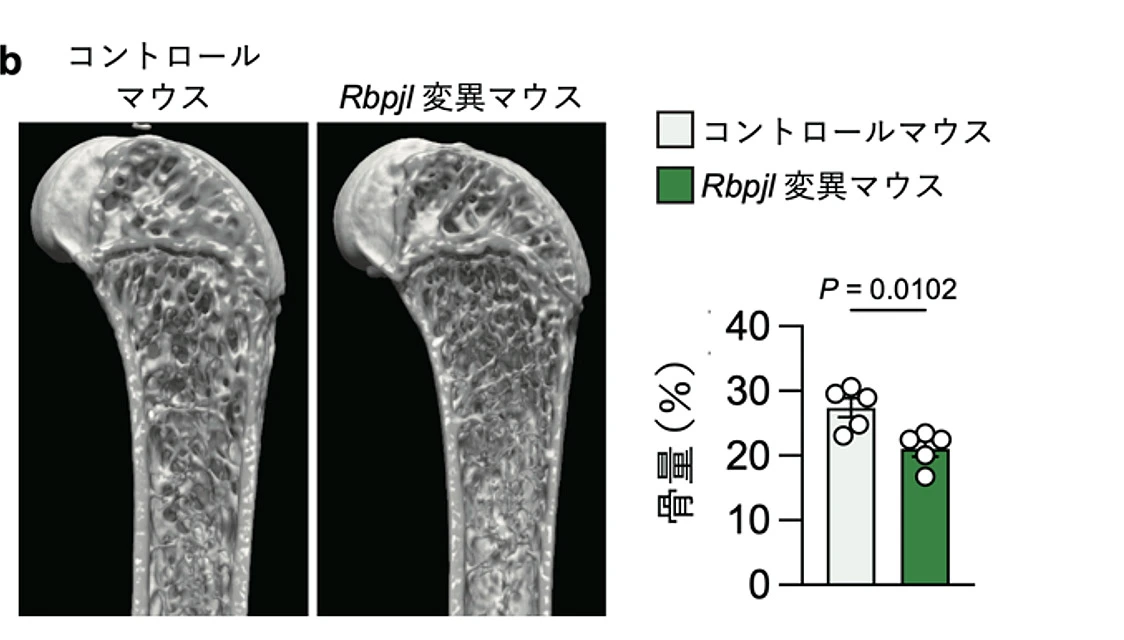
さらに、網羅的遺伝子発現解析により、Fam102aの下流で機能する転写因子としてRbpjlを同定しました。このRbpjlを変異させたマウスをCRISPR-Cas9技術を用いたi-GONAD法[用語5]で作製して解析したところ、Rbpjl変異マウス大腿骨において骨量が有意に減少し、Osterixの発現が低下していることが確認されました(図3b)。これらの結果から、Fam102aがRbpjlを介してOsterixの発現を促進することで骨芽細胞の分化を正に制御していることが明らかになりました。
社会的インパクト
骨リモデリングの制御機構には未解明の部分が多く残されていますが、本研究を通じてその一端が解明されることで、骨粗鬆症をはじめとする骨疾患に対する新たな治療戦略の提案が期待されます。
今後の展開
現在の骨粗鬆症治療では、骨吸収や骨形成のいずれか一方を直接的な標的とする治療薬が主に使用されています。しかし、これらの薬剤には使用期間の制限や骨代謝抑制に伴う副作用といったいくつかの課題が残されています。そのため、次世代の骨粗鬆症治療薬には、骨吸収抑制や骨形成促進を超えた、骨代謝全体を改善する新たな概念に基づく創薬が強く求められています。
本研究の成果は、Fam102aが骨芽細胞だけでなく破骨細胞の分化を制御することで骨代謝を統合的に調整する可能性を示した点にあります。このことから、Fam102aを基盤とした新たな骨粗鬆症治療法や予防戦略の創成に向けた分子基盤として、本研究が大きく貢献することが期待されます。
付記
この研究は、日本医療研究開発機構の革新的先端開発支援事業AMED-CREST「骨恒常性を司る骨細胞のメカノ・カスケードの解明」(研究開発代表者:中島友紀)およびPRIME「加齢に伴うオステオカインの変化がもたらす個体機能低下機構の解明」(研究開発代表者:林幹人)、科学研究費助成事業(20H00551、21K19554、21H03051、24K02563)、武田科学振興財団、アステラス病態代謝研究会、第一三共生命科学研究振興財団、セコム科学技術振興財団等の支援のもとで行われたものです。
用語説明
- [用語1]
- 破骨細胞:骨を溶かして壊す働きをする細胞。古くなった骨や、不要になった骨を分解する役割を持つ。
- [用語2]
- 骨芽細胞:新しい骨を作る働きをする細胞。骨を硬く丈夫にする役割を持つ。
- [用語3]
- 網羅的遺伝子発現解析:生物の細胞や組織において、すべての遺伝子がどの程度発現しているかを一度に測定し、解析する手法である。
- [用語4]
- 骨粗鬆症:骨が弱くなり、もろくなってしまう病気。世界で推定2億人が罹患している。
- [用語5]
- i-GONAD法:動物の体内で直接遺伝子改変を行う技術。この方法は、妊娠中の雌の動物の生殖腺にCRISPR-Cas9などの遺伝子編集ツールを直接注入することで受精卵において遺伝子改変が起こり、次の世代に引き継がれる。
論文情報
- 掲載誌:
- Nature Communications
- 論文タイトル:
- Fam102a translocates Runx2 and Rbpjl to facilitate Osterix expression and bone formation
- 著者:
- 山下祐、林幹人、劉安豪、佐々木文之、土谷洋輔、高柳広、斎藤充、中島友紀
研究者プロフィール
中島友紀 Tomoki NAKASHIMA
東京科学大学 歯学部 教授
研究分野:骨生物学、骨代謝学、分子生物学

林幹人 Mikihito HAYASHI
東京科学大学 大学院医歯学総合研究科 分子情報伝達学分野 准教授
研究分野:骨代謝学、分子生物学

斎藤充 Mitsuru SAITO
東京慈恵会医科大学 整形外科学講座 講座担当教授
研究分野:整形外科学、骨代謝学

山下祐 Yu YAMASHITA
東京慈恵会医科大学 整形外科学講座 助教
研究分野:整形外科学、リウマチ学、骨代謝学、分子生物学

関連ページ
お問い合わせ
取材申込み
学校法人慈恵大学 経営企画部 広報課
- Tel
- 03-5400-1280
- Fax
- 03-5400-1281
- koho@jikei.ac.jp
東京科学大学 総務企画部 広報課
- Tel
- 03-5734-2975
- Fax
- 03-5734-3661
- media@adm.isct.ac.jp