ポイント
- 多層化ゲルと気液界面を組み合わせた独自の培養技術(IMALI法)により、ヒトiPS細胞から肝臓に特有の血管「類洞(るいどう)」を、世界で初めて試験管内で立体的に再現。
-
iPS細胞から誘導した4種類の前駆細胞(肝内胚葉細胞、間葉系細胞、動脈内皮細胞、肝類洞内皮前駆細胞)の相互作用により、肝細胞の成熟と類洞を含む血管構造の形成が同時に進行。
- この方法で作製した肝臓オルガノイドは、第VIII因子(FVIII)などの凝固因子を高いレベルで分泌し、血友病Aモデルマウスへの移植実験で長期間にわたる出血症状の改善が確認。
- 類洞構造と代謝機能の両方を備えたこの肝臓オルガノイドは、疾患研究や創薬、再生医療など多用な応用が期待。
概要
東京科学大学(Science Tokyo)総合研究院 ヒト生物学ユニットの佐伯憲和特任講師、武部貴則教授(大阪大学 大学院医学系研究科/ヒューマン・メタバース疾患研究拠点(WPI-PRIMe)兼任)らを中心とした研究チームは、タケダ-CiRA共同研究プログラム(T-CiRA)[用語1]の一環として、ヒト人工多能性幹細胞(iPS細胞)[用語2]から、ヒト肝臓に特有の血管「類洞(るいどう)[用語3]」を含む肝臓オルガノイド(HLBO)[用語4]を試験管内で作製することに成功しました。
iPS細胞から分化させた肝内胚葉細胞[用語5]や肝類洞内皮前駆細胞(iLSEP)[用語6]など、4種類の前駆細胞を用い、新たに開発した気液界面培養「IMALI法」[用語7]に基づく独自の培養法によって、肝臓に特有の3次元血管構造を再構築することに成功しました。これにより、オルガノイド内の肝細胞における成熟や代謝機能が高まり、血液凝固因子を効率的に分泌することが明らかとなりました。さらに、この肝臓オルガノイドを血友病A[用語8]モデルマウスに移植したところ、出血症状の改善が確認されました。
本技術は、ヒト臓器に固有の血管構造をオルガノイドに導入するための基盤的な細胞操作技術であり、未解明の多い人体の生命現象や疾患の理解に貢献するツールとなることが期待されます。さらに、機能を強化した肝臓オルガノイドを再生医療の開発に応用することで、血液凝固異常症や末期肝不全などに対する革新的な治療概念につながる可能性を秘めています。
本成果は、6月25日付(英国時間)で「Nature Biomedical Engineering」誌に掲載されました。
背景
肝臓は、解毒、栄養代謝、胆汁の生成、血液凝固因子の産生など、生命維持に必要な多彩な機能を担う臓器です。その中でも、肝類洞と呼ばれる特異な血管は、壁が非常に薄く、微細な穴を多数持つ有窓構造により、血液と肝細胞との間で効率的な物質交換を可能にしています。さらに、類洞血管は免疫や血液凝固など、さまざまな機能に関与するとされており、なかでも第VIII因子(FVIII)などの凝固因子(止血に関わる因子)を産生する主要な細胞の場として知られています。
一方、類洞血管の機能異常によって発症する疾患として、血友病Aが挙げられます。血友病Aでは、遺伝的に第VIII因子が欠乏することにより血液の凝固が妨げられ、わずかな外傷でも重篤な出血を引き起こします。現在は、定期的に凝固因子製剤を注射する補充療法が標準的な治療法とされていますが、高コストや投与負担、免疫反応といった課題が存在します。こうした背景から、体内で凝固因子を持続的に産生できる再生医療技術の開発が強く求められていました。
近年では、iPS細胞などのヒト幹細胞を用いて、オルガノイドと呼ばれる臓器の微細構造を模した組織を創出する技術が注目を集めています。武部教授のグループでも、2013年に血管網を有する肝臓オルガノイドの作製に成功しましたが、形成されたのは動脈様の血管にとどまり、類洞のような臓器固有の血管網構造を作り出すことはできていませんでした。このような技術的限界により、凝固因子をはじめとする肝臓の機能が十分に再現できない点が、これまでの課題となっていました。
研究成果
研究チームはまず、ヒトiPS細胞から肝類洞内皮前駆細胞(iLSEP)を効率よく誘導するプロトコルを確立しました。この細胞は、胎児期の臓器に由来する血管内皮の特徴を再現しており、FVIIIの産生する能力を備えています。
このiLSEPに加えて、同様にiPS細胞から誘導した肝内胚葉細胞、間葉系細胞[用語9]、動脈内皮細胞[用語10]を組み合わせ、ゲル中に内封した上で、気液界面培養を利用して立体構造を構築する新たな三次元培養法(Inverted Multilayered Air-Liquid Interface:IMALI法)を開発しました(図1A)。この方法では、上下から酸素と栄養を供給できる培養環境を作り出すことで、各細胞が互いに影響を及ぼしながらゲルの境界を超えて自然に集まり、自己組織化が促進されます。
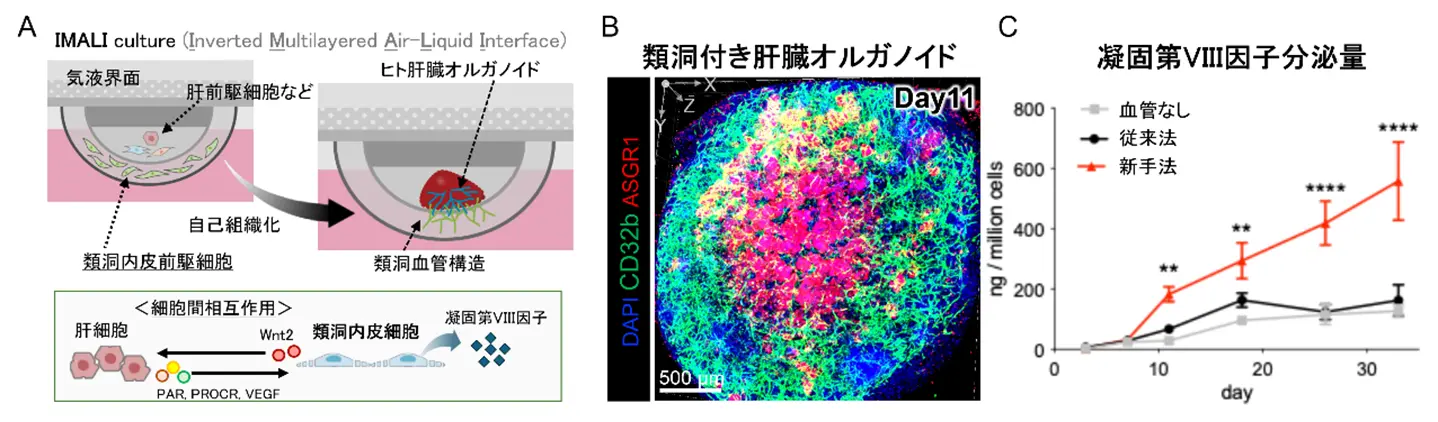
A.本研究で得られた肝臓オルガノイドの創出技術と、類洞内皮細胞が関与する機能の概略。 B. 肝臓オルガノイドを構成する、ASGR1陽性肝細胞(赤)、CD32B陽性類洞内皮細胞(緑)、および細胞核(青)を染色した3次元立体構造の蛍光画像。 C. 肝臓オルガノイドの培養液中に分泌された凝固第VIII因子(FVIII)の量。
その結果、直径約3 mmのドーム状肝臓オルガノイド(HLBO)が形成されました。このHLBOでは、CD32b陽性の類洞内皮細胞とASGR1陽性の肝細胞が共存し、枝分かれした血管網が構築されました(図1B)。単一細胞RNAシーケンス解析[用語11]により、HLBO内には動脈様、静脈様、類洞様の4種類の血管内皮細胞が含まれ、時間の経過とともに、CD32bおよびLYVE1陽性の類洞内皮細胞が優勢に分化することが確認されました。この過程においては、iLSEPが分泌するWNT2[用語12]が、肝細胞の成熟や血管形成を促進する中心的な役割を果たしていました(図1A)。
このようにして形成されたHLBOでは、肝臓に特有の代謝酵素や補体[用語13]の発現が高まり、血液凝固因子も多数分泌されました。特に、FVIIIの分泌能力は従来の血管付き肝臓オルガノイドと比べて大幅に向上し、30日を超える期間にわたって持続しました(図1C)。
さらに、この強化された“ミニ臓器”が有する凝固機能を活用し、凝固異常疾患に対する止血治療効果を、血友病Aモデルマウスを用いた移植実験によって検証しました(図2A)。HLBOを移植したマウスでは、最大で5ヵ月間にわたりヒト由来FVIIIの分泌が持続し、長期的な出血症状の改善が確認されました(図2B)。

A. 肝臓オルガノイド移植による血友病Aの治療効果を検証した実験の概要図。B. 出血試験の実施状況と、出血量の比較結果。
社会的インパクト
本研究は、世界で初めて臓器特異的な血管網を有する肝臓オルガノイドの創出技術を確立するとともに、血液凝固異常疾患、特に血友病Aに対する新たな治療法を提示するものです。患者自身の細胞から作製したiPS細胞をもとに、機能性肝臓オルガノイドを構築・移植することで、外部からの凝固因子補充に依存しない、より持続的で患者の負担が少ない治療法が実現することが期待されます。
また、肝臓オルガノイドから得られる凝固因子は、投与型製剤としての活用も可能であり、製薬技術への応用も視野に入ります。さらに、HLBOは薬剤応答評価モデルや肝疾患の病態解明にも有用であり、創薬や個別化医療の研究基盤としても高い価値を有します。
これまで再現が困難だった、臓器に特異的な血管構造と機能を併せ持つオルガノイドの創出技術の確立は、今後、さまざまな器官の再生に向けた重要なマイルストーンとなると考えられます。
今後の展開
今後は、類洞を備えた肝臓オルガノイドを用いて、薬物の毒性評価や動態解析、疾患研究への応用を進めるとともに、さらなる長期安定性および安全性の評価を行い、ヒトへの応用を目指した実用化研究を展開していきます。
本技術は、臓器特異的な血管構造を再構築する基盤技術として、肝疾患にとどまらず、他の臓器への応用も視野に入れた研究展開が期待されます。また、製造工程の標準化およびスケールアップを通じて、AIやロボット技術も活用しながら、再生医療、疾患モデル、創薬研究などへの幅広い応用を加速させる予定です。
付記
本研究は、国立研究開発法人日本医療研究開発機構(AMED)再生・細胞医療・遺伝子治療実現加速化プログラム「機能強化型肝臓オルガノイドを用いたUTOpiAシステムの開発」、橋渡し研究プログラム「橋渡し研究推進による未来医療創出」、革新的先端研究開発支援事業(AMED-CREST)「ヒト肝オルガノイドモデルを用いた内分泌系の破綻と炎症・線維化機構の解明」、肝炎等克服実用化研究事業「ゲノム付きNAFLDオルガノイドパネルを用いた革新創薬概念の実証」、「内胚葉オルガノイドの線維化誘導とメカノスクリーン体系の創生」、「ヒトiPS細胞誘導性肝オルガノイドを用いた革新的疾患モデルの開発および肝線維化と発がんを抑止する治療法の創成」、「NASH肝がんの治療開発を目指す炎症加齢を加味したリピド・ゲノミクス研究2.0」、「革新的オルガノイド技術を用いた肝線維化・発がん機構の解明と肝星細胞活性化制御をめざした治療法の創成」、再生医療実現拠点ネットワークプログラム「ヒト肝臓オルガノイドによる血液凝固異常症の革新治療概念の実証」、ならびに科学技術振興機構(JST)ムーンショットプログラム(JPMJMS2033-12、JPMJMS2022-10)、日本学術振興会(JSPS)科学研究費助成事業(JP18H02800)、武田薬品工業株式会社(タケダ-CiRA共同研究プログラム(T-CiRA))などの支援を受けて実施されました。
用語説明
- [用語1]
- タケダ-CiRA共同研究プログラム(T-CiRA:Takeda-CiRA Joint Program for iPS Cell Applications):武田薬品工業株式会社と京都大学iPS細胞研究所(CiRA)、東京科学大学のアカデミア研究者が連携して進める、再生医療研究の共同プロジェクト。
- [用語2]
- 人工多能性幹細胞(iPS細胞):皮膚などの体細胞から作られ、さまざまな臓器や組織へと分化できる能力を持つ細胞。
- [用語3]
- 類洞(るいどう):肝臓に特有な、細かな穴を持つ特殊な血管構造。血液と肝細胞との間で栄養や酸素の効率的な交換を行うほか、血液凝固因子を分泌する細胞としても知られる。
- [用語4]
- 肝臓オルガノイド(HLBO:Human Liver Bud Organoid):ヒトiPS細胞由来の複数の細胞が自己組織化して形成される小型の三次元肝組織。肝臓の微細構造や機能を再現し、「ミニ肝臓」などと呼ばれることもある。
- [用語5]
- 肝内胚葉細胞:肝臓の前駆組織である内胚葉に由来し、肝細胞や胆管細胞へと分化できる能力を持つ。肝臓オルガノイドの構築において主要な構成要素の一つ。
- [用語6]
- 肝類洞内皮前駆細胞(iLSEP:Liver Sinusoidal Endothelial Progenitor):肝臓の類洞血管を形成するもとになる細胞で、ヒトiPS細胞から誘導される。
- [用語7]
- 気液界面培養「IMALI法」:空気と培養液の界面で細胞を培養することで、ガス交換と栄養供給を促進し、細胞が本来の機能を発揮しやすくする培養法。
- [用語8]
- 血友病A:遺伝的に凝固第VIII因子(FVIII)が欠乏することで血液凝固が障害され、出血しやすくなる疾患。凝固異常疾患の中で最も頻度が高い。
- [用語9]
- 間葉系細胞:支持組織などへ分化できる細胞で、臓器内における構造的支えやシグナル伝達に関与する。
- [用語10]
- 動脈内皮細胞:血流や血圧の変化に応じて応答する、動脈血管の内側を覆う細胞。iPS細胞からの血管内皮細胞分化では、高濃度の血管内皮成長因子(VEGF-A)を用いることが一般的であり、動脈様の内皮細胞が誘導されやすい。
- [用語11]
- 単一細胞RNAシーケンス解析:1細胞ごとに遺伝子発現を測定する技術。細胞の多様性や分化の状態を詳細に調べることができる。
- [用語12]
- WNT2:発生や組織再生に関わるタンパク質の一種で、血管形成や細胞の分化誘導に関与する。
- [用語13]
- 補体:病原体の除去や免疫応答に関与するタンパク質群であり、その多くが肝臓で産生される。
論文情報
- 掲載誌:
- Nature Biomedical Engineering
- タイトル:
- Self-organization of sinusoidal vessels in pluripotent stem cell-derived human liver bud organoids
- 著者:
- Norikazu Saiki*, Yasunori Nio, Yosuke Yoneyama, Shuntaro Kawamura, Kentaro Iwasawa, Eri Kawakami, Kohei Araki, Junko Fukumura, Tsuyoshi Sakairi, Tamaki Kono, Rio Ohmura, Masaru Koido, Masaaki Funata, Wendy L. Thompson, Pamela Cruz-Encarnacion, Ya-Wen Chen and Takanori Takebe†(*筆頭著者、†責任著者)
研究者プロフィール
佐伯 憲和 Norikazu SAIKI
東京科学大学 総合研究院 ヒト生物学研究ユニット 特任講師
研究分野:幹細胞生物学、血液血管生物学、バイオインフォマティクス
武部 貴則 Takanori TAKEBE
東京科学大学 総合研究院 ヒト生物学研究ユニット 教授
研究分野:幹細胞生物学、再生医学
関連リンク
お問い合わせ
取材申込み
東京科学大学 総務企画部 広報課
- media@adm.isct.ac.jp
- Tel
- 03-5734-2975
- FAX
- 03-5734-3661