概要
東京科学大学 物質理工学院 応用化学系 田中克典教授(兼 理化学研究所(理研)開拓研究所 田中生体機能合成化学研究室 主任研究員)、アンバラ・プラディプタ助教、寺島一輝博士後期課程学生らの研究チームは、細胞透過性の悪い、双性イオン[用語1]を持つ天然物(以下、双性イオン天然物)誘導体をがん細胞の中で選択的に「現地合成」し、抗がん活性を発揮させることに成功しました。
本結果は、双性イオン天然物や抗がん剤の細胞透過性と副作用の懸案を一挙に解決する「生体内合成化学治療」として、医療分野への応用が期待されます。
双性イオン天然物の中には、抗がん活性を示すものが知られています。しかし、双性イオン化合物は細胞膜を通りにくく、またがん細胞への選択性もないことから抗がん剤としての利用はほとんど行われていませんでした。今回、研究チームは、がん細胞で過剰に産生される代謝物「アクロレイン[用語2]」を細胞内での反応剤として利用することにより、脱保護反応(保護基[用語3]を除去する反応)、分子内アザ電子環状反応[用語4]、酸化・加水分解反応を含む連続7段階の有機合成化学反応をがん細胞内で一挙に実現しました。双性イオン天然物の活性構造をがんにおいて効率的に「現地合成」するとともに、がん選択的に抗がん活性を発揮させることに成功しました。
本研究成果は、科学雑誌『Angewandte Chemie International Edition』のホットペーパー(注目論文)に選出され、12月26日付でオンライン掲載されました。本誌では、急速な展開によって注目を集めている分野における研究で、編集委員が特に重要性を認めた論文をホットペーパーとして選定しています。
背景
双性イオン天然物の中には、そのプラスとマイナスの両方の電荷によって核酸やタンパク質と強く相互作用することにより、ユニークな生物活性を示す化合物があることが知られています(図1)。特に、ペガヌミンHやキノシジンのように、高い抗がん活性を示すものも存在し、効果的ながん治療薬を発見するための基盤として期待されています。しかし、双性イオン化合物は親水性が高く、疎水性の細胞膜を通過しにくいことから、細胞内で活性を発現させることは困難です。さらにがん細胞への選択性も低いため、抗がん剤としての利用はほとんど行われていませんでした。
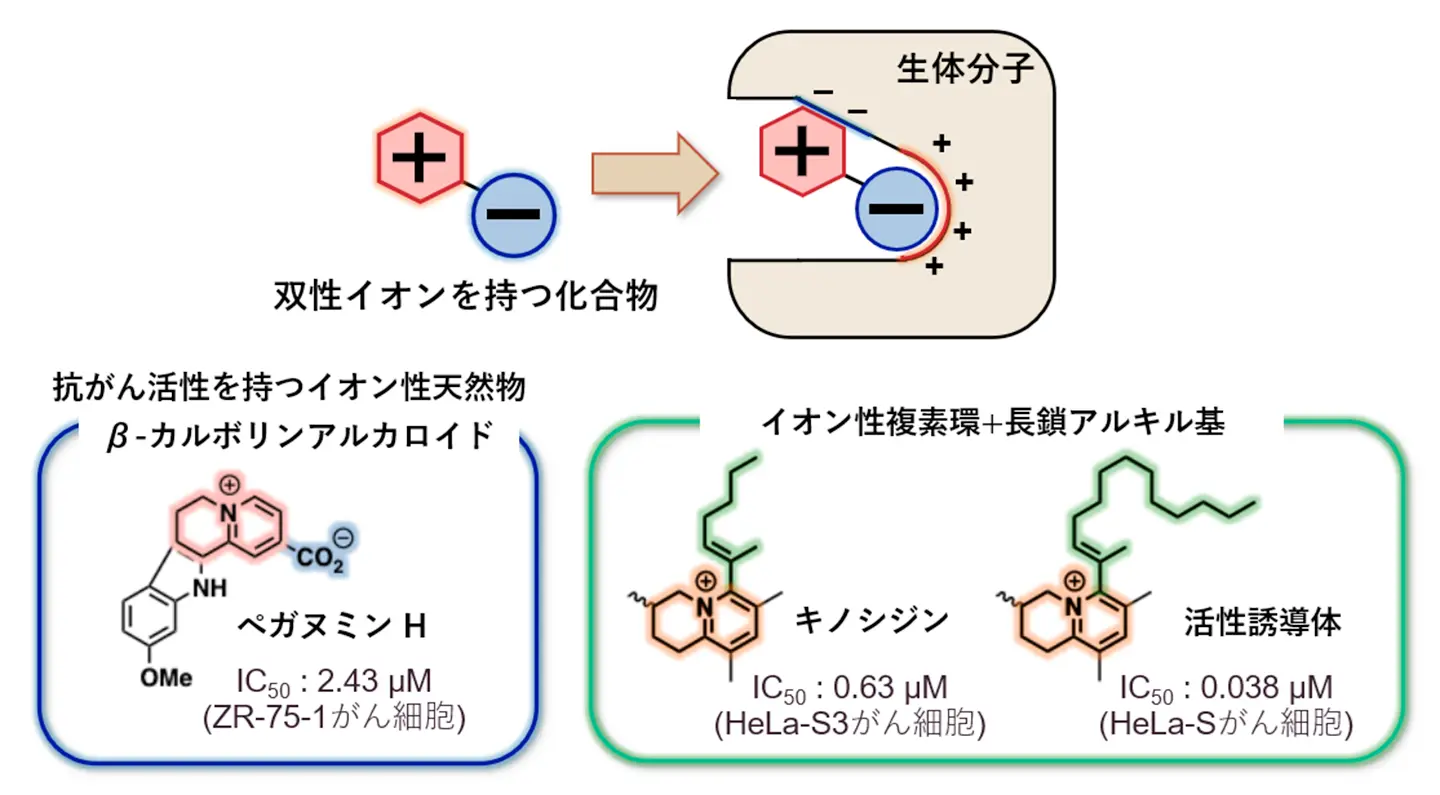
双性イオン天然物は、正負の両電荷を持つため、核酸やタンパク質などの生体分子と強く相互作用する(上)。例えば、ペガヌミンH(下左)やキノシジン(下中)のように、高い抗がん活性を示すものも存在する。
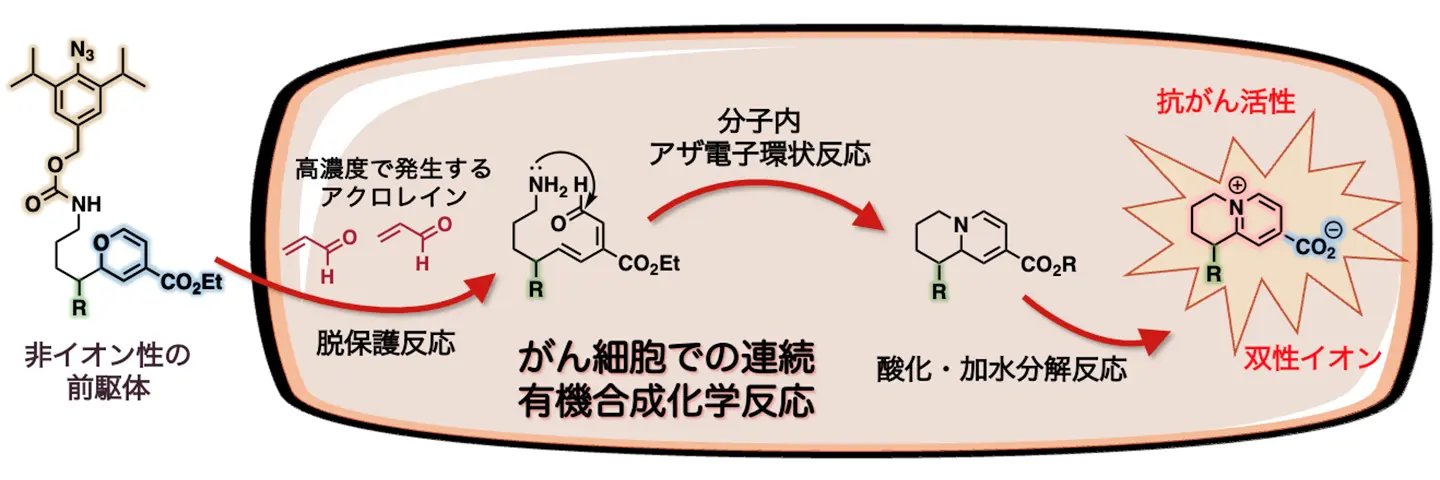
一方で、これまでに田中主任研究員らは、がん細胞内で金属触媒やがん代謝物を有効に利用することで、がんの現地で抗がん活性分子を合成し、治療する「生体内合成化学治療」を開拓してきました注1~3。この戦略により、マウスを用いた研究で副作用のない治療を実現してきました。そこで今回研究チームは、「生体内合成化学治療」を、双性イオン天然物にも展開することを計画しました。非イオン性で細胞膜を透過できる前駆体をがん細胞に作用させ、抗がん活性を持つ双性イオン天然物誘導体をがん細胞内で「現地合成」することにより、細胞への取り込みと副作用の両方の問題を一挙に解決できると考えました(p.1概要図)。
注1)2019年7月2日プレスリリース「触媒的『現地合成』によるがん治療」
注2)2022年1月10日プレスリリース「体内でベンゼン環を作る」
注3)2023年9月27日プレスリリース「極微量の触媒で抗がん剤を体内で大量生産」
研究手法と成果
これまでに田中主任研究員らは、がん細胞内では正常細胞と比べ、アクロレインが非常に高い濃度で発生していることを見いだしていました注4~6)。そこで、研究チームは双性イオンを持つ薬剤をがん細胞内で「現地合成」するために、アジド基(-N3)を持つ非イオン性の前駆体1を設計・開発しました(図2)。
この前駆体1をA549肺がん細胞に作用させたところ、前駆体1のアジド基ががん細胞で発生するアクロレインと反応し、(1)1,3-双極付加環化反応[用語5a]と(2)開環反応[用語5b]によるジアゾ化合物を経て、(3)脱保護反応が進行し、アミン2が効率的に生成されました。さらに、このアミンが分子内に存在するアルデヒド基と(4)イミン[用語5c]形成反応を起こした後、(5)分子内でアザ電子環状反応が速やかに進行し、ジヒドロピリジン3が得られました。ジヒドロピリジン3はさらに時間とともに(6)酸化され、続く(7)加水分解反応が進行し、最終的に双性イオン天然物誘導体4(双性イオン4)が総収率18%で得られました。この結果は、各段階が78%もの高い収率で進んだことを示します。このように、アクロレインをがん細胞内での反応剤として利用することにより、7段階の有機合成化学反応を連続で行い、非イオン性の前駆体1から双性イオン4へとがん細胞内で効率的に変換することに成功しました。
注4)2018年11月28日プレスリリース「有機合成反応で乳がん手術を改革」
注5)2021年3月31日プレスリリース「体内での環化付加反応によるがん化学療法」
注6)2024年11月8日プレスリリース「副作用を劇的に抑えた抗がん剤ドキソルビシンの開発」
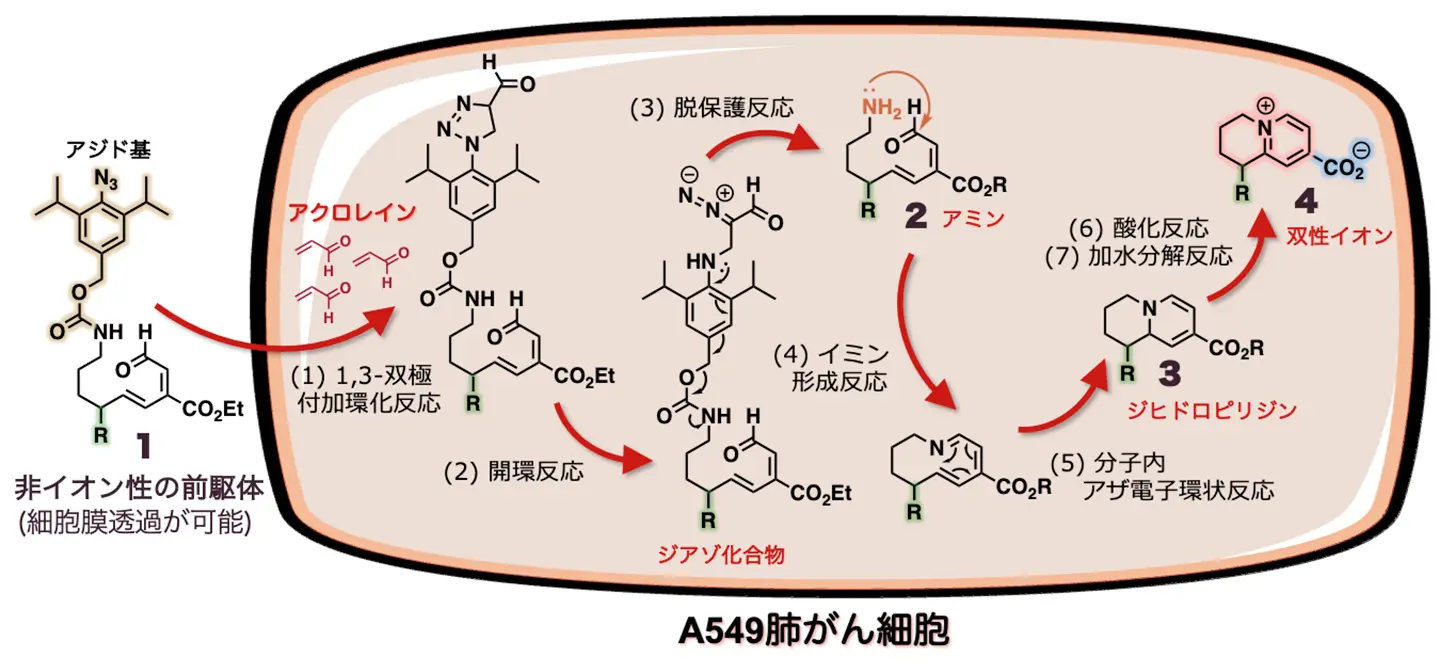
設計・開発したアジド基(-N3)を持つ非イオン性前駆体1をA549肺がん細胞に作用させると、前駆体1がアクロレインと反応し、七つの反応が続き、生成物ができた。(1)1,3-双極付加環化反応(2)開環反応→ジアゾ化合物→(3)脱保護反応→アミン2→(4)イミン形成反応(5)分子内アザ電子環状反応→ジヒドロピリジン3→(6)酸化反応(7)加水分解反応→双性イオン4。
がん細胞内で直接「現地合成」した双性イオン4は、弱いながらも抗がん活性(50%効果濃度(IC50)=41.1マイクロモーラー(µM、1µMは100万分の1モーラー、1Mは1リットル当たりのモル数)を示すことが分かりました(図3)。図1のキノシジン天然物の構造を基に、さらに抗がん活性を強めることを意図して、長鎖アルキル基を含む誘導体を合成したところ、強い抗がん活性を示すことが判明しました(IC50=6.2µM)。
一方で、がん細胞内で合成した双性イオン誘導体4は抗がん活性を示したのに対して、あらかじめ合成した双性イオン誘導体4を直接、A549がん細胞に作用させた場合には、細胞に取り込まれないために活性をほとんど示しませんでした。また、非イオン性前駆体1を、アクロレインが発生していない正常細胞に作用させた場合には、双性イオン誘導体4が生成しないため、毒性を示しませんでした。これらの結果から、研究チームの「生体内合成化学治療」によって、がん細胞内で直接、抗がん活性を持つ双性イオン天然物誘導体を合成することにより、細胞内移行とがん細胞選択性の両者の課題を克服することに成功しました。
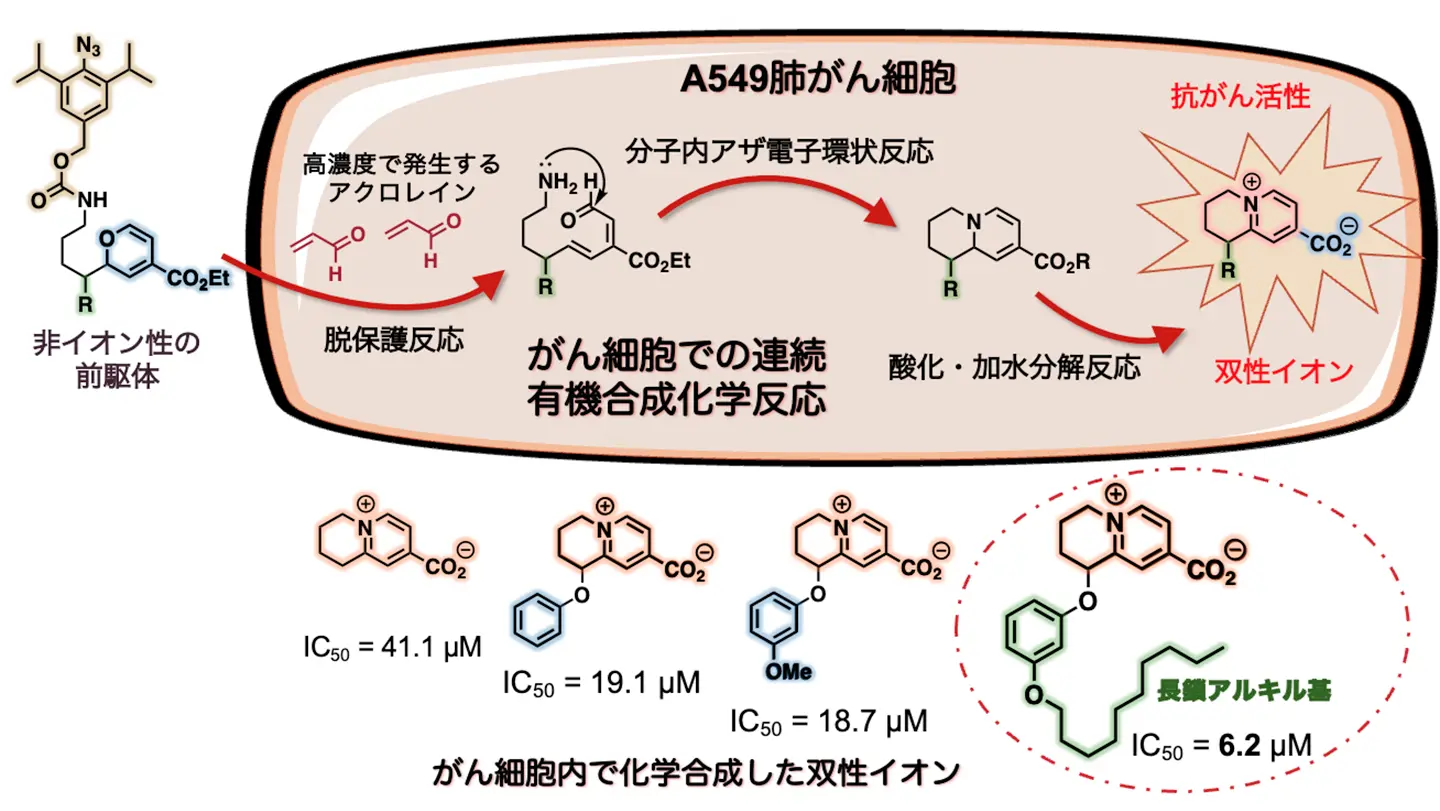
A549肺がん細胞内で「現地合成」した双性イオン4(上右端)は、弱いながらも抗がん活性を示した(IC50=41.1µM)。双性イオン天然物のキノシジンを基に、長鎖アルキル基を有する誘導体を合成すると、抗がん活性はかなり高まった(IC50=6.2µM)。IC50は細胞などの生育を50%阻害する薬物の濃度のことで、この値が小さいほど強い効果を持つことを示す。
今後の期待
今回の研究では、適切に設計された非イオン性の前駆体をがん細胞へと投与することで、がんの「現地」で発生するアクロレインが一連の連続反応の駆動力となり、双性イオン天然物誘導体へと効率的に変換することができました。そして、がんで抗がん活性を直接発現させることで、双性イオン化合物の欠点であった細胞への取り込みと細胞の選択性を克服することに成功しました。このように、田中主任研究員らが掲げるがんの「生体内合成化学治療」は、新たな活性化合物を発見する可能性に加え、これまでにさまざまな欠点から実用化することができなかった化合物に再び活躍の可能性を与えることができます。「生体内合成化学治療」は、これからの化学療法に変革をもたらすことが期待されます。
用語説明
- [用語1]
- 双性イオン:同一分子内に正の電荷(陽イオン)と負の電荷(陰イオン)を持つ分子のこと。アミノ酸などが代表例。
- [用語2]
- アクロレイン:生体内で生成される反応性の高いアルデヒド化合物。2019年に田中生体機能合成化学研究室が、がん細胞内では普遍的に、外部から導入した試薬と有意に化学反応を起こすことができる高濃度でアクロレインが生成されることを発見した。
- [用語3]
- 保護基:有機化合物の反応性の高い官能基に導入することで、不活性化できる官能基。化学反応を行う際に、特定の官能基における望まない反応を防ぐために導入され、特定の反応条件で除去することが可能である。また、薬剤の官能基に保護基を導入し、標的となるタンパク質との相互作用を制御する研究も行われており、生体内反応によって保護基を除去できれば、プロドラッグ(生体内の薬剤標的部位での化学反応によって、薬効を示す分子に変換されるようにデザインされた薬剤)として利用できる。
- [用語4]
- アザ電子環状反応:不飽和アルデヒドと1級アミンが反応すると、1-アザトリエンが生成する。1-アザトリエンは、末端炭素原子と窒素原子が結合してピリジン誘導体を与える。この反応を6π-アザ電子環状反応(または単にアザ電子環状反応)という。この反応は古くからよく知られていたものの、長い反応時間と高い反応温度が必要とされ、さらに収率もよくなかったことから積極的に有機合成に利用されることはなかった。しかし1998年に、田中主任研究員らがアザ電子環状反応を強力に促進させる置換基効果を発見して以来、有機合成に限らず生体分子や細胞の標識、あるいは複合化のための反応として利用されている。現在、理研クリック反応として、研究チームが中心となり診断や放射線治療に向けた研究を展開している。
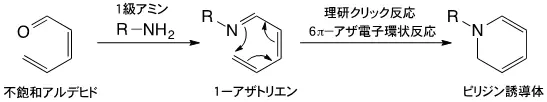
- [用語5a]
- 1,3-双極付加環化反応:3原子から成る4π電子化学種を1,3-双極子と呼び、これがアルケンやアルキンなどと環を形成する付加環化反応を起こし、5員環化合物を与える。この反応を1,3-双極付加環化反応という。また、この5員環化合物は環状を開く開環反応を起こし、ジアゾ化合物へと変換される。一方、イミンは炭素と窒素の二重結合を一つ持つ化合物で、シッフ塩基とも呼ばれる。
- [用語5b]
- 開環反応:用語5aを参照
- [用語5c]
- イミン:用語5aを参照
論文情報
- 掲載誌:
- Angewandte Chemie International Edition
- タイトル:
- In Cellulo Multistep Synthesis of Antitumor Zwitterionic Heterocycles Triggered by Cancer-Specific Acrolein
- 著者:
- Kazuki Terashima, Ambara R. Pradipta, Akihiro Ishiwata, and Katsunori Tanaka

関連リンク
東京科学大学 総務企画部 広報課
- Tel
- 03-5734-2975
- Fax
- 03-5734-3661
- media@adm.isct.ac.jp