概要
東京科学大学(Science Tokyo)※ 物質理工学院 応用化学系の田中克典教授(理化学研究所(理研)開拓研究本部 田中生体機能合成化学研究室 主任研究員)、アンバラ・プラディプタ助教(同客員研究員)、髙橋ゆりあ修士課程2年(同研修生)、寺島一輝博士後期課程2年(同研修生)らの共同研究グループは、副作用を劇的に抑えた、新しいドキソルビシン薬剤の開発に成功しました。
本研究成果は、従来の課題であった副作用に悩まない新たなドキソルビシン薬剤の開発に貢献すると期待されます。
がんの治療は日々進歩を遂げていますが、がん化学療法での副作用はいまだに深刻な問題です。特に、現在もよく用いられている「ドキソルビシン」という抗がん剤は、肺がん、消化器がん、乳がん、悪性リンパ腫などさまざまながん種に効果を示す一方で、正常細胞にも影響を与え、吐き気、嘔吐(おうと)による大幅な体重減少・骨髄抑制・脱毛などの副作用に多くの患者が悩まされています。
今回、共同研究グループは、がん細胞内で有機化学反応を行い、がんのある場所(現地)でドキソルビシンを発生させることで、副作用を大幅に抑えた新たなドキソルビシン薬剤を開発しました。この薬剤は、実際の患者に非常に近いモデルマウス(患者腫瘍移植モデル(PDX model)[用語1])においても副作用を抑えつつ有意に腫瘍の増加を抑制しました。さらに、がん細胞内でドキソルビシンが発生する機構を明らかにするとともに、薬を投与してから排せつされるまでの薬物動態を確認し、非臨床や臨床研究[用語2]につながる結果が得られました。
本研究は、科学雑誌「Tetrahedron Chem」オンライン版に掲載されました。
- 2024年10月1日に東京医科歯科大学と東京工業大学が統合し、東京科学大学(Science Tokyo)となりました。
背景
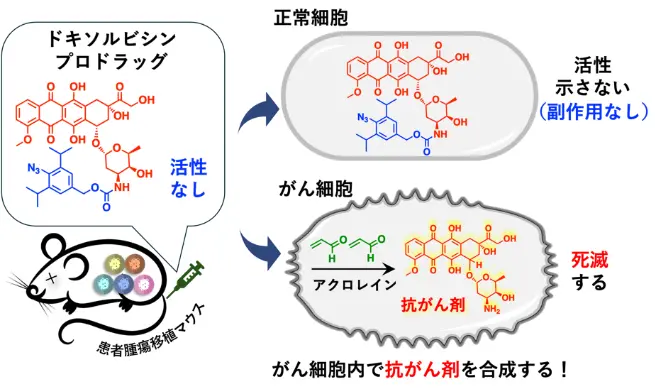
田中主任研究員らは、さまざまながん細胞でアクロレイン[用語3]分子(図1緑の化合物)が大量に産生されていることを見いだしました※1、2)。さらに、がん細胞内でアジド基(-N3)を持つフェニルアジドとアクロレインが選択的に環化付加反応を起こすことを利用した「プロドラッグ[用語4]」の設計に成功しました※3)。
がん化学療法において副作用はいまだに深刻な問題です。特に、抗がん剤の「ドキソルビシン」は、実際に臨床の現場で多用されており、さまざまながん種に効果を発揮しますが、正常細胞にも影響を与えるため、多くの患者が大幅な体重減少・骨髄抑制(骨髄の働き低下)・脱毛などの副作用に悩まされています。さらに、心毒性(心臓機能障害)などの副作用も報告されており、生涯に投与できる累積量の上限が定められています。
そこで、共同研究グループは、がん細胞内で有機化学反応を行い、がん細胞内のみでドキソルビシンを発生させることにより、副作用を抑えた新たなドキソルビシン薬剤の開発に挑戦しました。
正常細胞ではドキソルビシンプロドラッグは影響を及ぼさないが、がん細胞に到達するとがん細胞中のアクロレインと反応することにより、ドキソルビシンが放出される。これにより副作用の少ないがん治療が可能になると考えられる。
研究成果
共同研究グループははじめに、非臨床や臨床試験用のCMC[用語5]検討とGMP[用語6]製造に向け、ドキソルビシンプロドラッグを簡便かつ大量合成できる手法の開発に取り組みました(図2)。従来のルート(図2緑線)では、中間体1を合成するのに遷移金属(Pd(PPh3)4)や一酸化炭素(CO)を用いるため操作が複雑でした。また、中間体1までに3ステップを要します。本研究では、これらを用いず、ステップ数を減らした新規ルート(図2オレンジ線)を新たに開拓しました(2ステップ)。これにより、容易かつ大量にドキソルビシンプロドラッグを合成することが可能になりました。
さらに、合成したドキソルビシンプロドラッグの細胞毒性を評価したところ、正常細胞と比較してがん細胞で有意に高い活性を示すことが確認されました。
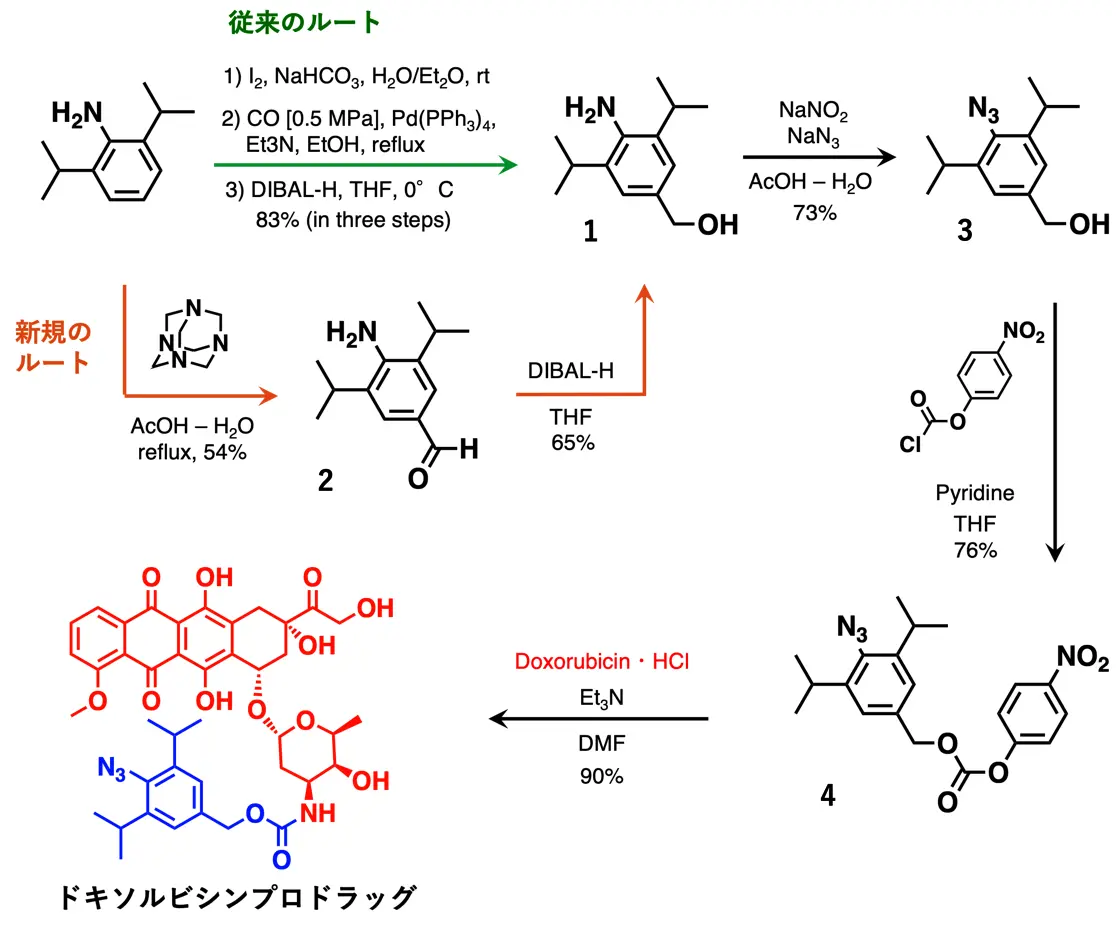
従来のルート(緑線)では、中間体1の合成までに遷移金属(Pd(PPh3)4)や一酸化炭素(CO)を用いており、操作が複雑であった。また、中間体1までに3ステップを要する。本研究では、これらを用いず、ステップ数を減らし、2ステップとした新たなルート(オレンジ線)を開拓した。これにより、容易かつ大量にドキソルビシンプロドラッグを合成することが可能になった。
続いて、ドキソルビシンプロドラッグの治療効果について検証しました。肺がん細胞株(A549細胞)を移植したヌードマウス[用語7]
に対して、それぞれ生理食塩水(無治療群)、ドキソルビシンプロドラッグ、ドキソルビシン(抗がん剤本体)を4回投与しました(図3)。無治療群では、時間の経過とともに腫瘍の増大が確認されました(図3黒線)。ドキソルビシンを投与した場合には、腫瘍の増加を抑えたものの深刻な副作用により全ての個体が実験終了前に死亡してしまいました(図3赤線)。また、急激な体重減少が確認されました。
しかし、同等量のドキソルビシンプロドラッグを投与した場合には、副作用を抑えつつ腫瘍の増加を有意に抑えることが分かりました(図3青線)。
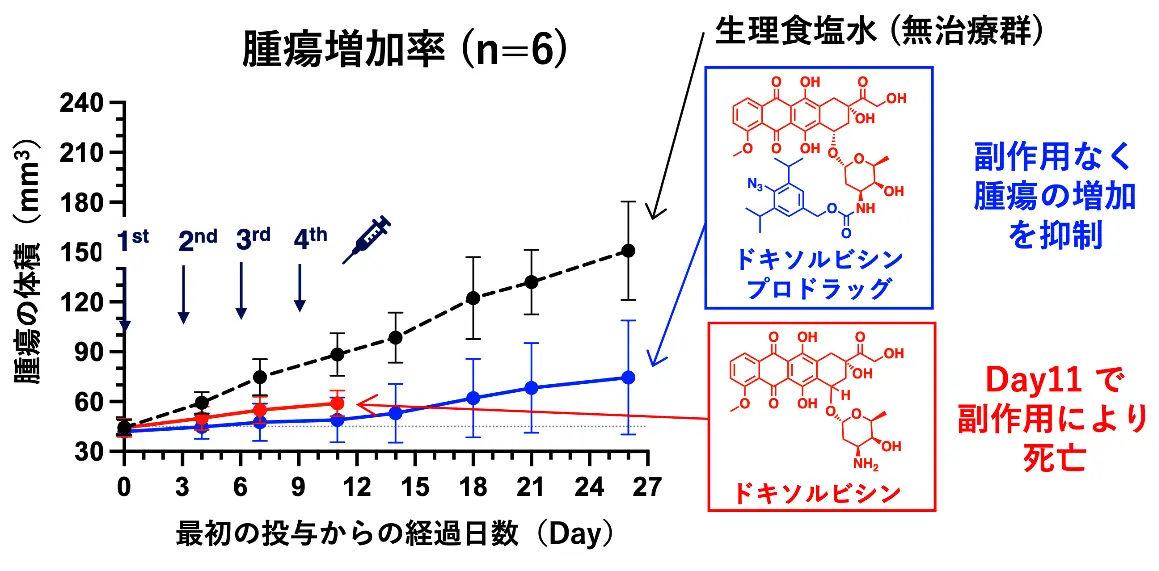
抗がん剤本体のドキソルビシンを投与した場合は副作用により早期に死亡が確認されたが、ドキソルビシンプロドラッグを投与した場合は副作用を抑えつつ腫瘍の増加を抑制することができた。
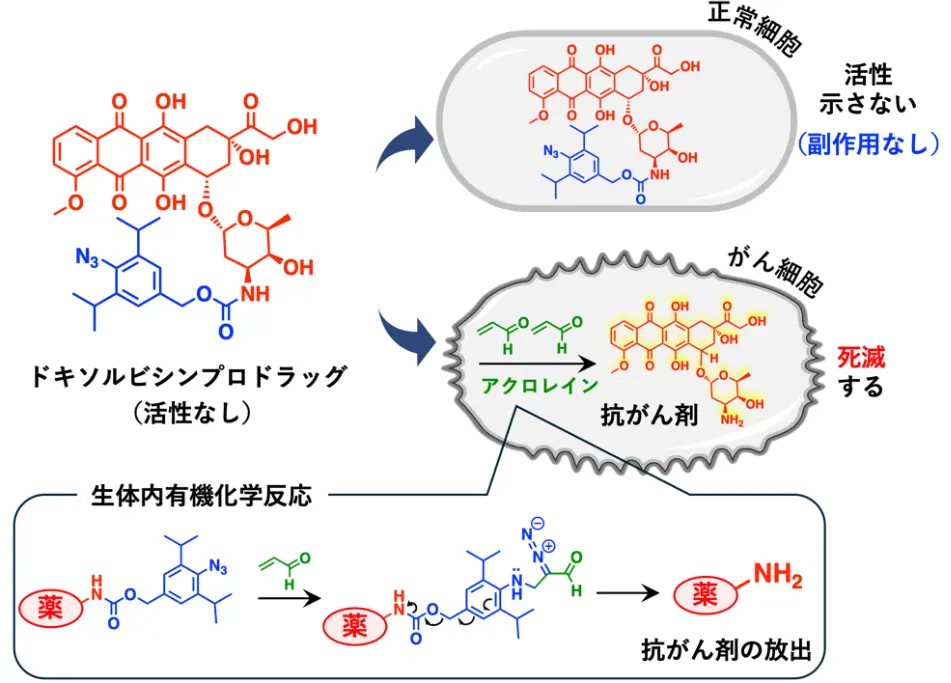
さらに、ドキソルビシンプロドラッグががん細胞内で抗がん剤に変換される機構の解明に挑みました。そこで、本薬剤投与後の血中と腫瘍の薬剤濃度を時間経過に沿って測定しました。静脈注射で投与されたドキソルビシンプロドラッグは、血液中のアルブミンに結合することにより、血液中で安定に滞在することが確認されました。その後、徐々にがん細胞内に移行し、がん細胞中のアクロレインと少しずつ反応することで、治療に必要最低限のドキソルビシンが放出されることを確認しました。このように必要最低限のドキソルビシンががん細胞内で放出されることで、正常細胞などには影響を及ぼさず副作用の少ないがん化学療法ができると考えられます。
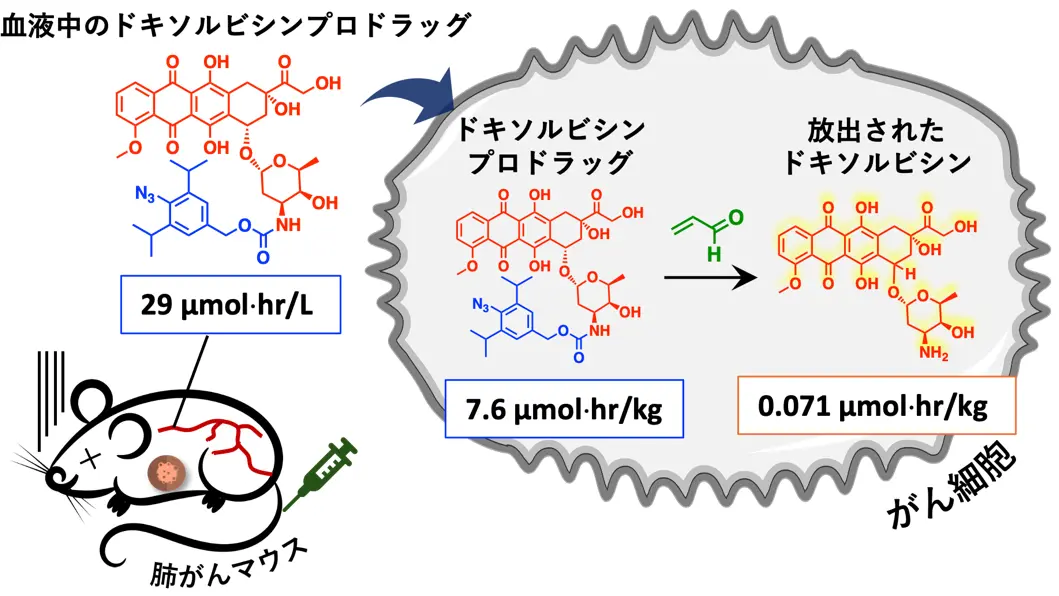
静脈注射により投与されたドキソルビシンプロドラッグは、血液中のアルブミンと結合することにより血液中で安定に存在する。その後がん細胞に到達すると、がん細胞中のアクロレインと徐々に反応し、ドキソルビシンががん細胞内にて放出される。必要最低限のドキソルビシンががん細胞内で放出されるため、副作用を抑えることができると考えられる。
また本薬剤の安全性を評価するために、放射線標識(トリチウム(3H)標識)したドキソルビシンプロドラッグを用い、投与から排せつまでの動きを調べました(図5)。ドキソルビシンプロドラッグは、投与から4時間後には血液中で安定に存在して、がんを含めて全身に分布していました。しかし、その後は蓄積することなく、168時間(7日)後にはほとんどの臓器から速やかに排せつされました。特定の臓器に長時間蓄積する場合には、副作用を伴いますが、本薬剤は体内に最小限しか蓄積せず速やかに排せつされたため、良好な安全性を示すことが分かりました。
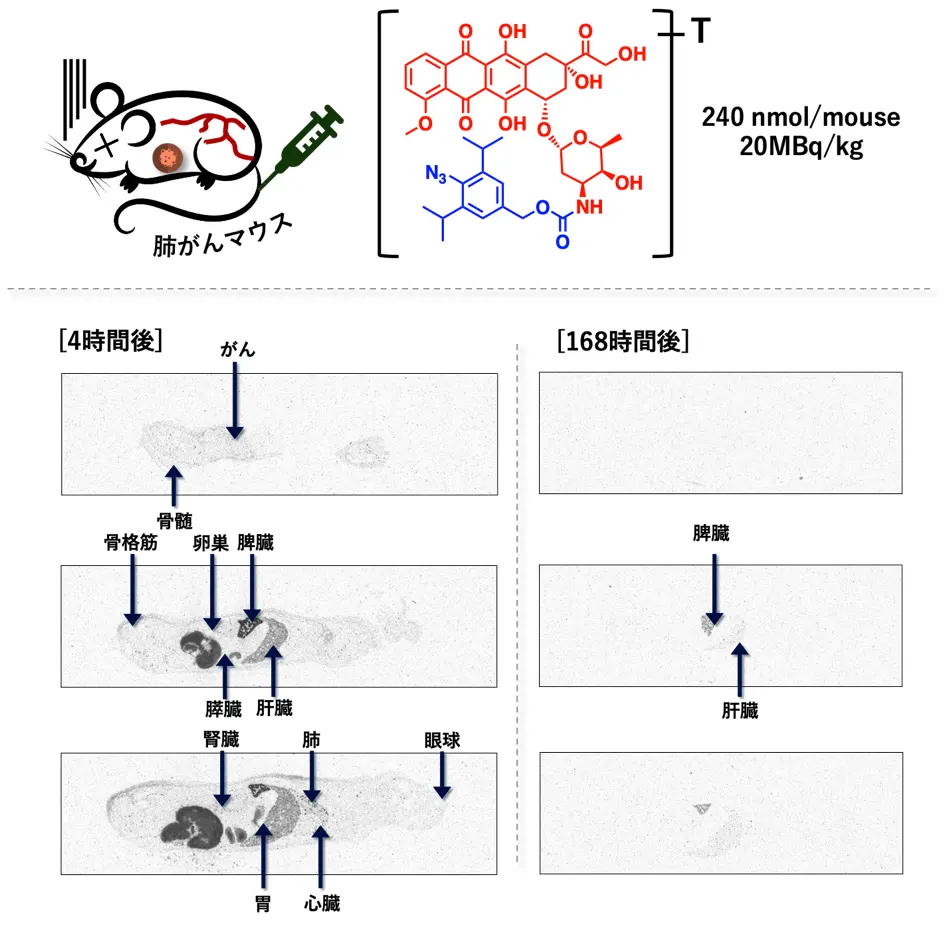
放射線標識したドキソルビシンプロドラッグは、投与すると4時間後にはがんを含めて全身に広がるが、その後は蓄積することなく、168時間(7日)後にはほとんどの臓器から排せつされることが分かった。
最後に、本薬剤の患者への応用を目指し、ヒトのがん腫瘍を移植したマウス(患者腫瘍移植モデル:PDXモデル)で治療実験を行いました(図6)。このマウスは従来の担がんマウスとは異なり、患者の腫瘍を直接移植しているため、実際の環境に非常に近いモデルです(図6A)。そのため、このモデルで成功することは、臨床研究への大きな一歩となります。
肺がんの患者腫瘍移植モデルに対して、ドキソルビシンプロドラッグまたはドキソルビシンを投与したところ、ドキソルビシンでは副作用により早期に死亡が確認された一方で、ドキソルビシンプロドラッグでは副作用を抑えつつ治療することができました(図6B左)。これは、大腸がん(図6B右)、乳がん、胃がんでも同様の傾向が見られました。このことから、ドキソルビシンプロドラッグは少ない副作用でがん患者を治療できる可能性があります。
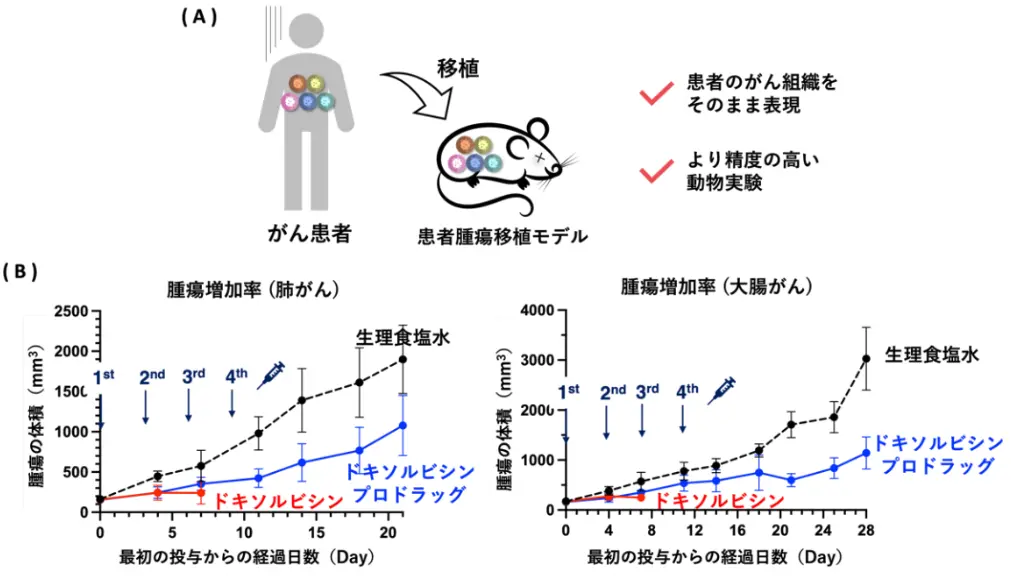
(A)患者腫瘍移植モデルは患者の腫瘍を直接移植したモデルで、実際の環境に非常に近く、精度の高い動物実験が可能。
(B)患者腫瘍移植モデル(肺がん/左図、大腸がん/右図)にドキソルビシンプロドラッグまたはドキソルビシン(抗がん剤本体)を投与した結果、抗がん剤本体のドキソルビシンでは副作用により早期に死亡が確認されたが、ドキソルビシンプロドラッグでは副作用を抑えつつ腫瘍の増加を抑制することができた。
今後の期待
今回、共同研究グループは、がん細胞内で有機化学反応を行い、がん現地でドキソルビシンを少しずつ発生させることで、副作用を大幅に抑えた新たなドキソルビシンプロドラッグを開発しました。この薬剤は、実際の患者に非常に近いモデル(患者腫瘍移植マウス)においても副作用を抑えつつ有意に腫瘍の増加を抑制しました。
今後、非臨床や臨床の研究を進めることにより、副作用を抑えたドキソルビシン薬剤を患者に届けることができると期待されます。
用語説明
- [用語1]
- 患者腫瘍移植モデル(PDX model):患者腫瘍移植モデルは、免疫力を抑え拒絶反応が起きにくいマウスにがん患者の腫瘍をそのまま移植したモデル。元のがんの腫瘍の性質や不均一性を保持しているため、薬効の予測精度が高いと報告されている。PDXはPatient Derived-Xenograft の略。
- [用語2]
- 臨床研究:医薬品などの開発候補物質や医療機器の実用化可能性を検証するためにヒトを対象として行う研究。
- [用語3]
- アクロレイン:生体内で生成される反応性の高いアルデヒド化合物。最近、田中生体機能合成化学研究室により、がん細胞内では普遍的に、外部から導入した試薬と優位に化学反応を起こすことができる高濃度(マイクロ〜ミリモーラー)でアクロレインが生成されることが発見された。
- [用語4]
- プロドラッグ:生体内の薬剤標的部位での化学反応によって、薬効を示す分子に変換されるようにデザインされた薬剤。標的部位選択的に活性を示すため、副作用の軽減が期待できる。標的部位での化学反応には、生体内の酵素による触媒反応や生体内の低分子化合物との反応が主に用いられる。また、近年は国内外で田中生体機能合成化学研究室が中心となって、生体内に導入した遷移金属触媒によって機能性分子を合成する研究も進められている。
- [用語5]
- CMC:医薬品を作り上げていくために必要な、プロセス研究、製剤開発、品質保証・管理などの一連のプロセスを指す。CMCは、Chemistry, Manufacturing and Controlの略。
- [用語6]
- GMP:「製造管理および品質管理の基準」のことを指す。これは、「人為的な誤りを最小限にすること」、「医薬品の汚染および品質低下を防止すること」、「高い品質を保証するシステムを設計すること」の三つの原則に基づいており、安全な医薬品を製造するために、医薬品製造所が守るべき基準である。GMPは、Good Manufacturing Practiceの略。
- [用語7]
- ヌードマウス:先天的に胸腺を欠くマウス。胸腺を欠損しているためにT細胞が作られず、免疫不全を起こす。他の動物種の細胞を拒絶する力も弱いので、がん細胞の移植実験によく用いられる。
論文情報
- 掲載誌:
- Tetrahedron Chem
- 論文タイトル:
- Highly efficient and selective anticancer approach through acrolein-triggered cycloaddition chemistry in patient-derived xenografts: Mechanistic and preclinical investigation
- 著者:
- Yuria Takahashi, Kazuki Terashima, Taiji Shimoda, Masayuki Nagahashi, Koji Morimoto, Sayaka Urano, Kozo Kataoka, Hisashi Shinohara, Yasuo Miyoshi, Ambara R. Pradipta, and Katsunori Tanaka
共同研究グループ
東京科学大学 物質理工学院 応用化学系
- 教授 田中克典(理化学研究所 開拓研究本部 田中生体機能合成化学研究室 主任研究員)
- 助教 アンバラ・プラディプタ(Ambara Pradipta)(同 客員研究員)
- 修士課程2年 髙橋ゆりあ(同 研修生)
- 博士後期課程2年 寺島一輝(同 研修生)

株式会社糖鎖工学研究所
- 事業部長 下田泰治
兵庫医科大学 医学部
乳腺・内分泌科
- 教授 三好康雄
- 准教授 永橋昌幸
- テクニカルスタッフ 浦野清香
下部消化管外科
- 講師 片岡幸三
上部消化管外科
- 主任教授 篠原尚
大阪国際大学 人間科学部 人間健康科学科
- 教授 盛本浩二