概要
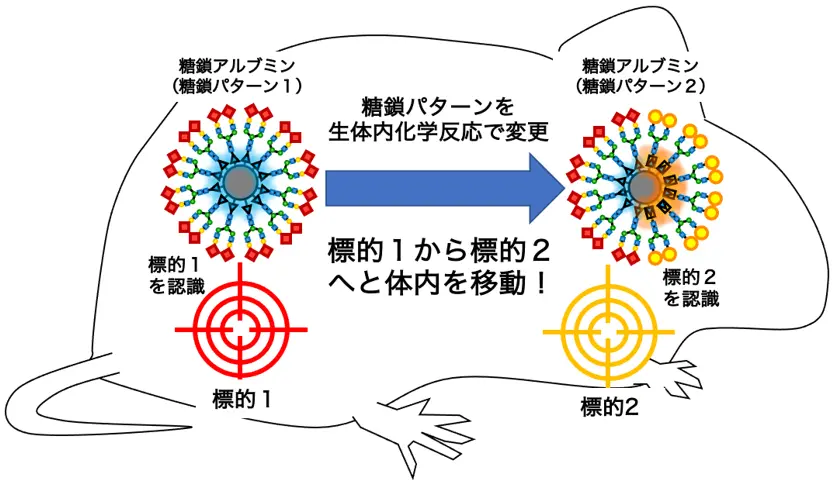
東京科学大学* 物質理工学院 応用化学系の田中克典教授(理化学研究所(理研)開拓研究本部 田中生体機能合成化学研究室主任研究員)、理研 開拓研究本部 田中生体機能合成化学研究室のチャン・ツンチェ研究員、山田健士郎研修生(研究当時、東京工業大学 物質理工学院 応用化学系博士後期課程3年(研究当時))、向峯あかり特別研究員(研究当時)らの研究チームは、化学反応により体内で糖タンパク質の糖鎖[用語1]構造を変化させることで、糖鎖の臓器に対する認識を変化させ、臓器から臓器へと分子を移動させることに成功しました。
抗体のように強く特定の細胞や臓器を認識する分子は、いったん、その細胞や臓器にくっつくと引き剝がすことは困難です。一方、これまで田中教授は、複数種類の糖鎖構造を組み合わせて認識させる「糖鎖パターン認識」を用いると、ほんのわずかな糖鎖パターンの違いによって標的となる細胞や臓器の種類が劇的に変化することを見いだしています。
研究チームは、体内での化学反応により糖鎖パターン認識を変更できる糖タンパクを開発し、それを使って、マウス体内で尿排せつから便排せつへ、あるいはがんから腸管へと、分子を移動させることに成功しました。この研究成果は、体内の異なる疾患を1分子でパトロールして治療し、治療終了後には体外へ排出できる分子が実現可能であることを示しています。1966年に公開されたハリウッド映画『ミクロの決死圏』の世界の、“未来の技術”の実現に向けた大きな一歩となります。
本研究は、オンライン科学雑誌『Nature Communications』(10月2日付:日本時間10月2日)に掲載されました。
*2024年10月1日に東京医科歯科大学と東京工業大学が統合し、東京科学大学(Science Tokyo)となりました。
背景
糖鎖は「細胞の顔」と呼ばれる分子で、細胞同士がお互いを認識し合う際に不可欠であり、この認識には糖鎖とレクチン(糖鎖を認識するタンパク質)の弱い相互作用が重要な役割を果たしています。これまでに田中教授らは、糖鎖による細胞認識を模倣し、複数種類の糖鎖をアルブミン[用語2]上にクラスター化した糖鎖アルブミンを作製し、がんへのターゲティング技術を開発してきました。一本の糖鎖とレクチンの相互作用は弱いですが、複数の糖鎖を組み合わせた糖鎖クラスター[用語1]とすることで、相互作用が増強されます。さらに複数種類の糖鎖から成る「糖鎖パターン」として細胞に提示すると、細胞表面の複数種類のレクチンとの相互作用が全てマッチした場合にのみ強い相互作用が生じるため、選択的な標的認識が可能となります(図1)。この複数種類の糖鎖を介した選択的な認識を、「糖鎖パターン認識」と呼びます。
田中教授らは、糖鎖パターンを持つさまざまな糖鎖アルブミンを開発し、マウス内でのがんや膵臓(すいぞう)、肝臓、あるいは脾臓(ひぞう)を精度よく認識したり、尿排せつや便排せつの経路を制御したりすることに成功してきました※1~5。糖鎖パターン認識の大きな特徴として、糖鎖クラスターを構成する一部の糖鎖が変化するだけで標的の認識が大きく変化することが挙げられます。もし、糖鎖パターンを動物の体内で変更することができれば、細胞や臓器への認識を体内で自由に切り替えて、細胞から細胞へ、あるいは臓器から臓器へと自在に移動させることができると予想しました。
- ※1 生体内部を高度に認識できる糖鎖複合体|理化学研究所(2016年2月23日プレスリリース)
- ※2 糖鎖は不均一であることが重要|理化学研究所(2016年11月28日プレスリリース)
- ※3 がんを糖鎖のパターンで識別|理化学研究所(2018年7月4日プレスリリース)
- ※4 がんを指紋認証のように認識・標識化する技術|理化学研究所(2020年3月9日プレスリリース)
- ※5 糖鎖の不均一性を秩序よく高次化してがんを見つける|東工大ニュース(2020年10月21日プレスリリース)
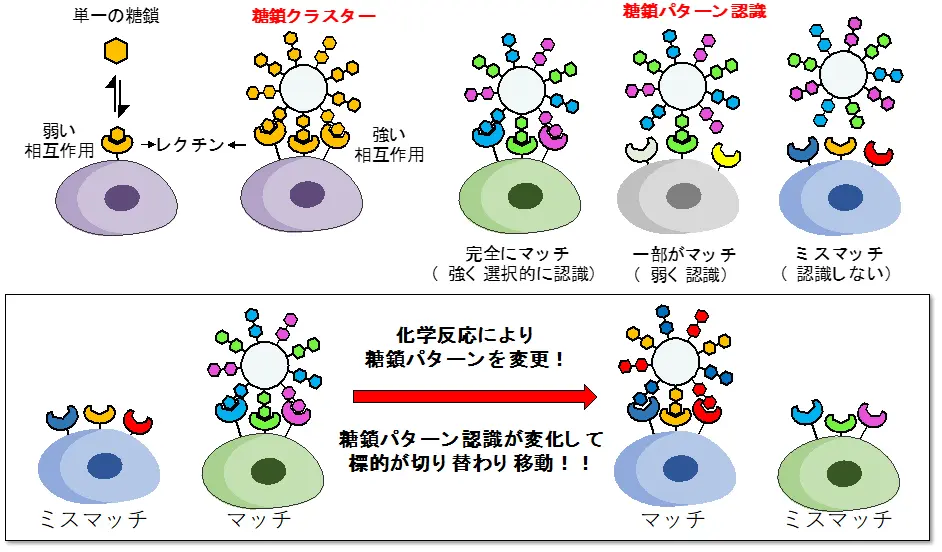
糖鎖とレクチンの相互作用は弱いが、糖鎖をクラスター化することで相互作用が増強される。複数種類の糖鎖を組み合わせた糖鎖パターンとして提示すると、複数種類のレクチンとの相互作用が全てマッチした場合にのみ強い相互作用が生まれる。これを利用して、もし糖鎖パターンを体内で変更することができれば、標的への認識が切り替わり、細胞から細胞、あるいは臓器から臓器へと移動させることが可能となる。
研究成果
糖鎖アルブミンの体内移動を実現するためには、刺激に応じて素早く体内で糖鎖パターンを変更する手法が必要です。そこで着目したのが、2022年のノーベル化学賞として話題になったクリック反応[用語3]です。クリック反応は短時間で進行するシンプルな化学反応であり、細胞内の複雑な環境下で新たな結合を形成する技術です。中でもclick-to-release法[用語4]は、結合の形成(click反応)・切断(release反応)を一挙に進行させる方法として用いられています。そこで研究チームは、click-to-release反応を利用することで、マウスの体内で糖鎖アルブミン上に新しい糖鎖を導入するとともに、アルブミン上の古い糖鎖を切り離すことができると考えました。すなわちclick-to-release法により、糖鎖アルブミン上のパターン認識を体内で変更し、糖鎖アルブミンを体内で動かすことができると予想しました。
研究チームはまず体外で、click-to-release法による糖鎖付け替え反応を検討しました。click-to-release法では、trans-シクロオクテン基(図2の青で示した構造)に対してテトラジン基(図2のオレンジで示した構造)を反応させ、二つの分子が結合(click反応)した後、元からある分子の切り離し反応(release反応)が進行します(図3)。今回、trans-シクロオクテン基を糖鎖アルブミンに組み込んだ化合物と、新たに導入する糖鎖に対してテトラジンを結合させた化合物をそれぞれ合成し、両者の反応を検討しました。質量分析法で反応を追跡したところ、反応開始10分後には分子量の増加が観測され、click反応により新しい糖鎖がアルブミン上に導入されたことが分かりました。その後、反応開始4時間後には分子量が減少し、もともとアルブミン上に結合していた古い糖鎖が切断されたことが分かりました。これらの結果より、click-to-release反応によってアルブミンの糖鎖が付け替わり、糖鎖パターンを変更できることが明らかとなりました。
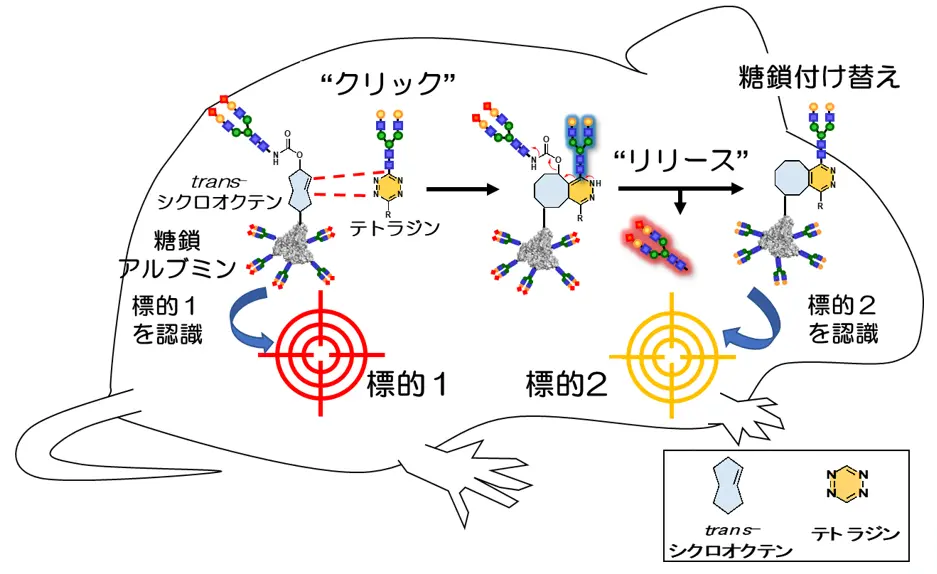
標的1(細胞や臓器)を認識する糖鎖アルブミン(標的1のパターン認識)に対して、click-to-release反応を進行させることで、新たな糖鎖の導入とともに古い糖鎖が切り離され、標的2を認識する糖鎖アルブミン(標的2のパターン認識)へと変更することができる。マウス体内でこの反応を実施すれば、標的1から標的2に糖鎖アルブミンを動かすことができる。
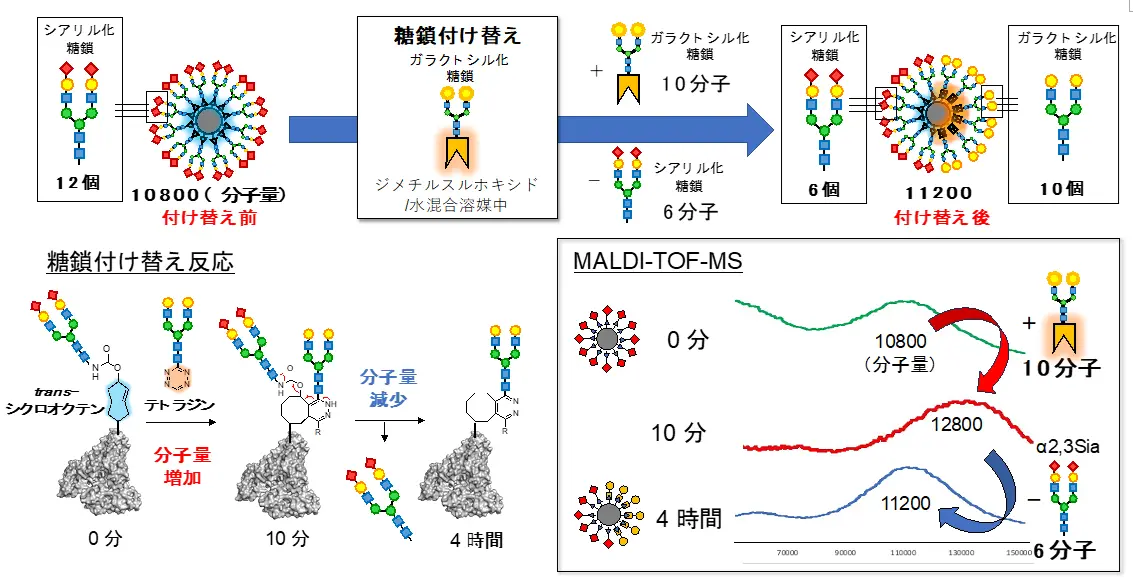
click-to-release反応を開始した後、10分後にはclick反応により10本のガラクトシル糖鎖が導入され、糖鎖アルブミンの分子量が12,800まで増加した。その後、4時間後にはrelease反応により6本のシアリル化糖鎖が切り離され、11,200まで分子量が減少した(右下)。
続いて研究チームは、この糖鎖付け替え反応を生きたマウス体内で実施し、糖鎖アルブミンを体内で動かすことに挑戦しました。これまでに田中教授らは、シアリル化糖鎖を持つ糖鎖アルブミンは膀胱(ぼうこう)から尿として排せつされるのに対し、ガラクトシル化糖鎖を持つ糖鎖アルブミンは腸管から便として排せつされることを見いだしています。
そこでまず、マウス体内に投与したシアリル化糖鎖アルブミンに対して血中でclick-to-release反応を行い、ガラクトシル化糖鎖へ付け替えることで排せつ経路を尿から便へと切り替えることを計画しました(図4)。ここでは、糖鎖アルブミンに蛍光標識を行うことで、近赤外蛍光イメージング法[用語5]を用いてマウス体内での糖鎖アルブミンの「動き」を可視化しました。すなわち、シアリル化糖鎖を持つ糖鎖アルブミンをマウス尾静脈から投与したところ、糖鎖アルブミンは迅速に膀胱へと移動し、尿から排せつされることが分かりました。一方で、シアリル化糖鎖を持つ糖鎖アルブミンについて、血中でclick-to-release反応によりガラクトシル化糖鎖に付け替えたところ、糖鎖アルブミンが腸管を経て便から排せつされることが分かりました。このように、マウス体内で化学反応により糖鎖を効率的に付け替えることで、排せつ経路を体内で変更することに成功しました。
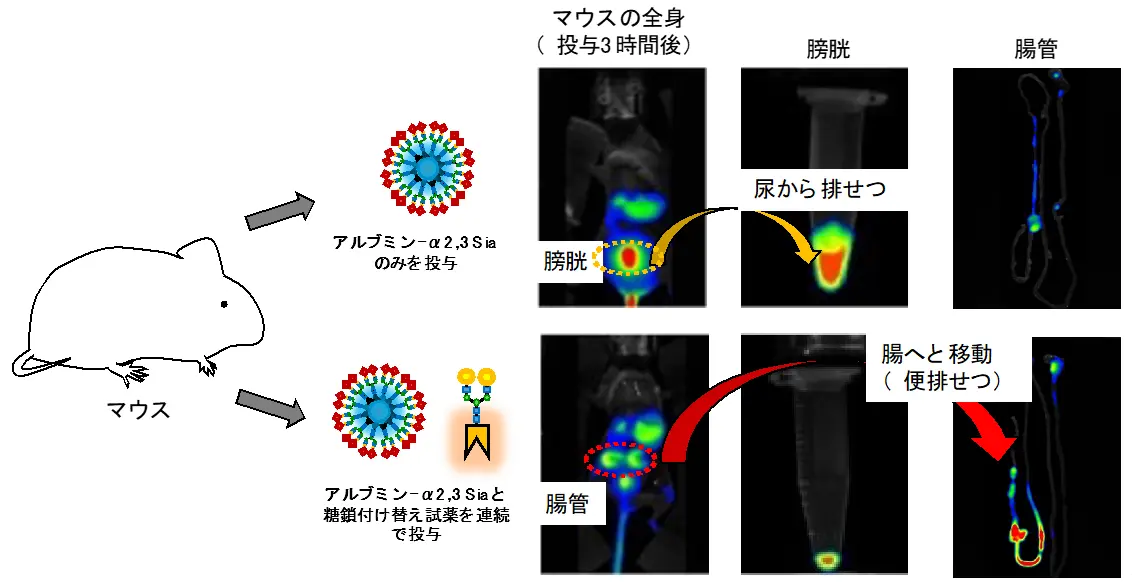
上)マウスに対してシアリル化糖鎖(α2,3-Sia)を持つ糖鎖アルブミンを尾静脈投与すると、3時間後には糖鎖アルブミンが膀胱を経て尿から排せつされた。
下)マウスに対してシアリル化糖鎖(α2,3-Sia)を持つ糖鎖アルブミン、ならびにガラクトース糖鎖に付け替える反応試薬を尾静脈から連続投与すると、3時間後には糖鎖アルブミンが腸から便として排せつされた。
次に研究チームは、マウスの腫瘍部位で糖鎖を付け替えることで、糖鎖アルブミンをがんから腸管へと移動させることを試みました(図5)。田中教授らは、シアリル化糖鎖を持つ糖鎖アルブミンはSW620大腸がんを認識し、ガラクトシル化糖鎖は認識しないことを見いだしています。そこで、SW620大腸がんに結合しているシアリル化糖鎖アルブミンに対して、ガラクトシル化糖鎖への付け替えを行うことを計画しました。SW620大腸がんへの結合が弱められて糖鎖アルブミンが乖離(かいり)し、さらにガラクトシル化糖鎖に置き換わった糖鎖アルブミンは腸管へと移動すると予想しました。SW620大腸がんを移植したマウスの腫瘍部位に対して、シアリル化糖鎖を持つ糖鎖アルブミンを直接投与したところ、糖鎖アルブミンはまず腫瘍部位に結合して滞留し、時間とともに尿から排せつされました。一方、シアリル化糖鎖を持つ糖鎖アルブミンに対して、腫瘍部位でclick-to-release反応によりガラクトシル化糖鎖に付け替えたところ、糖鎖アルブミンが速やかに腫瘍部位から腸管部位へと移動しました。このように、腫瘍部位で直接、糖鎖を付け替えることにより、がんから腸管へと糖鎖アルブミンを移動させることに成功しました。
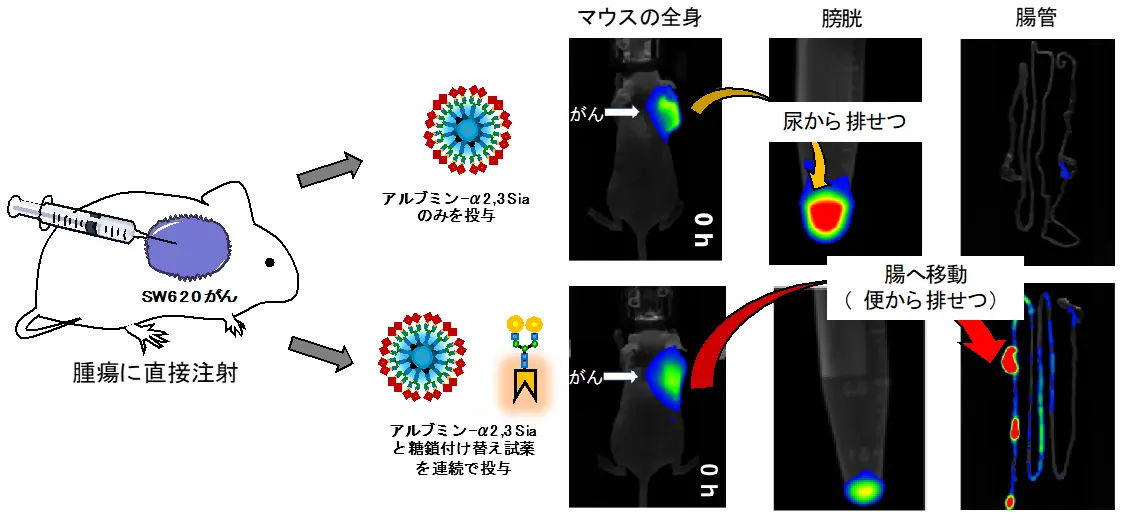
上)マウスの腫瘍部位に対してシアリル化糖鎖(α2,3-Sia)を持つ糖鎖アルブミンを投与すると、まず糖鎖アルブミンは腫瘍内にとどまる。その後、5時間後にゆっくりと尿から排せつされた。
下)マウスの腫瘍部位に対してシアリル化糖鎖(α2,3-Sia)を持つ糖鎖アルブミン、ならびにガラクトース糖鎖に付け替える反応試薬を連続投与すると、糖鎖アルブミンががんから腸へと移動し、便から排せつされた。
今後の期待
今回、研究チームが開発した「化学反応により体内を動く分子」と生体寛容性の金属触媒反応※6~10を組み合わせることで、これまでのドラッグデリバリーシステム[用語6]では成し得ない、画期的な治療技術が夢ではなくなります。例えば糖鎖アルブミンを体内の複数の疾患部位へ順番に移動させ、それぞれの箇所で必要な分だけ必要な薬剤を生体内合成して治療を行った後、体外へ排出させることが可能となります。これは、体内の異なる疾患を1分子でパトロールして治療し、治療終了後には体外へ排出できる分子が「有機合成化学」により実現可能であることを示しています。1966年に公開されたハリウッド映画『ミクロの決死圏』での“未来の技術”の実現に向けた大きな一歩となります。
- ※6 狙った臓器で金属触媒反応を実現|理化学研究所(2017年2月15日プレスリリース)
- ※7 触媒的『現地合成』によるがん治療|理化学研究所(2019年7月2日プレスリリース)
- ※8 世界初のマウス体内におけるタギング治療|東工大ニュース(2021年4月24日プレスリリース)
- ※9 体内でベンゼン環を作る|東工大ニュース(2022年1月10日プレスリリース)
- ※10 植物毒の「現地合成」でがん細胞の増殖阻害に成功|東工大ニュース(2022年9月29日プレスリリース)
研究チーム
-
東京科学大学 物質理工学院 応用化学系
- 教授 田中克典(理化学研究所 開拓研究本部 田中生体機能合成化学研究室 主任研究員)
-
理化学研究所 開拓研究本部 田中生体機能合成化学研究室
- 研究員 チャン・ツンチェ(Tsung-Che Chang)
- 客員研究員 アンバラ・プラディプタ(Ambara Pradipta)(東京科学大学 物質理工学院 応用化学系 助教)
- 研修生(研究当時)山田健士郎(東京工業大学 物質理工学院 応用化学系 博士後期課程3年(研究当時)、 現 関西学院大学 生命環境学部 環境応用化学科 助教)
- 特別研究員(研究当時)向峯あかり(現 北海道大学 化学反応創成研究拠点 特任助教)
- テクニカルスタッフII 中村亜希子
- 研究パートタイマーII 草苅百合子

付記
本研究は科学研究費助成事業、および水谷糖質科学振興財団(研究代表者:田中克典)の助成を受けて行われました。
用語説明
- [用語1]
- 糖鎖、糖鎖クラスター:糖鎖とは、最も単純な糖である単糖(ガラクトースなど)が数個、ときには数百個以上も枝分かれしながら連なったもの。同一あるいは数種類の糖鎖が、ある基盤上に複数個並べられた構造を糖鎖クラスターと呼ぶ。
- [用語2]
- アルブミン:分子量が6万程度の極めて安定な可溶性タンパク質で、血清中の大部分を占める。さまざまな薬物と配位する疎水性ポケットが存在し、血中を運搬する。表面に反応性の高いリジン残基が30個程度存在するため、糖鎖などの機能性低分子を付着させる生体高分子としてもよく使用される。生体内に静脈注射すると、皮下の毛細血管を通り、体全体に広く分布する。
- [用語3]
- クリック反応:スクリプス研究所のB. K. Sharpless教授(2001年、2022年ノーベル化学賞受賞)によって提起された効率的な結合形成反応。シートベルトを締める際の“カチッ”という音がする動作のように、二つの反応部位が、速やかに、かつ選択的に、しかも他の副生成物を生じることなく100%に近い効率で結合生成を起こすような型の反応。この代名詞となるような反応として、アジドとアセチレン(炭素−炭素三重結合を持つ化合物)がトリアゾールを与える反応が挙げられ、細胞や動物体内での反応にも活用されている。
- [用語4]
- click-to-release法:クリック反応の中でも、trans-シクロオクテンとテトラジンの反応を利用して、結合の形成(click反応)と切断(release反応)を一挙に進行させる手法。
- [用語5]
- 蛍光イメージング:目的の化合物に蛍光色素を付けた後、細胞内、あるいは動物の体内に導入することにより、その化合物が発する蛍光を指標として、生体内での動きを観察(イメージング)すること。
- [用語6]
- ドラッグデリバリーシステム:体内の薬物分布を量的・空間的・時間的にコントロールする薬物伝達システム。特定の組織への効果や副作用の軽減が期待できる。
論文情報
掲載誌:Nature Communications
論文タイトル :Chemistry-driven translocation of glycosylated proteins in mice
- 著者
- Kenshiro Yamada, Akari Mukaimine, Akiko Nakamura, Yuriko Kusakari, Ambara R. Pradipta, Tsung-Che Chang, Katsunori Tanaka
お問い合わせ
取材申込み
東京科学大学 総務企画部 広報課
- Tel
- 03-5734-2975
- Fax
- 03-5734-3661
- media@ml.tmd.ac.jp
理化学研究所 広報室 報道担当
- Tel
- 050-3495-0247
- ex-press@ml.riken.jp