ポイント
- 細胞の分泌過程を可視化できる顕微鏡技術「LCI-S」を活用し、ヒト単球における炎症性サイトカインIL-1βの放出メカニズムを単一細胞レベルで解明。
- IL-1βは「生きた単球」ではなく、炎症性細胞死(パイロトーシス)を起こすごく一部の単球(約5〜10%)から放出されるDAMPであることを実証。
- この経路が自己炎症性疾患クリオピリン関連周期熱症候群患者で自発的に作動することを確認し、炎症制御の新たなパラダイムを提唱。

概要
東京科学大学(Science Tokyo) 総合研究院 M&Dデータ科学センター AI技術開発分野の鎌谷高志講師と同 大学院医歯学総合研究科 茨城県小児・周産期地域医療学講座の清水正樹寄附講座教授は、東京大学、京都大学、ゲント大学等による国際共同研究グループと共同で、細胞の分泌過程を可視化できる顕微鏡技術「LCI-S」を中心とした単一細胞解析技術を用い、ヒト単球における炎症性サイトカインIL-1βの分泌メカニズムを単一細胞レベルで解明しました。その結果、IL-1βは「生きた単球」からではなく、ごく一部の単球(約5〜10%)が炎症性細胞死(パイロトーシス)を起こす過程で放出されることを世界で初めて実証しました。この発見により、従来「炎症性サイトカイン」として知られていたIL-1βが、細胞死に伴ってDAMPとして放出される分子であることが明らかになりました。さらに、自己炎症性疾患であるクリオピリン関連周期熱症候群(CAPS)患者の単球では、この経路が自発的に作動していることを確認し、ヒト炎症疾患の発症機構を直接的に示すとともに、炎症制御の新たなパラダイムを提示しました。
本研究成果は、11月11日付で免疫学研究に関する科学誌「Nature Immunology」に掲載されました。

LCI-Sによって撮影したヒト単球が炎症性細胞死(パイロトーシス)に伴って炎症性サイトカインIL-1βを放出する様子。上:明視野+細胞死染色SYTOX orange(ピンク)、下:IL-1β放出(Green-Fire-Blue)。撮影間隔はおよそ1時間ごと。
発表内容
炎症を引き起こす主要な物質であるインターロイキン-1β(IL-1β)は、体内でどのように放出されるのか――この疑問は30年以上にわたり議論されてきました。特に、ヒトの血液中でIL-1βを作る主な細胞である単球が「生きたまま分泌するのか、それとも細胞死に伴って漏れ出るのか」は、決着のつかない論点でした。
本研究では、この問いに対して細胞がタンパク質を放出する瞬間をリアルタイムで可視化できるライブセルイメージング技術「LCI-S(Live Cell Imaging of Secretion activity)」を用いて挑みました。この方法では、抗体で分泌タンパク質をとらえて光らせる仕組みを使い、全反射蛍光照明法によって洗浄操作を行わずに細胞が分泌する様子の一部始終を撮影することができます。その結果、細胞の生死状態と分泌現象を同時に追跡することが可能になりました。
この技術を使って、細菌成分LPSで刺激したヒト単球のIL-1β放出を単一細胞レベルで観察しました。その結果、IL-1βを放出していたのは生きた細胞ではなく、一部の細胞が壊死(ネクローシス)に陥るときに一過的に多量に放出していることが明らかになりました。この細胞死は、炎症性の細胞死「パイロトーシス」と呼ばれる現象で、NLRP3インフラマソームとガスダーミンDの活性化によって起こっていました。解析の結果、IL-1βの99%はこのパイロトーシスによるものであり、これまで信じられてきた「生存単球がIL-1βを分泌する」という説を覆しました。このパイロトーシスを生じる単球亜集団は、CD14およびCD33の細胞表面発現の低い細胞に富むことから、CD33がCD14を介してTLR4シグナル伝達を負に制御する役割を持つことを考慮すると、この表現型はTLR4シグナル伝達を増強し、インフラマソーム活性化を促進するような調節的変化を反映している可能性があります。
さらに、クリオピリン関連周期熱症候群患者由来の単球では、この現象が自然に起きることも確認され、ヒト疾患の病態に直結する仕組みであることが示されました。
本研究は、LCI-S技術によって「見えなかった分泌の瞬間」を世界で初めて捉え、長年の論争に終止符を打った成果です。IL-1βは「死にゆく単球から放出される分子(Damage-associated Molecular Pattern:DAMP)」であることが明確となり、この発見は炎症や感染症、自己炎症性疾患の理解を深め、将来的には、炎症の早期診断や病状のモニタリング、新しい治療法の開発につながる技術としての応用が期待されます。
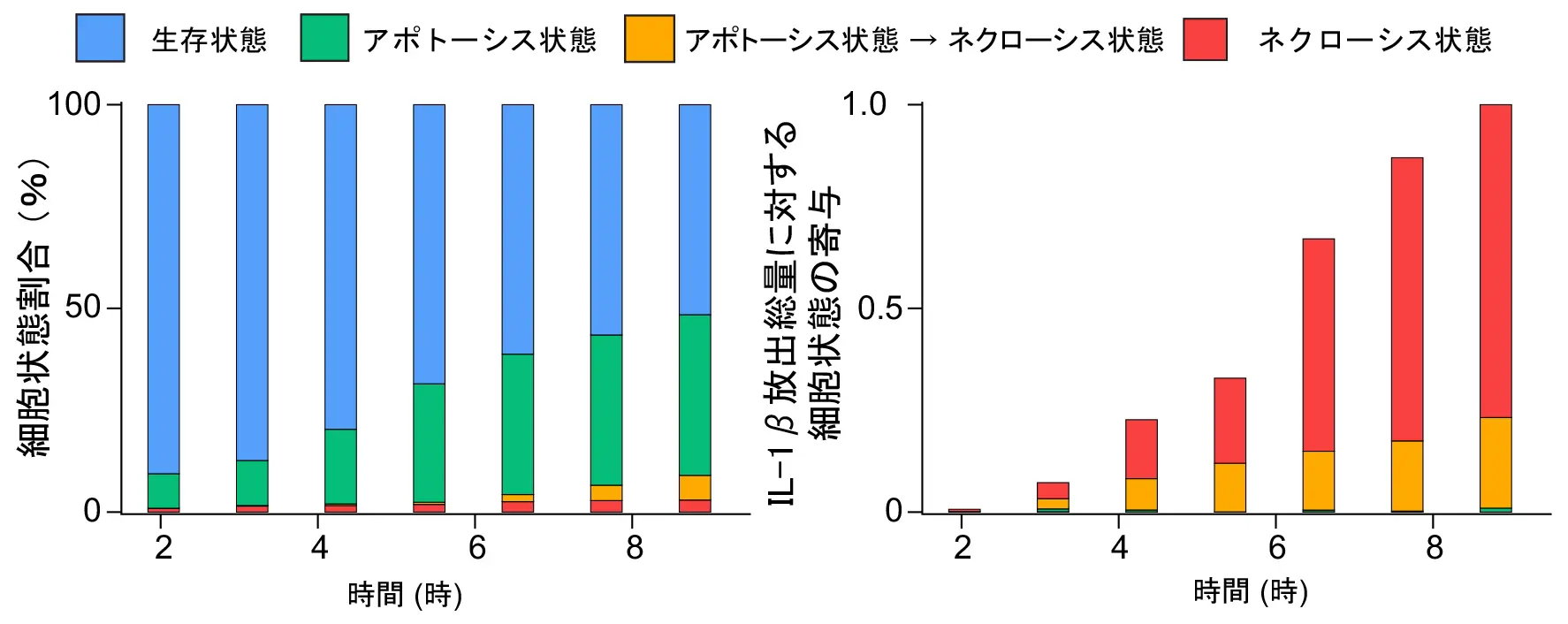
健常者の末梢血単球にLPSで擬似感染刺激を与え、各細胞状態割合(左)と、放出されたIL-1βの総量に対する各細胞状態の寄与(右)の時間推移を示す。ネクローシス状態の割合は小さいが、大部分のIL-1β放出を担っていた。
なお、本研究は京都大学医学部附属病院倫理委員会の承認のもと、ヘルシンキ宣言および日本の法令に則り実施されました。
発表者・研究者情報
-
東京大学 先端科学技術研究センター 光量子イメージング分野
白崎 善隆 准教授 -
京都大学 大学院医学研究科 発達小児科学
滝田 順子 教授
井澤 和司 講師
加藤 健太郎 研究当時:医員 -
久留米大学医学部小児科
西小森 隆太 教授 -
財団法人かずさDNA研究所
小原 收 副所長 -
東京科学大学
総合研究院 M&Dデータ科学センター AI技術開発分野
鎌谷 高志 講師
大学院医歯学総合研究科 茨城県小児・周産期地域医療学講座
清水 正樹 寄附講座教授 -
群馬大学医学部小児科
滝沢 琢己 教授 -
株式会社ライブセルダイアグノシス
山岸 舞 博士 -
Ghent University Faculty of Medicine and Health Sciences
Prof. Mohamed Lamkanfi
Lieselotte Vande Walle
Alex Vervaeke -
Janssen Interventional Oncology
Rosa Martín-Pérez
付記
本研究は、AMED先端計測分析技術・機器開発プログラム(JP20hm0102082)、厚労省科研費 難治性疾患実用化研究事業(JPMH23FC1016)、文科省科研費(JP23767854、23K17463、25K11080)、科学研究基金FWO-Flanders(G017121N、G0I5722N、G014221N)、欧州研究会議(ERC-2022-PoC 101101075)、並びにJSTムーンショット型研究開発事業(JPMJMS2217)の支援により実施されました。
論文情報
- 掲載誌:
- Nature Immunology
- タイトル:
- Single-cell analysis reveals cell death as driver of NLRP3-mediated secretion of IL-1β in human monocytes
- 著者:
- Lieselotte Vande Walle†, Kentaro Kato†, Mai Yamagishi, Takashi Kamatani, Alex Vervaeke, Rosa Martín-Pérez, Masaki Shimizu, Takumi Takizawa, Junko Takita, Ryuta Nishikomori, Osamu Ohara, Kazushi Izawa*, Yoshitaka Shirasaki*, Mohamed Lamkanfi*