ポイント
- 肥満マウスはSARS-CoV-2感染すると早期に死亡するが、抗リウマチ薬「イグラチモド」の治療により、生存率が有意に改善することを発見した
- イグラチモドは、ウイルス感染によって引き起こされる過剰な炎症(サイトカインストーム)を抑制しつつ、ウイルス排除に必要な免疫機能は損なわないことが示唆された
- イグラチモドは、関節リウマチの治療に使われている安全性の高い薬剤であり、重症COVID-19への新たな治療薬としての適応拡大(ドラッグ・リポジショニング)が期待される
概要
東京科学大学(Science Tokyo) 医歯学総合研究科 膠原病・リウマチ内科学分野の保田晋助教授と細矢匡准教授、大庭聖也大学院生らによる研究チームは、国立感染症研究所との共同研究により、抗リウマチ薬イグラチモド(Iguratimod)[用語1]の投与によって、SARS-CoV-2[用語2]感染によるマウスの生存率を改善できることを明らかにしました。
これまでの研究で、同研究チームは、内臓脂肪の蓄積がSARS-CoV-2感染によるサイトカインの過剰産生(サイトカインストーム)[用語3]のリスクとなることを示してきました。本研究では、ウイルスに感染させた肥満マウスにイグラチモドを投与することで、生存率の改善だけでなく、肺組織の傷害を軽減し、炎症を抑えることを発見しました。
興味深いことに、COVID-19患者で使用されるステロイドでは炎症を抑える効果は認められたものの、肺組織の障害抑制や生存率の改善といった効果は見られず、さらにウイルス排除に必要な免疫応答までも抑制してしまうことが分かりました。
重症COVID-19に合併するサイトカインストームに対しては、ステロイドや抗IL-6(インターロイキン6)[用語4]阻害薬が治療に用いられています。しかし、これらの薬剤には免疫抑制作用があり、COVID-19後の肺炎リスクを高める可能性があります。
本研究の結果からは、イグラチモドは重症COVID-19に伴う有害な過剰炎症を抑えつつ、ウイルス排除に必要な免疫応答は抑制しない可能性が示唆されました。イグラチモドは、効果が高く副作用も少ない安全性の高い抗リウマチ薬であるため、COVID-19治療への応用も期待されます。
この研究は、国立研究開発法人日本医療研究開発機構による免疫アレルギー疾患実用化研究事業の支援のもとで実施されたものであり、その成果は、国際科学誌「European Journal of Pharmacology」誌のオンライン版に2025年4月1日付で早期公開され、同年6月5日に同論文雑誌に収録されます。
背景
COVID-19は新型コロナウイルス(SARS-CoV-2)によって引き起こされ、一部の患者では重症肺炎を引き起こします。感染時には抗ウイルス作用を持つインターフェロンが誘導されますが、同時に炎症を促進する転写因子NF-κB(エヌエフカッパービー)[用語5]も活性化され、過剰な炎症(サイトカインストーム)が重症化や全身性の障害を招きます。
研究チームはこれまでに、COVID-19入院患者の臨床情報と、内臓脂肪が蓄積する肥満マウスの解析を通じて、内臓脂肪が炎症を増幅させ、COVID-19の重症化や予後悪化を促進することを明らかにしました[参考文献1]。また、SARS-CoV-2のSタンパク質がマクロファージに直接作用し、サイトカイン産生を誘導することも確認しています[参考文献2] 。
重症例の治療には、ステロイドやIL-6阻害薬が用いられますが、これらは免疫全体を抑制し、ウイルス排除の遅延や二次感染のリスクを高めることが課題です。そのため、ウイルス免疫を損なわずに炎症だけを抑える新たな治療法が求められています。
イグラチモドは日本で開発された抗リウマチ薬で、NFκB阻害活性を持ち、炎症を抑えます[参考文献3]。一方で副作用が少なく安全性も高いため、本研究ではCOVID-19によるサイトカインストームへの有効性を検討しました。
研究成果
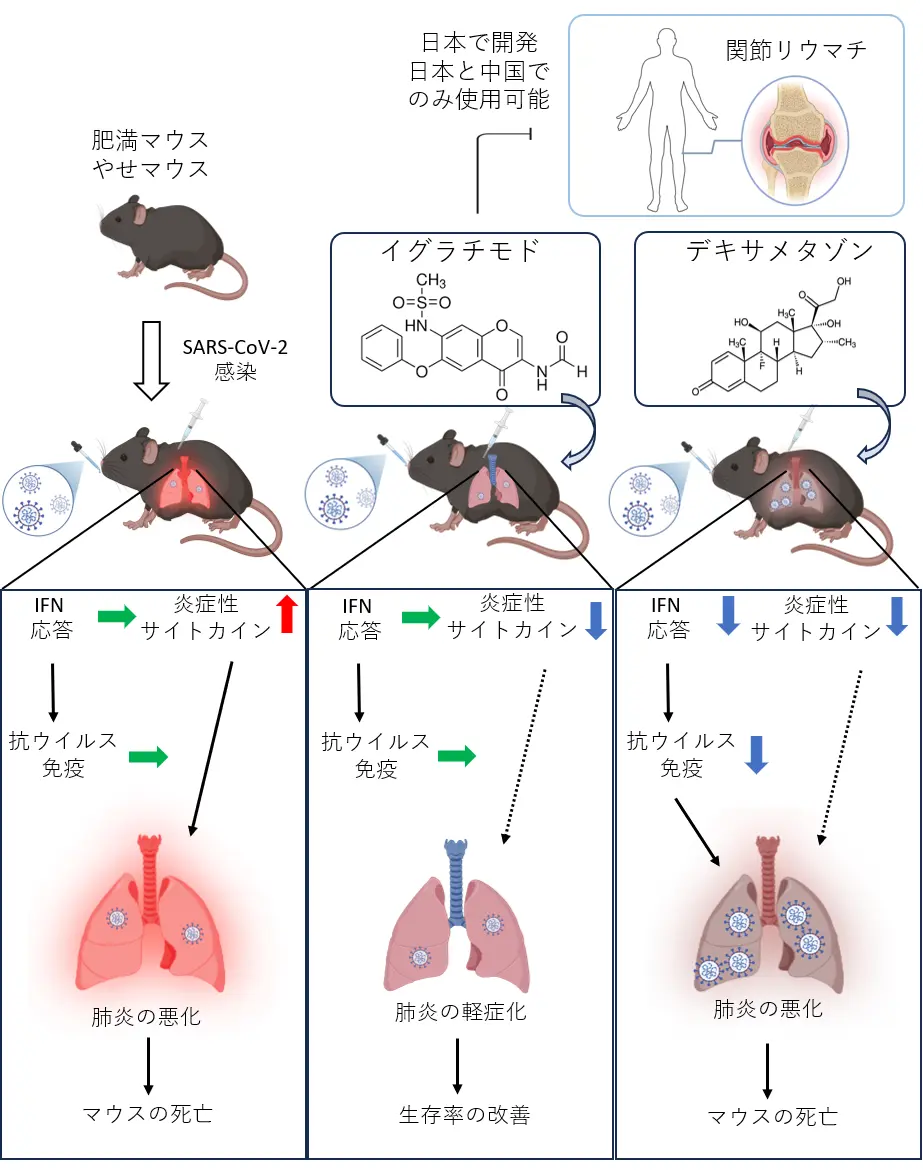
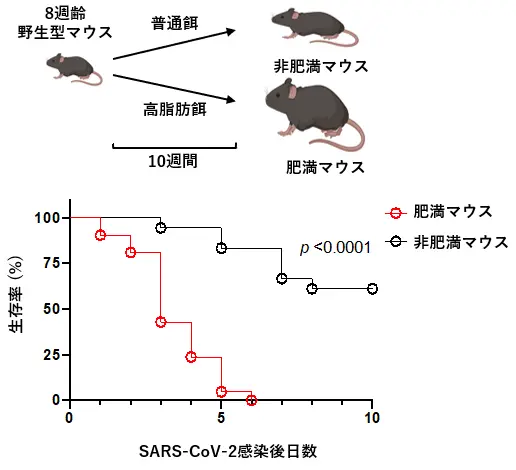
研究チームは、これまでに野生型マウスに高脂肪食を長期間与えることで肥満化させたマウスが、SARS-CoV-2感染後に早期死亡することを見出していました(図2)。SARS-CoV-2の感染から3日後の肥満マウスの肺では、広範な肺炎が確認され、SARS-CoV-2タンパクも多く検出されました。また、TNFα(腫瘍壊死因子α)[用語6]やIL-6などの炎症性サイトカインも著しく上昇しており、サイトカインストームの状態であると判断されました。これらのことから、本モデルは重症COVID-19におけるサイトカインストームを再現しており、薬剤の有効性を検討するために適していると考えました。
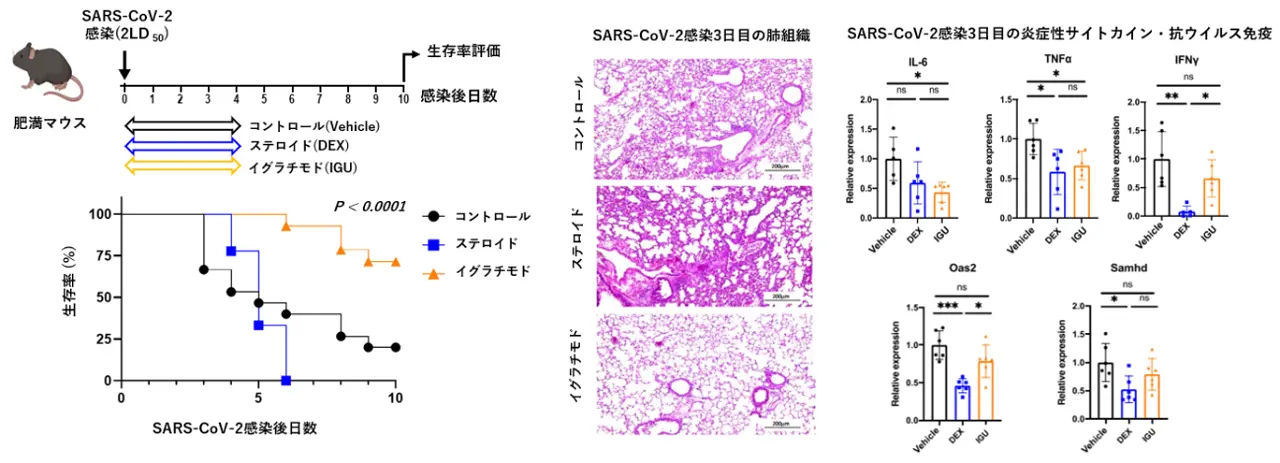
そこで、治療薬の候補としてイグラチモドおよび糖質ステロイド(デキサメタゾン)を選定し、SARS-CoV-2感染の1時間前から1日1回、4日目まで投与しました。その結果、糖質ステロイドを投与したマウスでは死亡がむしろ早まったのに対し、イグラチモドを投与したマウスでは生存率の改善が認められました。
感染3日目にマウスの肺組織を解析したところ、イグラチモド投与群では肺炎が軽症化しており、TNFαやIL-6の産生も抑制されていることが明らかとなりました。一方、ステロイドを投与したマウスではTNFαの産生は抑制されていたものの、抗ウイルス免疫に重要なインターフェロンγ(IFN-γ)[用語7]の発現が低下しており、加えてインターフェロンによって誘導されるOas2 / Samhd[用語8]の発現も減少していました。
つまり、イグラチモドは肺組織障害を抑制し、炎症を軽減することで生存率を改善した一方で、ステロイドは炎症を抑制する効果はあるものの、肺組織障害の抑制や生存率の改善にはつながらず、さらにウイルス排除に必要な免疫応答も抑制してしまうことが分かりました(図3)。
さらに研究チームは、SARS-CoV-2感染の翌日から治療を開始した場合でも、イグラチモドが生存期間の延長に寄与することを確認しました。また、野生型(非肥満)マウスに大量のウイルスを感染させたモデルにおいても、イグラチモドが肺炎の軽症化に有効であることを明らかにしました。
社会的インパクト
重症COVID-19への対応として、ワクチンや抗体療法、抗ウイルス薬などが開発されてきましたが、SARS-CoV-2は変異が早く、治療薬の効果が短期間で低下するという課題があります。
一方、重症化に伴うサイトカインストームへの治療は、パンデミック初期から行われており、糖質ステロイドやトシリズマブ、JAK阻害薬[用語9]など、リウマチ治療薬の転用が進められてきました。このように既存薬を別の疾患に応用する「ドラッグ・リポジショニング(Drug Repositioning)[用語10]」は、開発期間やコストの削減につながる有効な戦略です。
本研究で効果が示されたイグラチモドは、過剰な炎症を抑えつつ、ウイルス排除に必要な免疫応答は維持する可能性があり、安全性にも優れています。すでに関節リウマチ治療に用いられていることから、COVID-19への適応拡大が期待され、臨床現場に新たな選択肢をもたらす可能性があります。
今後の展開
イグラチモドは、日本で開発された重要な抗リウマチ薬ですが、現在使用されているのは日本と中国に限られており、世界的にはまだ十分に認知されていません。抗炎症作用と高い安全性を兼ね備えた薬剤であり、実際に関節リウマチ以外のリウマチ性疾患への転用も進められています。こうした背景から、将来的にはCOVID-19に対する有効性を検証するための臨床試験が実施され、適応拡大が図られることが期待されます。
付記
本研究は下記の団体からの支援を受けました。
国立研究開発法人日本医療研究開発機構(AMED): 研究代表者 保田晋助、課題番号JP21ek0410083、研究代表者 鈴木忠樹、研究番号JP22fk0108637、JP22wm0125008.
小林財団:研究代表者 細矢匡
参考文献
- [1]
- Hosoya T, Oba S, Komiya Y, Kawata D, Kamiya M, Iwai H, Miyamoto S, Kataoka M, Tobiume M, Kanno T, Ainai A, Sato H, Hirakawa A, Mitsui Y, Satoh T, Wakabayashi K, Yamada T, Otomo Y, Miyazaki Y, Hasegawa H, Suzuki T, Yasuda S. Apple-shaped obesity: A risky soil for cytokine-accelerated severity in COVID-19. Proc Natl Acad Sci U S A. 2023 May 30;120(22):e2300155120. doi: 10.1073/pnas.2300155120. Epub 2023 May 22. PMID: 37216518; PMCID: PMC10235975.
- [2]
- Kawata D, Iwai H, Oba S, Komiya Y, Koike R, Miyamoto S, Kanno T, Ainai A, Suzuki T, Hosoya T, Yasuda S. Diverse pro-inflammatory ability of mutated spike protein derived from variant strains of SARS-CoV-2. Cytokine. 2024 Jun;178:156592. doi: 10.1016/j.cyto.2024.156592. Epub 2024 Apr 3. PMID: 38574505.
- [3]
- Mimori T, Harigai M, Atsumi T, Fujii T, Kuwana M, Matsuno H, Momohara S, Takei S, Tamura N, Takasaki Y, Yamamoto K, Ikeuchi S, Kushimoto S, Koike T. Safety and effectiveness of iguratimod in patients with rheumatoid arthritis: Final report of a 52-week, multicenter postmarketing surveillance study. Mod Rheumatol. 2019 Mar;29(2):314-323. doi: 10.1080/14397595.2018.1460230. Epub 2018 Apr 27. PMID: 29611761.
用語説明
- [用語1]
- イグラチモド(Iguratimod):日本で開発された抗リウマチ薬。炎症を引き起こすNF-κBという転写因子の活性を抑えることで、炎症性サイトカインの産生を抑制する。副作用が少なく、安全性の高い薬剤として関節リウマチの治療に広く用いられている。
- [用語2]
- SARS-CoV-2:新型コロナウイルス(Severe Acute Respiratory Syndrome Coronavirus 2)の略称。COVID-19の原因ウイルスであり、肺炎や多臓器不全を引き起こすことがある。
- [用語3]
- サイトカインストーム:感染症などにより免疫系が過剰に活性化し、大量のサイトカイン(免疫細胞の情報伝達物質)が放出される状態。炎症が全身に波及し、臓器障害や死亡に至ることがある。
- [用語4]
- IL-6(インターロイキン6):炎症や免疫応答を調整するサイトカインのひとつ。COVID-19重症化にも関与しており、これを標的とした治療薬(トシリズマブなど)も使われている。
- [用語5]
- NF-κB(エヌエフカッパービー):炎症や免疫応答を制御する転写因子。活性化されると炎症性サイトカインの産生が促進される。
- [用語6]
- TNFα(腫瘍壊死因子α):強力な炎症性サイトカインで、感染や炎症時に免疫細胞から分泌される。過剰に産生されると組織損傷を引き起こす。
- [用語7]
- インターフェロンγ(IFN-γ):ウイルス感染時に重要な役割を果たすサイトカイン。感染細胞の排除や免疫応答の活性化に関与する。抗ウイルス免疫に不可欠。
- [用語8]
- Oas2 / Samhd:いずれもインターフェロンに応答して発現する抗ウイルス関連遺伝子。ウイルスの複製を抑える作用がある。
- [用語9]
- JAK阻害薬:ヤヌスキナーゼ(JAK)という酵素を阻害する薬剤。炎症や自己免疫疾患の治療に用いられ、COVID-19のサイトカインストームにも適応が広がっている。
- [用語10]
- ドラッグ・リポジショニング(Drug Repositioning):既存の医薬品を別の疾患治療に再利用する戦略。新薬開発に比べて、開発期間やコストが大幅に削減できる利点がある。
論文情報
- 掲載誌:
- European Journal of Pharmacology
- タイトル:
- Iguratimod, a Promising Therapeutic Agent for COVID-19 that Attenuates Excessive Inflammation in Mouse Models
- 著者:
- Seiya Oba, Tadashi Hosoya, Daisuke Kawata, Yoji Komiya, Hideyuki Iwai, Ryuji Koike, Sho Miyamoto, Takayuki Kanno, Akira Ainai, Tadaki Suzuki, Hideki Hasegawa, Shinsuke Yasuda
研究者プロフィール
保田 晋助 Shinsuke YASUDA
東京科学大学 大学院医歯学総合研究科 膠原病・リウマチ内科学分野 教授
研究分野:リウマチ性疾患、自己炎症性疾患、免疫学
細矢 匡 Tadashi HOSOYA
東京科学大学 大学院医歯学総合研究科 膠原病・リウマチ内科学分野 准教授
研究分野:リウマチ性疾患、自己炎症性疾患、免疫学
大庭 聖也 Seiya OBA
東京科学大学 大学院医歯学総合研究科 膠原病・リウマチ内科学分野 大学院生(発表時)
研究分野:リウマチ性疾患、免疫学
