ポイント
- 赤血球の成熟過程でミトコンドリアが除去される仕組みを解明しました。
- 細胞膜タンパク質も同じ分解システム(GOMED)によって処理され、その分子をどのように認識するかを明らかにしました。
- GOMEDは神経変性疾患を含むさまざまな病気に関与しており、今回の発見は幅広い疾患研究の新たな突破口となります。
概要
ゴルジ体膜関連分解(GOMED)[用語1]は、細胞が不要なタンパク質や構成要素を処理するための新しい分解システムです。東京科学大学(Science Tokyo)総合研究院 高等研究府 病態細胞生物学研究室の清水重臣特別教授と仁部洋一プロジェクト助教らの研究チームは、AMED革新的先端研究開発支援事業(AMED-CREST)「ゴルジプロテオスタシスの理解と疾患への応用」などの支援を受けて、東京科学大学 消化器内科、広島大学、Monash大学との共同研究により、GOMEDが、どのように基質を選択して分解するのかを明らかにしました。
本解析の結果、OPTNが基質に結合したK33ユビキチン[用語2]鎖を認識し、GOMEDによる分解へ導く仕組みを解明しました。この機構は、細胞膜タンパク質の量的・質的調節や、赤血球におけるミトコンドリア除去に機能しています。GOMEDは、生体内で神経変性疾患をはじめとする多様な疾患に関与することが知られており、今回の基質認識機構の発見は、これらの疾患の新たな治療標的につながると期待されます。
本成果は、国際科学誌Nature Communicationsに、2025年10月20日18時(日本時間)にオンライン版で発表されました。
背景
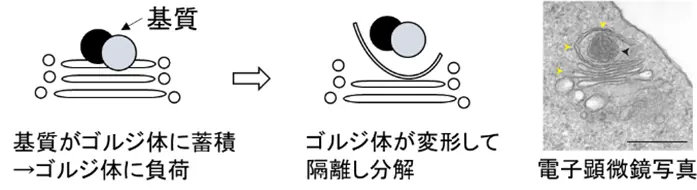
細胞内では、不要になったタンパク質や小器官を分解して恒常性を維持する仕組みが備わっています。その代表がオートファジーです。一方で、ゴルジ体膜関連分解(Golgi-membrane-associated degradation; GOMED)は、ゴルジ体膜を利用して不要な構成要素を分解する、もう一つの仕組みです(Nature 2009)。GOMEDは進化的に保存されたシステムで、私たちの体を構成するすべての細胞で機能しています。また、GOMEDの機能異常は、神経変性疾患をはじめとするさまざまな疾患の原因となる可能性が報告されています。
しかし、GOMEDがどのように基質を認識して分解するのかは未解明であり、今回、世界で初めてその認識機構が明らかになりました。
研究成果
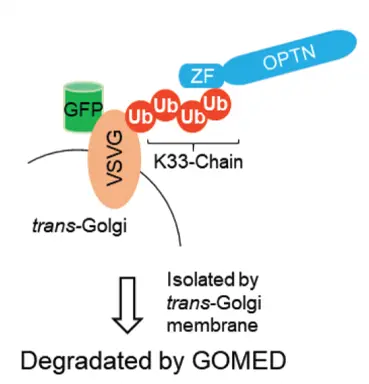
細胞内でタンパク質を分解する際、その基質を認識する分子として、これまでに5種類のタンパク質が知られていました。私たちは、この5種類のいずれかがGOMEDに関与すると考え解析を行った結果、オプチニューリン(OPTN)が重要であることを見出しました。さらに、OPTNが何を目印にして基質を認識しているのかを検討したところ、ユビキチン分子(Ub)が形成する「K33鎖」が目印として機能していることを突き止めました。
この「基質―K33Ub-OPTN-GOMED分解」という機構は、多様なの細胞膜タンパク質の分解だけでなく、赤血球の最終分化過程におけるミトコンドリア除去にも機能していることが明らかになりました。
なお、K48Ubはプロテアソームによるタンパク質分解に、K63Ubや直鎖Ubはオートファジーによる分解に重要であることが知られています。これに対し、K33Ubを利用したGOMEDによる分解は、新たに「第三のタンパク質分解系」と位置付けられます。
社会的インパクト
今回の発見は、細胞が不要となった細胞内構成物を分解する新しい仕組みを示すものであり、神経変性疾患をはじめとする多様な疾患の理解に新たな視点をもたらします。さらに、GOMEDを応用した研究は、新たなコンセプトに基づく疾患治療薬の開発へとつながることが期待されます。
今後の展開
本研究で明らかになったGOMEDの仕組みは、神経変性疾患や炎症性疾患の克服につながる可能性があります。今後は、多様な疾患の病態においてGOMEDの基質認識機構がどのように関与しているのかを解明することで、新たな治療戦略の開発へと発展させていくことが期待されます。
付記
本研究は、日本学術振興会(JSPS)(23H05480, 20H00467, 24K11166, 20K07353, 22K07345, 23K05748, 19K16119, 22H04639, 23H04773, 24H01887)、AMED-CREST (JP23gm1410012), AMED (JP21wm0525028, JP24ama221130, JP24ek0109770)の支援を受けて実施されました。
参考文献
- [1]
- Nishida Y, Arakawa S, Fujitani K, Yamaguchi H, Mizuta T, Kanaseki T, Komatsu M, Otsu K, Tsujimoto Y, Shimizu S. Discovery of Atg5/Atg7-independent alternative macroautophagy. Nature. 2009 Oct 1;461(7264):654-8.
- [2]
- Yamaguchi H, Honda S, Torii S, Shimizu K, Katoh K, Miyake K, Miyake N, Fujikake N, Sakurai HT, Arakawa S, Shimizu S. Wipi3 is essential for alternative autophagy and its loss causes neurodegeneration. Nat Commun. 2020 Oct 20;11(1):5311.
- [3]
- Honda S, Arakawa S, Nishida Y, Yamaguchi H, Ishii E, Shimizu S. Ulk1-mediated Atg5-independent macroautophagy mediates elimination of mitochondria from embryonic reticulocytes. Nat Commun. 2014 Jun 4;5:4004.
- [4]
- Torii S, Yamaguchi H, Nakanishi A, Arakawa S, Honda S, Moriwaki K, Nakano H, Shimizu S. Identification of a phosphorylation site on Ulk1 required for genotoxic stress-induced alternative autophagy. Nat Commun. 2020 Apr 9;11(1):1754.
- [5]
- Yamaguchi H, Arakawa S, Kanaseki T, Miyatsuka T, Fujitani Y, Watada H, Tsujimoto Y, Shimizu S. Golgi membrane‐associated degradation pathway in yeast and mammals. EMBO J. 2016 Sep 15;35(18):1991-2007. doi: 10.15252/embj.201593191. Epub 2016 Aug 10.
用語説明
- [用語1]
- ゴルジ体関連分解(Golgi-membrane-associated degradation; GOMED):GOMEDは、ゴルジ体膜を利用する新しいタンパク質分解機構であり、私たちの体を構成するすべての細胞に存在しています。GOMEDは、サイトカインなどゴルジ体を経由して細胞外に分泌される分子を分解し、オートファジーなどとは分解するタンパク質が大きく異なるため、生体内での役割も異なります。GOMEDの機能が変調すると、生体にさまざまな不具合を引き起こす可能性があります。
- [用語2]
- ユビキチン:ユビキチン修飾系は、翻訳後修飾の一つであり、タンパク質分解にとどまらず、シグナル伝達など多様な役割を担うことが明らかになっています。ユビキチン分子内には7個のリジン(K6、K11、K27、K29、K33、K48、K63)とN末端のメチオニン(M1)が存在し、これらを介して8種類のユビキチン間結合が形成されます。細胞内には、このように多様な構造をもつポリユビキチン鎖が存在することが知られています。
論文情報
- 掲載誌:
- Nature Communications
- タイトル:
- Optineurin is an adaptor protein for ubiquitinated substrates in Golgi membrane-associated degradation
- 著者:
- Yoichi Nibe-Shirakihara, Shinya Honda, Satoko Arakawa, Satoru Torii, Hajime Tajima Sakurai, Hirofumi Yamaguchi, Shigeru Oshima, Ryuichi Okamoto, Michael Lazarou, Hideshi Kawakami, and Shigeomi Shimizu
研究者プロフィール
仁部 洋一 Yoichi Nibe
東京科学大学 総合研究院 高等研究府
病態細胞生物学研究室 プロジェクト助教
研究分野:消化器病態学、ユビキチン、細胞生物学
清水 重臣 Shigeomi Shimizu
東京科学大学 総合研究院 高等研究府
病態細胞生物学研究室 特別教授
研究分野:オルガネラバイオロジー、細胞生物学
関連リンク
東京科学大学 総合研究院 高等研究府 病態細胞生物学研究室
プロジェクト助教 仁部 洋一
- Tel
- 03-5280-8080
- Fax
- 03-5280-8079
- ynibe.pcb@tmd.ac.jp
更新履歴
- 2026年1月16日 ページ内の誤記を修正しました。