ポイント
- 筋萎縮性側索硬化症(ALS)など神経変性疾患に関わる異常なタンパク質合成を、翻訳開始因子eIF1AとeIF5Bが制御することを発見
- 異常なタンパク質合成を試験管内で再現し、eIF1AとeIF5Bの作用機序を詳細に解明
- 異常なタンパク質合成の制御技術の開発により、神経変性疾患の新たな治療戦略の展開に期待
概要
東京科学大学(Science Tokyo)生命理工学院 生命理工学系の伊藤隼人大学院生(研究当時)、同大学 総合研究院 細胞制御工学研究センターの田口英樹教授、兵庫県立大学 大学院工学研究科の今高寛晃教授、町田幸大准教授、近畿大学 医学部 内科学教室(脳神経内科部門)の永井義隆主任教授らの共同研究チームは、神経変性疾患である筋萎縮性側索硬化症(ALS)や前頭側頭型認知症(FTD)に関わるC9orf72遺伝子において、RAN翻訳[用語1]と呼ばれる異常なタンパク質合成がどのように制御されるかを解明しました。
本研究チームは、兵庫県立大学のグループが確立した「ヒト因子由来再構成型翻訳システム(human PURE)」を用いた試験管内解析と、ヒト細胞を用いた実験を組み合わせることで、翻訳開始因子[用語2]eIF1AとeIF5BがRAN翻訳の開始効率を抑制する因子であることを発見しました。さらに、細胞がストレスにさらされた際に活性化される「統合的ストレス応答(ISR)[用語3]」において、eIF1AがRAN翻訳の促進に関与することを突き止めました。
これにより、ALSやFTDの病態形成に関わるRAN翻訳が、通常の翻訳開始因子によって調節されていることが明らかとなりました。この知見は今後、RAN翻訳の制御技術の開発につながることが期待されます。
本成果は、10月10日付(現地時間)の「Nucleic Acids Research」誌に掲載されました。
背景
筋萎縮性側索硬化症(ALS)は運動神経が変性し、全身の筋肉が急速に衰えていく難病指定されている神経変性疾患です。前頭側頭型認知症(FTD)は、アルツハイマー型認知症やレビー小体型認知症に次いで多い認知症で言語障害などを引き起こす神経変性疾患として知られています。これらの疾患で高頻度に見られる遺伝変異として、C9orf72遺伝子内に存在するGGGGCCという6つの塩基からなる配列の異常な繰り返しが検出されていました。この繰り返し(リピート)配列を持つRNAでは、教科書的な翻訳開始機構に依らないRAN翻訳(図1)と呼ばれる異常なタンパク質合成が発生することが知られています。このRAN翻訳で合成されるタンパク質は細胞毒性を持っており、神経細胞の機能障害や細胞死を誘発するため病態との関連が示唆されています。RAN翻訳について分子機構の解析は行われているものの、その詳しいメカニズムや制御因子についてはよく分かっていませんでした。
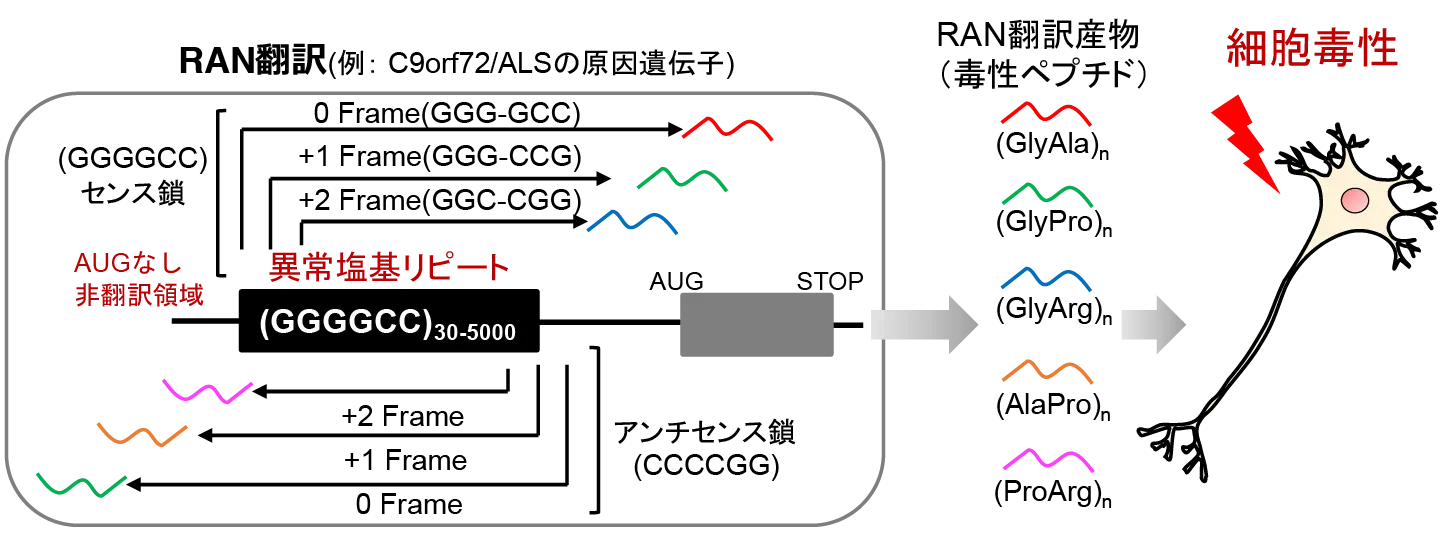
タンパク質が合成されないと考えられていた遺伝子領域から、さまざまなタンパク質が作られ、それらが細胞毒性を示す。
研究成果
今回本研究グループは、以前に同グループが確立した試験管内でRAN翻訳を再構成するボトムアップ型の系[参考文献1]を用いて分子機構解析を行い、翻訳開始因子eIF1AとeIF5BがRAN翻訳を制御する因子だと同定しました。具体的には、特定の翻訳因子を欠損させた無細胞系を個別に調製して、RAN翻訳への影響を解析したところ、eIF1AもしくはeIF5Bを欠損させた場合にRAN翻訳が大きく促進されることが明らかになりました。またeIF1AとeIF5Bの欠損による促進効果は、同時に欠損させた場合にさらに強力になったため、それぞれが異なる作用機序によってRAN翻訳を制御していることも明らかになりました。このeIF1AとeIF5Bの効果は、培養細胞を用いた実験系でも再現されました。また同グループは、細胞がストレスにさらされた際にRAN翻訳が選択的に促進される現象に、eIF1Aが大きく関与することも見出しました(図2)。
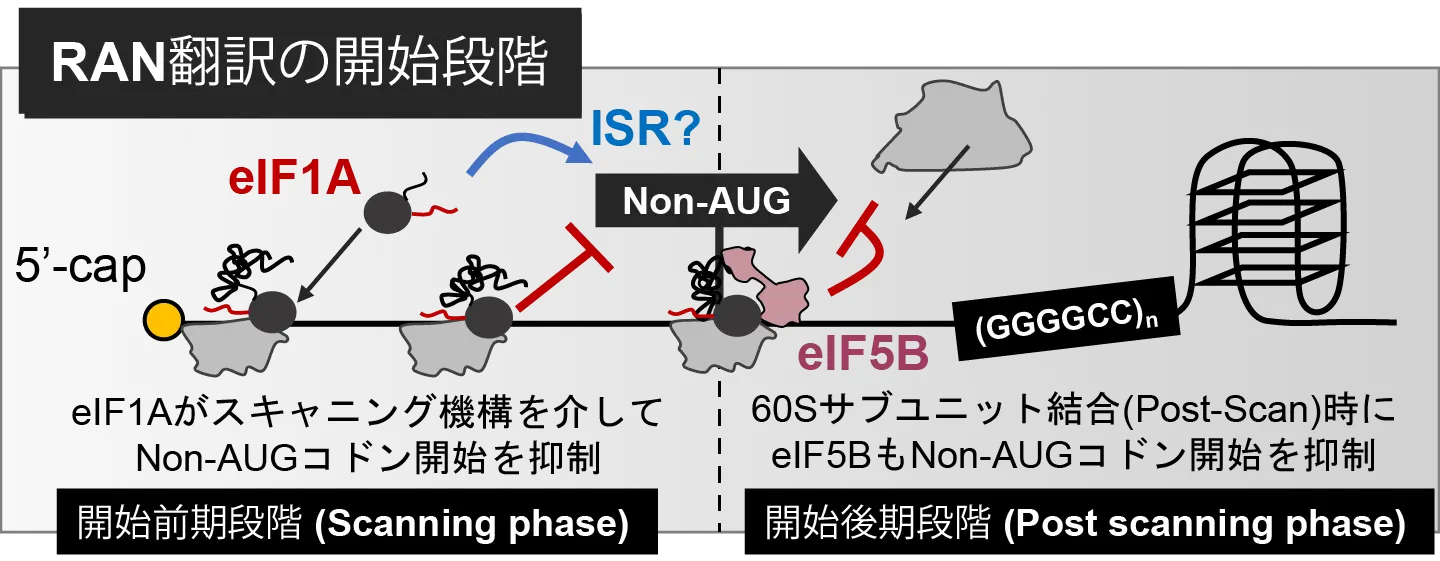
eIF1AとeIF5BはどちらもAUGではない翻訳開始コドン「Non-AUGコドン」を見つけて抑制するが、それぞれが働くタイミングが異なる。
社会的インパクト
本研究は、ALSやFTDといった現在有効な治療法が限られている神経変性疾患の根本的な病態機構に迫る成果です。これまで「曖昧な分子機構」とされてきたリピート配列由来の異常翻訳(RAN翻訳)の分子機構を、再構成型無細胞翻訳系(human PURE)を用いて詳細に明らかにしたことは、基礎研究からの病態解明という点で大きな意義を持ちます。この知見は、患者に蓄積する毒性タンパク質(ジペプチドリピート)の産生を抑える新しい治療戦略の基盤となりうるものであり、創薬標的として翻訳因子を利用する可能性を提示します。
またhuman PUREによる翻訳の分子機構解析のアプローチは近年見出されつつある、ほかの非典型的なタンパク質合成の分子機構解析にも応用可能であり、基礎生物学の観点からも広い応用性を持つことが期待されます。
今後の展開
今回の研究から、ALSやFTDの病態に深く関わるRAN翻訳が翻訳開始因子によって制御されていることが明らかとなりました。今後は、この発見をさらに発展させることで、より具体的な治療戦略へとつなげることが期待されます。例えば、これらの因子の働きを調節する化合物や核酸医薬を開発すれば、RAN翻訳を抑制する新規治療薬につながることが予想されます。さらに、統合的ストレス応答(ISR)とRAN翻訳の関連性をより詳しく解析することで、神経変性疾患におけるストレス依存的な翻訳制御の仕組みを明らかにできると期待されます。加えて、C9orf72遺伝子に限らず、他のリピート配列で発生するRAN翻訳においても本研究と同様の制御が存在すると予想され、今回得られた知見は脊髄小脳失調症や脆弱X関連症候群といった幅広い神経変性疾患への応用が期待されます。
付記
文部科学省 科学研究費助成事業(JP26116002, JP18H03984, JP21H04763, JP20H05925[田口英樹])、AMED-CREST(JP21gm1410008[田口英樹])、JST大学フェローシップ創設事業(JP-MJFS2112; 伊藤隼人)、日本学術振興会 科学研究費助成事業(24KJ1067[伊藤隼人])、上原記念生命科学財団(田口英樹)、三菱財団(田口英樹)、第一三共株式会社(田口英樹)の支援を受けて行われました。
参考文献
- [1]
- Ito, H. et al. Reconstitution of C9orf72 GGGGCC repeat-associated non-AUG translation with purified human translation factors. Sci Rep 13, 22826 (2023). DOI:10.1038/s41598-023-50188-z
用語説明
- [用語1]
- RAN翻訳:メッセンジャーRNAに転写された遺伝情報をもとに、タンパク質を合成する過程を「翻訳」という。通常の翻訳機構ではAUGの3塩基で規定される開始コドンと呼ばれる部位から翻訳開始するが、RAN翻訳は異常に伸長した塩基リピートに依存してAUG以外から翻訳が開始するので、Repeat-associated Non-AUG翻訳、略してRAN翻訳と名付けられた。
- [用語2]
- 翻訳開始因子:翻訳開始因子は翻訳開始を制御するタンパク質の総称である。真核生物の翻訳開始は10以上もの翻訳開始因子によって制御されている。これらの因子が緻密に連携することで、適切な翻訳開始部位での翻訳開始が制御される。
- [用語3]
- 統合的ストレス応答:細胞が特定のストレスにさらされたときに働く防御システムのこと。統合的ストレス応答(Integrated Stress Response: ISR)が活性化されると、通常のタンパク質合成は一時的に抑制されるが、その一方でストレスへの適応に必要なシャペロンなど特定のタンパク質の合成は促進される。ISRはRAN翻訳によっても活性化されるので、そのISRによってRAN翻訳がさらに促進されるフィードフォワードループが示唆されている。
論文情報
- 掲載誌:
- Nucleic Acids Research
- タイトル:
- Canonical translation factors eIF1A and eIF5B modulate the initiation step of repeat-associated non-AUG translation.
- 著者:
- Hayato Ito , Kodai Machida , Yuzo Fujino , Mayuka Hasumi , Soyoka Sakamoto ,Yoshitaka Nagai , Hiroaki Imataka , Hideki Taguchi
- DOI:
- 10.1093/nar/gkaf994
研究者プロフィール
伊藤 隼人 Hayato Ito
東京科学大学 生命理工学院 生命理工学系 大学院生(研究当時)
研究分野: RNA生物学、分子生物学
田口 英樹 Hideki Taguchi
東京科学大学 総合研究院 細胞制御工学研究センター 教授
研究分野:蛋白質科学、生化学
今高 寛晃 Hiroaki Imataka
兵庫県立大学 大学院 工学研究科 応用化学専攻 教授
研究分野:ライフサイエンス、システムゲノム科学、合成生物学
町田 幸大 Kodai Machida
兵庫県立大学 大学院 工学研究科 応用化学専攻 准教授
研究分野:ライフサイエンス、システムゲノム科学、合成生物学
永井 義隆 Yoshitaka Nagai
近畿大学 医学部 内科学教室(脳神経内科部門) 主任教授
研究分野:脳神経内科学、神経科学、分子生物学
関連リンク
東京科学大学 総務企画部 広報課
- media@adm.isct.ac.jp
- Tel
- 03-5734-2975
- FAX
- 03-5734-3661