ポイント
- 水素貯蔵デバイスの鍵となる高性能なヒドリドイオン(H–)伝導性固体電解質を新たに開発。
- 開発した固体電解質を用いた全固体電池により、水素貯蔵材料Mg/MgH2の可逆的な水素吸蔵・放出を大幅に低温化。
- Mg–H2電池により、高容量・低温・可逆的に水素ガスの吸蔵・放出を実証。
- 安全で効率的な水素エネルギー貯蔵デバイスの実用化の可能性を提示。
概要
東京科学大学(Science Tokyo) 総合研究院 全固体電池研究センターの廣瀬隆研究員(研究当時)、松井直喜助教、菅野了次特命教授らの研究チームは、理想的なエネルギーキャリアである水素を、安全、高容量で貯蔵する技術を開発しました。
固体材料への水素貯蔵は、安全で、体積エネルギー密度が高いことから注目されています。特にマグネシウム(Mg)[用語1]は、安価で重量水素密度(7.6 wt.%)が高いために、有望な水素貯蔵材料とされますが、水素吸蔵・放出に300℃以上の高温が必要な点が問題でした。一方、従来の水素貯蔵デバイスの水溶液系電解液に代わる固体電解質[用語2]の開発が進んでいますが、電気化学安定性とイオン伝導性を両立する材料は見つかっていませんでした。
本研究グループは、新規に開発したヒドリドイオン[用語3]伝導体Ba0.5Ca0.35Na0.15H1.85を固体電解質に用いることで、ヒドリドイオン駆動型の水素貯蔵デバイスを新たに開発しました。このヒドリドイオン伝導体は、逆α-AgI型[用語4]の結晶構造を持ち、高いヒドリドイオン伝導性と電気化学安定性を兼ね備えていることが分かりました。この固体電解質を用いた全固体電池は、90℃という低温で、Mg電極の理論水素貯蔵量に相当する高容量の水素を可逆的に吸蔵・放出することを示しました。さらに、水素ガスを吸蔵・放出するMg–H2電池[用語5]を開発し、理論容量の水素ガスの可逆的な吸蔵・放出を実証しました。
本技術は、Mg金属への水素貯蔵を従来の熱駆動型のアプローチと比べて大幅に低温化することにより、安全で効率的な水素エネルギー貯蔵への道を拓くものです。
本研究成果は、2025年9月18日(米国東部時間)に米国科学誌「Science」に掲載されました。
背景
水素は軽量であり、資源量も豊富であることから、理想的なエネルギーキャリアとして注目されていますが、その貯蔵・運搬には安全性の課題があります。固体材料への水素貯蔵は安全な手段として期待されていますが、代表的な水素吸蔵合金であるLaNi5は貯蔵容量が低く(1.4 wt.%)、実用上の限界がありました。一方で、MgH2は貯蔵容量(7.6 wt.%)が高く、理想的な候補材料とされるものの、反応が300℃以上の高温で進行するため、利用範囲が制限されてきました。
一方で、電気的に水素を固体材料に出し入れする反応は高効率な手法であり、水溶液系の電解液中のプロトン(H+)を用いた電気化学的貯蔵がNi-MH電池などで実用化されています。しかし、MgH2のような高容量材料では電極が溶解するため、水溶液系の電解液が利用できないという問題があり、その解決が急務とされていました。近年、水溶液系電解液に代わる、H–伝導性の固体電解質の開発が進んでおり、室温付近で高いイオン伝導性を示す材料が相次いで報告されました。しかし電気化学安定性とイオン伝導性を兼ね備えた、実用に耐える材料は見つかっていませんでした。
研究成果
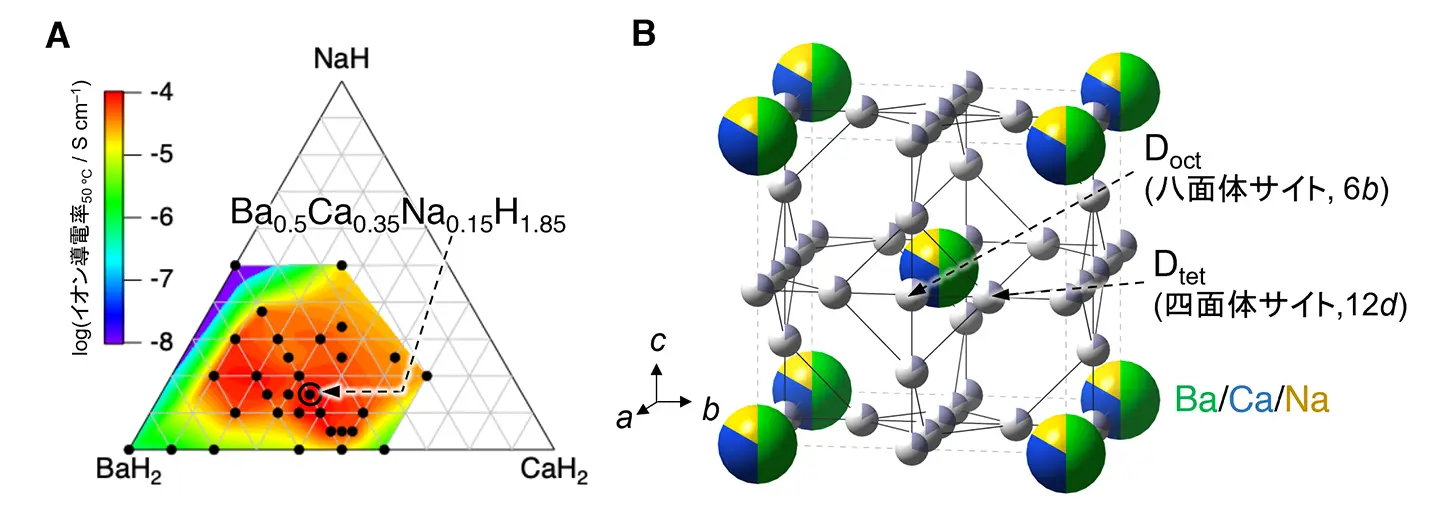
本研究では、高い電気化学安定性とイオン伝導性を併せ持つ固体電解質の開発を目指して、サイズと価数が異なる金属であるBaH2とCaH2、NaHを混ぜることで、新たなヒドリドイオン伝導体を探索しました。広範な組成の材料探索を通じた最適化により、組成式Ba0.5Ca0.35Na0.15H1.85が、超イオン伝導体であるα-AgIと同様の構造を形成することを発見しました。この新材料は、25℃で2.1×10–5 S cm–1という高いヒドリドイオン伝導性を示しました(図1A)。
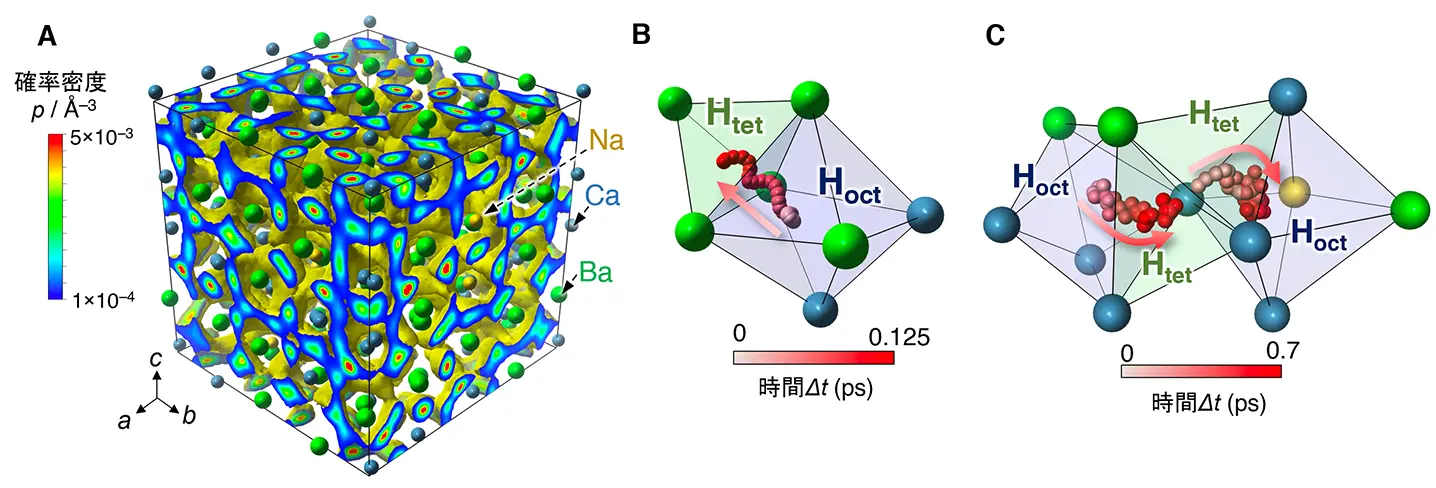
このヒドリドイオン伝導体について、高強度陽子加速器施設J-PARCでの中性子回折実験[用語6]により、重水素置換体[用語7]の結晶構造を解析した結果、Ba、Ca、Naがランダムに体心立方格子位置を占有し、重水素が四面体位置(12d)と八面体位置(6b)に無秩序に分布した構造を持つことが判明しました(図1B)。また、固体NMR測定[用語8]により、ヒドリドイオン輸送のダイナミクスを捉えることに成功しました。さらに、東京科学大学のTSUBAME4.0スーパーコンピュータ[用語9]を用いて、メッセージ伝播ニューラルネットワーク(MPNN)ポテンシャル[用語10]という高精度かつ比較的大規模な分子動力学(MD)シミュレーションを行い、ヒドリドイオンが四面体–八面体サイト間を協調的に移動し、三次元の拡散経路を持つことを明らかにしました(図2A-C)。
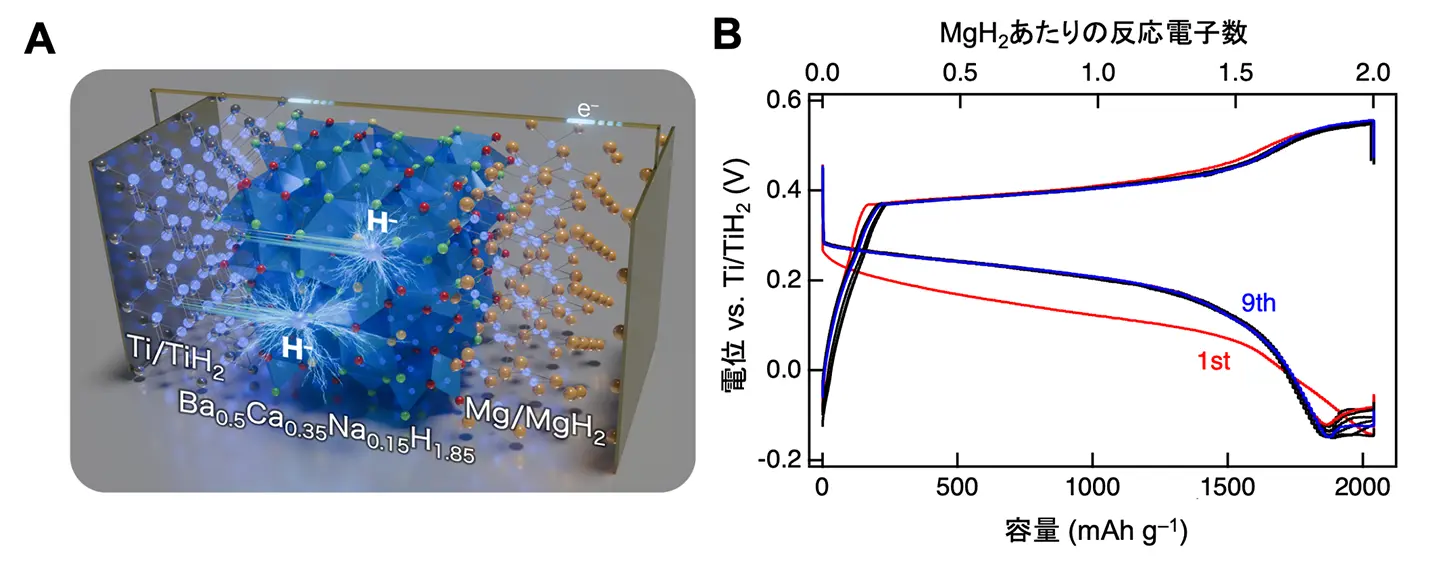
開発した固体電解質の電気化学安定性を評価したところ、–0.13 ~ +0.53 V vs. Ti/TiH2という、既報のヒドリドイオン伝導体では報告例のない広い電位窓[用語11]を持つことが分かりました。そこでこの電解質を用いて、金属の水素化・脱水素化反応を利用した全固体ヒドリド電池を構築しました。まず、チタンと水素化チタン電極を用いたTi–TiH2対称セルでは、60℃において、10サイクル後に理論容量の84%以上(900 mAh g–1以上)を維持した充放電が可能であり、これまでに報告例のない優れたヒドリドイオンの脱挿入反応を実証しました。次に、固体電解質の電位窓の範囲で動作可能な電極材料を第一原理計算により絞り込み、MgH2電極が理論的に動作可能であると予測しました。その上で、実際にTi–MgH2電池(図3A)を動作させたところ、90℃において1,800 mAh g–1(理論容量の88%)という高容量の充放電を達成しました(図3B)。この結果から、電気化学安定性に優れた固体電解質を用いた電気化学反応によって、金属電極にヒドリドイオンを可逆的に出し入れ可能であることが確認できました。
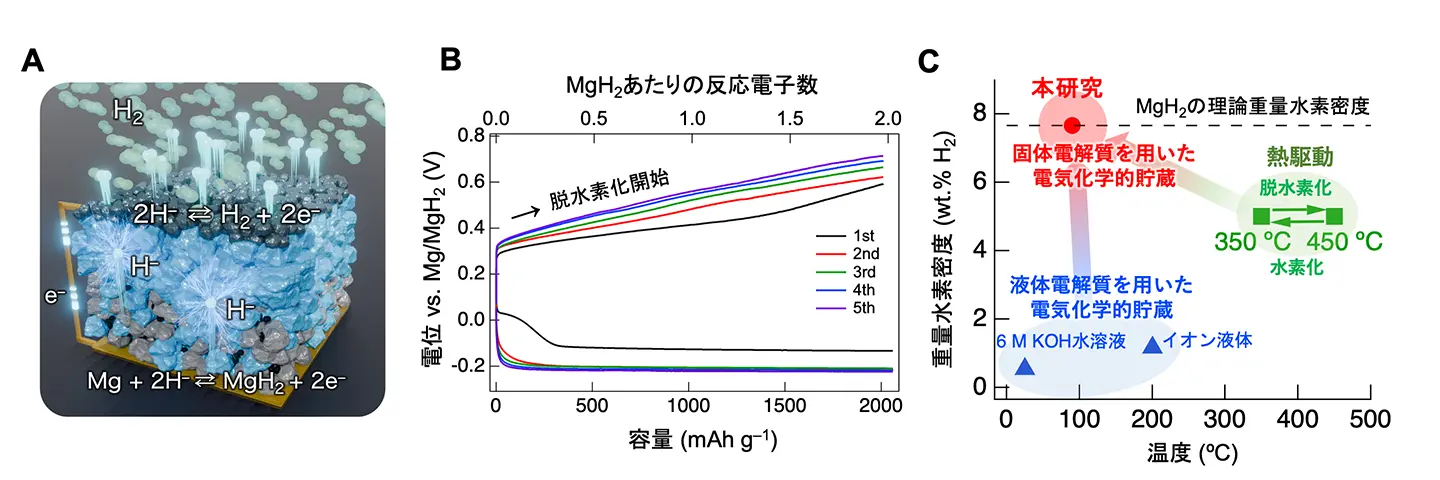
さらに水素貯蔵デバイスとして、作用極の電極活物質[用語12]として水素ガスを用いて、金属Mg電極から固体電解質を通じて水素ガスを吸蔵・放出するMg–H2電池を開発しました(図4A)。このMg–H2電池は、90℃において、Mg/MgH2の理論容量(2,030 mAh g–1)での可逆的な水素吸蔵・放出を実行できました(図4B)。これは、金属Mgの理論的な水素貯蔵量7.6 wt.%に相当します。これにより、これまで300℃以上が必要とされたMgの水素吸蔵・放出反応を大幅に低温化することに成功しました(図4C)。
社会的インパクト
水素エネルギー社会の実現には、安全で効率的な水素貯蔵技術が不可欠です。本研究で開発した、ヒドリドイオン伝導性固体電解質を用いた電気化学的な水素貯蔵技術は、従来の熱駆動型のアプローチよりも大幅に低い、90℃という低温での高容量(7.6 wt.%)の水素貯蔵を可能にしました。これは、再生可能エネルギーの貯蔵や燃料電池車への水素供給など、さまざまな用途での実用化が期待できる温度領域です。さらに、電気化学的な制御により、水素の吸蔵・放出を精密に制御できるため、水素と電気エネルギーの相互変換デバイスとしても機能します。これにより、再生可能エネルギーの変動を吸収し、必要に応じて水素または電気として取り出すことが可能となり、エネルギーの効率的な利用に貢献できます。
今後の展開
本研究により、ヒドリドイオン伝導性固体電解質を用いた新しい水素貯蔵技術の可能性が示されました。今後は、固体電解質のさらなる高性能化が課題であり、本研究で確立したデバイス評価技術を用いて、より低温で動作し、より高容量の水素貯蔵材料の開発が期待されます。
付記
本研究は、JSPS科学研究費助成事業 基盤研究(S)17H06145、新学術領域研究(研究領域提案型)19H05793、若手研究22K14472、特別研究員奨励費23KJ0933、基盤研究(S)24H00042、学術変革領域研究(A)25H01964の助成を受けたものであり、成果の一部は高エネルギー加速器研究機構 物質構造科学研究所 中性子共同利用実験課題(2019S06)および東京科学大学のTSUBAME4.0スーパーコンピュータの利用により得られたものです。
用語説明
- [用語1]
- マグネシウム(Mg):水素貯蔵材料としてのマグネシウム(Mg)は、理論水素貯蔵容量(約7.6 wt.%)の高さや資源の豊富さから注目されている。一方で、水素の吸蔵・放出に300~400ºCを要することが実用化の障壁となっている。そのため、Mg2Niのように合金化することで、水素吸蔵・放出温度を低下させる試みがなされているが、理論水素貯蔵容量が低くなるというトレードオフの関係がある。
- [用語2]
- 固体電解質:固体電解質はイオン伝導性を示すが、電子伝導性は抑制されており、全固体電池や燃料電池、センサー等に欠かせない固体材料である。固体電解質を2つの電極(正極と負極)で挟んだ電池が全固体電池である。
- [用語3]
- ヒドリドイオン(H–):水素は、カチオンとアニオンの2通りのイオン状態をとることができ、前者はプロトン、後者はヒドリドイオンと呼ばれる。ヒドリドイオンは、高い還元性、小さい電荷密度、固体中における高い拡散性といった、他のイオンにはないユニークな特徴を有する。
- [用語4]
- 逆α-AgI型:銀イオン伝導体であるヨウ化銀(AgI)は、147℃でβ相からα相へ相転移することで超イオン伝導特性を示す。α-AgIの結晶構造中では、bccパッキングをしたヨウ化物イオン副格子中を銀イオンが拡散する。一方で、本研究で見出されたBa5Ca0.35Na0.15H1.85は、α-AgIの銀イオン→ヒドリドイオン、ヨウ化物イオン→Ba/Ca/Naのカチオンというように、カチオンとアニオンが占有するサイトを逆転した構造をとる。このような構造は「逆構造」と呼ばれ、Ba0.5Ca0.35Na0.15H1.85は逆α-AgI構造を示す。
- [用語5]
- Mg–H2電池:片側の電極に水素貯蔵電極としてMgを、もう片側の電極に水素透過電極を配置して、2つの電極間に固体電解質を挟んだ電池である。電気化学的なアプローチにより、熱駆動型のアプローチと比較して低温での水素貯蔵が可能となる。また、電気化学的に水素を吸蔵する際には、電池のようにエネルギーを取り出すこともできる。
- [用語6]
- 中性子回折実験:中性子を物質に照射して得られる回折パターンを解析して、結晶構造を詳細に調べる実験手法。X線が電子数に依存して散乱するのとは異なり、中性子は原子核に散乱されるため、電子数の少ない軽元素や同位体の区別に強みを持つ。例えば、リチウムイオンとヒドリドイオンはいずれも電子数が少なく、X線では構造決定が困難だが、中性子回折ではその位置を高精度で決定できるため、ヒドリドイオンを含む材料研究ではよく用いられる。
- [用語7]
- 重水素置換体:水素(1H)の代わりに重水素(2D)を導入した化合物を指す。重水素は化学的性質が水素とほぼ同じであるが、中性子に対する散乱特性が大きく異なるため、回折実験での信号検出や解析を容易にする。特にヒドリドイオンの位置決定では、通常の水素を重水素に置換することでバックグラウンドを低減し、構造解析を高精度に行える。そのため、中性子回折実験には重水素置換材料がしばしば用いられる。
- [用語8]
- 固体NMR測定:固体試料を対象とした核磁気共鳴(NMR)測定であり、原子核周囲の電子環境や動きを反映するシグナルを得ることができる。中性子回折実験では得にくい「局所環境」に関する情報を与える点に特徴がある。さらに、得られるスペクトルの半値幅(ライン幅)の変化を解析することで、イオンの拡散挙動を調べることもでき、可動イオンの移動度評価にしばしば用いられる。
- [用語9]
- TSUBAME4.0スーパーコンピュータ:東京科学大学が運用する大規模計算機で、強力なGPUを備えており、高い計算性能を有する。通常のPCでは計算できない、数百個程度の原子を含む大規模第一原理計算や長時間スケールの分子動力学シミュレーションを実行できる。固体電解質などの材料研究において、メカニズム解明から特性予測まで幅広く活用される。
- [用語10]
- メッセージ伝播ニューラルネットワーク(MPNN)ポテンシャル:結晶構造をグラフとして表現し、原子間の相互作用を「メッセージ」として伝達しながら物性などを学習・予測する機械学習モデル。これをポテンシャル関数として利用すると、従来の第一原理計算と同等の精度を保ちながら計算コストを大幅に削減できる。固体電解質のシミュレーションにおいて、イオン拡散などの長時間スケール解析を可能にする、比較的新しい手法である。
- [用語11]
- 電位窓:電解質が分解せずに安定して存在できる電位範囲を指す。この電位範囲の上限を超えると電解質の酸化分解が、下限を下回ると還元分解が起こり、電解質の劣化や副反応を引き起こす。したがって、電位窓の広さは電池の作動電圧やエネルギー密度に直結する重要な指標である。
- [用語12]
- 電極活物質:電池の正極や負極で実際に化学反応に関与し、電気エネルギーの出入りを担う物質を指す。リチウムイオン電池ではLiCoO2や黒鉛が代表例であり、Mg–H2電池ではMgや水素ガスが電極活物質となる。電極活物質の種類や構造は、電池の容量・電圧・寿命・安全性を決定づける重要な要素である。
論文情報
- 掲載誌:
- Science
- タイトル:
- High-Capacity, Reversible Hydrogen Storage Using H⁻-Conducting Solid Electrolytes
- 著者:
- Takashi Hirose, Naoki Matsui, Takashi Itoh, Yoyo Hinuma, Kazutaka Ikeda, Kazuma Gotoh, Guangzhong Jiang, Kota Suzuki, Masaaki Hirayama, Ryoji Kanno
研究者プロフィール
菅野 了次 Ryoji KANNO
東京科学大学 総合研究院 全固体電池研究センター 特命教授
研究分野:固体イオニクス、電気化学
松井 直喜 Naoki MATSUI
東京科学大学 総合研究院 全固体電池研究センター 助教
研究分野:固体イオニクス、電気化学、材料インフォマティクス
廣瀬 隆 Takashi HIROSE
東京科学大学 総合研究院 全固体電池研究センター 研究員(研究当時)
(現 東京科学大学 物質理工学院 応用化学系 助教)
研究分野:固体イオニクス、電気化学、水素