ポイント
- 既存薬剤が取り込まれにくい腫瘍に有効な、新規低分子ホウ素薬剤を開発
- がん細胞で多く発現するアミノ酸輸送体を標的とし、ホウ素薬剤の腫瘍選択的な集積を実現
- 中性子捕捉療法の適応拡大につながる新薬剤として、難治性がん治療への貢献が期待
概要
東京科学大学(Science Tokyo) 総合研究院 化学生命科学研究所の中村浩之教授、三浦一輝助教らの研究グループは、京都大学 複合原子力科学研究所の鈴木実教授と共同で、既存薬剤を用いたホウ素中性子捕捉療法(Boron Neutron Capture Therapy:BNCT)[用語1]が効きにくい腫瘍にも高い治療効果を示す、新規ホウ素薬剤「GluBs」の開発に成功しました。
BNCTは、がん細胞に取り込まれたホウ素と中性子との核反応を利用して、がん細胞のみを選択的に殺傷する治療法であり、近年、手術や通常の放射線治療が難しい難治性がんや再発がんに対する新たな治療法として注目されています。しかし、現在薬事承認されている唯一のBNCT用ホウ素薬剤であるL-BPA(4-borono-L-phenylalanine)[用語2]が十分に集積しない腫瘍も数多く報告されており、新規ホウ素薬剤の開発が急務となっています。
本研究では、L-BPAが取り込まれにくい 「L-BPA耐性腫瘍」に対し、がん細胞で多く発現するアミノ酸輸送体であるアラニン-セリン-システイン輸送体2(ASCT2)[用語3]を標的とする新規低分子ホウ素薬剤GluBsを開発しました。このGluBsは、L-BPA耐性腫瘍でも高いホウ素集積を示し、BNCTによる優れた腫瘍増殖抑制効果を発揮することが確認されました。本成果により、BNCTの適応範囲が広がり、これまで治療が困難であった腫瘍に新たな治療選択肢を提供できるようになると期待されます。
本研究成果は12月22日付(現地時間)に国際学術雑誌「Journal of Controlled Release」に掲載されました。
背景
ホウ素中性子捕捉療法(BNCT)は、がん細胞に取り込まれたホウ素-10(10B)と熱中性子の核反応を利用し、がん細胞のみを選択的に殺傷する治療法です。BNCTは、正常組織への影響を抑えながら高いがん治療効果が期待できることから、近年、外科的手術や通常の放射線治療が難しい難治性がんや再発がんに対する新たな治療法として大きな期待が寄せられています。
現在、薬事承認されているBNCT用ホウ素薬剤はL-BPAのみであり、この薬剤はがん細胞で多く発現するL型アミノ酸輸送体1(LAT1)[用語4]を介して細胞内に取り込まれます。しかし、がん細胞の集合体である悪性腫瘍の中にはLAT1の発現量が少なく、L-BPAが十分に集積せず、BNCTの効果が得られにくい 「L-BPA耐性腫瘍」 が数多く存在することが問題となっていました。そのため、L-BPAとは異なる取り込み機構を持つ新たなホウ素薬剤の開発が強く求められています。
本研究グループはこれまでの研究で、がん細胞で多く発現するタンパク質であるインテグリンαvβ3を標的とした新規ホウ素薬剤cRGD-MID-BSA[用語5][参考文献1]や、葉酸受容体α(FRα)を標的とした新規ホウ素薬剤PBC-IP[用語6][参考文献2、3]を開発し、難治性腫瘍に対するBNCTにおいて有効性を示してきました。これらの成果を基盤として、BNCTの適応をさらに拡大することを目指して、新規ホウ素薬剤の開発に取り組んできました。
研究成果
本研究では、がん細胞で多く発現するアミノ酸輸送体の1種であるアラニン-セリン-システイン輸送体2(ASCT2)に着目し、ASCT2を介してがん細胞選択的に取り込まれる新規低分子ホウ素薬剤GluBsを開発しました(図1A)。このGluBsの分子デザインは、腫瘍微小環境[用語7]下でASCT2を介して取り込みが促進されるアミノ酸であるグルタミンの構造を模倣しています。
実験の結果、GluBsはヒト細胞に対してほとんど毒性を示さない、安全性の高い薬剤であることが確認されました。さらに、LAT1の発現量が少ないために既存のBNCT用薬剤L-BPAが取り込まれにくいものの、ASCT2の発現量は多いヒト由来がん細胞を用いて、GluBsの取り込み能を評価したところ、GluBsはL-BPAよりも数倍多く取り込まれることが明らかになりました。
次に、マウス大腸がん由来CT26細胞を移植したマウスモデルにGluBsを投与して、腫瘍へのホウ素集積とBNCT効果を確認したところ、腹腔内投与および静脈投与のいずれの場合でも、L-BPAを数倍上回るホウ素集積量を示し、かつ優れたBNCT効果を発揮しました。
さらに、L-BPAが十分に集積しないL-BPA耐性腫瘍である難治性悪性脳腫瘍由来U87MG細胞を移植したマウスモデルにおいて、GluBsを用いたBNCTを実施したところ、顕著な腫瘍増殖抑制効果が確認されました。この効果は、同量のL-BPAを投与した群と比較しても有意に高いものであり、特に L-BPA耐性腫瘍に対するBNCTにおいて、GluBsがL-BPAよりも優れた治療効果を示すことが明らかとなりました(図1B)。
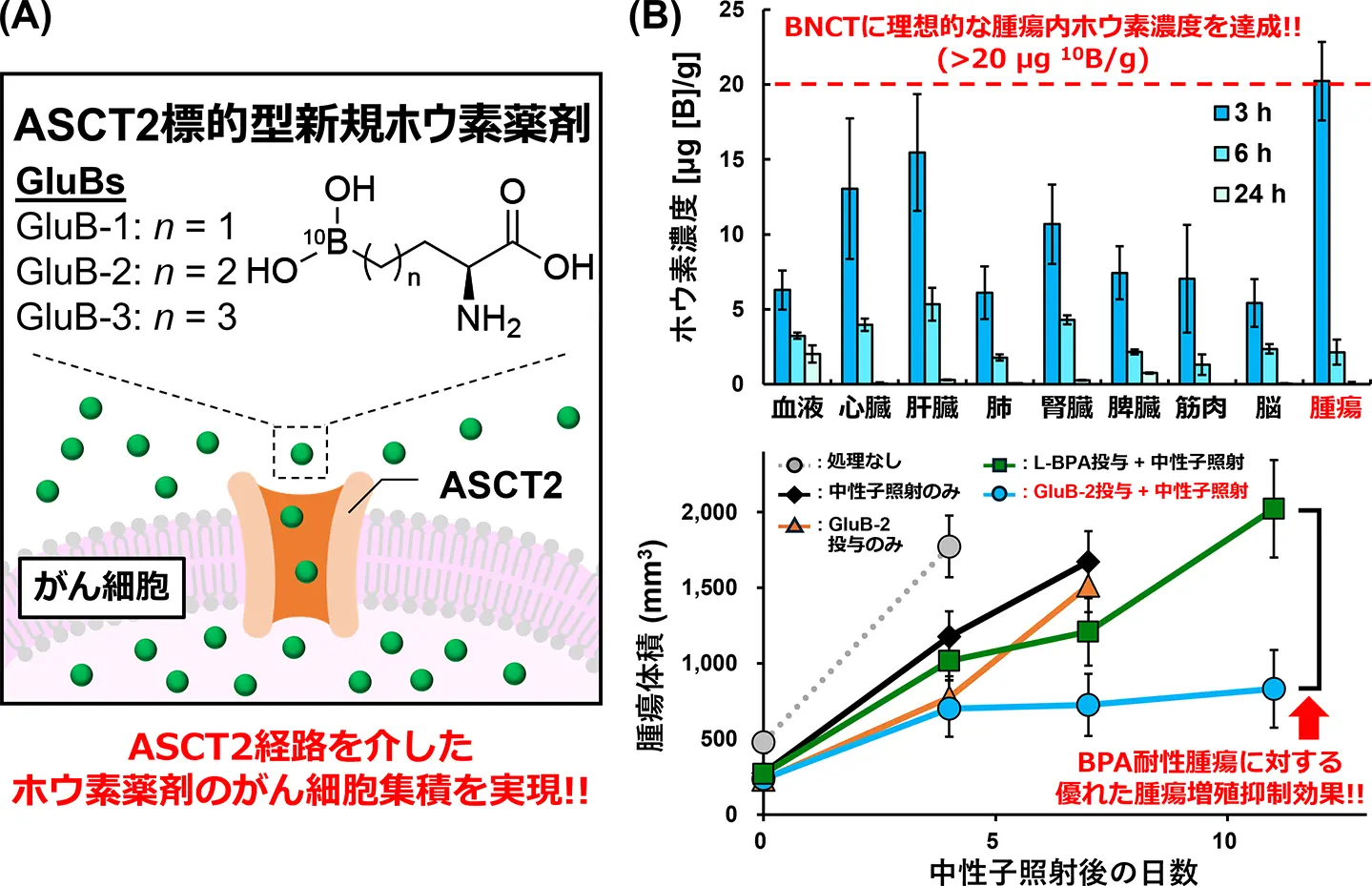
社会的インパクト
BNCTは、2020年に頭頸部腫瘍を対象とする世界初の治療システムが日本で承認され、がん治療の新たな選択肢として臨床現場での活用が始まりました。しかし、現在用いられているBNCT用薬剤L-BPAは、全ての頭頸部腫瘍に十分に集積するわけではなく、治療の適応とならない症例が一定数存在することが大きな問題となっていました。
今回の研究では、L-BPAに代わる新規ホウ素薬剤として、異なる細胞取り込み機構を持つGluBsを開発し、実際にマウスモデルでL-BPAを上回る優れたBNCT効果を示すことを確かめました。このGluBsは、L-BPAを用いたBNCTの最大の課題の1つであった、L-BPAが適応できない腫瘍への対応を可能にし、BNCTの治療対象となるがん種や患者層を大きく広げる可能性があります。
特に、これまで有効な治療法が限られていた難治性がんや再発がんに対して、新たな治療選択肢を提供できるとともに、がん医療全体の発展につながる大きな社会的インパクトをもたらすことが期待されます。
今後の展開
今後は、今回開発したGluBsを含めたホウ素薬剤全体のさらなる最適化や安全性評価を進めるとともに、臨床応用を見据えた研究を推進する計画です。
付記
本研究は、日本学術振興会(JSPS)科学研究費助成事業・基盤研究B「内在性アルブミンをホウ素キャリアに利用した次世代BNCTの構築」(21H02066)および「内在性アルブミンをホウ素キャリアに利用した細胞核標的型BNCTの開発」(25K01912)の支援を受けて行われました。
参考文献
- [参考文献1]
- F. Nakagawa et al. Cells, 9, 1615, 2020.
- [参考文献2]
- K. Nishimura et al. J. Control. Release, 360, 249-259, 2023.
- [参考文献3]
- K. Kawai et al. Mol. Pharm., 17, 3740-3747, 2020.
用語説明
- [用語1]
- ホウ素中性子捕捉療法(Boron Neutron Capture Therapy:BNCT):がん細胞に集積させたホウ素-10(10B)と熱中性子の核反応によって生じるα線とLi原子核によって、がん細胞を選択的に殺傷する放射線療法。
- [用語2]
- L-BPA(4-borono-L-phenylalanine):ボロン酸構造を有するアミノ酸誘導体で、一般名はボロファラン(10B)。がん細胞に多く発現するL型アミノ酸輸送体1(LAT1)を介して細胞内に取り込まれる。2020年に頭頸部がんに対するBNCTが承認され保険収載されている。
- [用語3]
- アラニン-セリン-システイン輸送体2(ASCT2):細胞膜に存在するアミノ酸輸送体の一種で、主にグルタミンなどの中性アミノ酸を細胞内へ取り込む役割を担う。多くのがん細胞で多く発現しており、がん細胞の増殖や代謝を支える重要な分子である。
- [用語4]
- L型アミノ酸輸送体1(LAT1):細胞膜に存在するアミノ酸輸送体で、ロイシンなどの大型中性アミノ酸を細胞内へ取り込む役割を担う。多くのがん細胞で多く発現しており、がんの増殖や代謝を支える重要な分子である。
- [用語5]
- cRGD-MID-BSA:本研究室で開発されたホウ素薬剤であり、インテグリンαvβ3結合部位であるc[RGDfK(Mal)]およびホウ素クラスターであるマレイミド型dodecaborate(MID)が段階的に結合したウシ血清アルブミン(BSA)分子。
- [用語6]
- PBC-IP:本研究室で開発されたホウ素薬剤であり、葉酸の部分構造であるpteroyl基、アルブミン結合部位であるiodophenyl基、ホウ素クラスターであるdodecaborateの3つが、アミノ酸リンカーを介して連結した構造を持つ。
- [用語7]
- 腫瘍微小環境:がん細胞そのものだけでなく、その周囲に存在するpH環境、血管、免疫細胞、細胞外基質、各種サイトカインなどを含む局所的な環境。がんの増殖、浸潤、転移や治療抵抗性に大きな影響を与える。
論文情報
- 掲載誌:
- Journal of Controlled Release
- タイトル:
- Alanine-serine-cysteine transporter-targeted small-molecule boron carriers for neutron capture therapy of L-4‑boronophenylalanine-refractory tumors
- 著者:
- Kazuki Miura, Tomoyuki Araki, Taiki Morita, Kai Nishimura, Satoshi Okada, Minoru Suzuki, Hiroyuki Nakamura*
研究者プロフィール
中村 浩之 Hiroyuki Nakamura
東京科学大学 総合研究院 化学生命科学研究所 教授
研究分野:有機化学、創薬化学、ケミカルバイオロジー
三浦 一輝 Kazuki Miura
東京科学大学 総合研究院 化学生命科学研究所 助教
研究分野:創薬化学、ケミカルバイオロジー
鈴木 実 Minoru Suzuki
京都大学 複合原子力科学研究所 附属粒子線腫瘍学研究センター 教授
研究分野:ライフサイエンス、放射線科学
関連リンク
お問い合わせ
東京科学大学 総合研究院 化学生命科学研究所
教授 中村 浩之
- hiro@cls.iir.isct.ac.jp
- Tel
- 045-924-5244
- Fax
- 045-924-5976