ポイント
- 昨今の抗菌薬耐性(AMR)の拡大は、全世界の健康上の脅威として懸念されていますが、近年、抗菌薬の開発は進んでいません。そのため、更なる対策として、効果的な細菌ワクチンの開発が急務とされています。
- 本研究では、AMRの主要病原体である緑膿菌を標的としたメッセンジャーRNA(mRNA)ワクチンを、PureCap法と呼ばれる独自のmRNA精製技術を基盤として開発しました。
- PureCap技術は、mRNAに含まれる免疫応答を妨げる不純物を除去することで、従来型のmRNAと比べて、ワクチン効果を26倍向上させました。
- この技術を、緑膿菌の病原性において重要なIII型分泌システムを構成するタンパク質PcrVに対するワクチンに応用しました。すると、マウスにおいて生存率が改善し、肺の細菌量が低下し、組織障害や炎症も抑えられました。
- これらの成果は、PureCap mRNAが細菌ワクチンの有望なプラットフォームであり、AMR対策に貢献する可能性を示しています。
概要
東京科学大学 総合研究院 難治疾患研究所 内田智士教授と京都府立医科大学 附属病院 佐和貞治院長ら研究グループは、薬剤耐性病原体である緑膿菌を標的としたmRNAワクチンを、独自のmRNA精製技術PureCap法を基盤として開発しました。
本件に関する論文は、国際科学雑誌『Journal of Controlled Release』(インパクトファクター:10.5)に2025年5月16日付けで掲載されました。
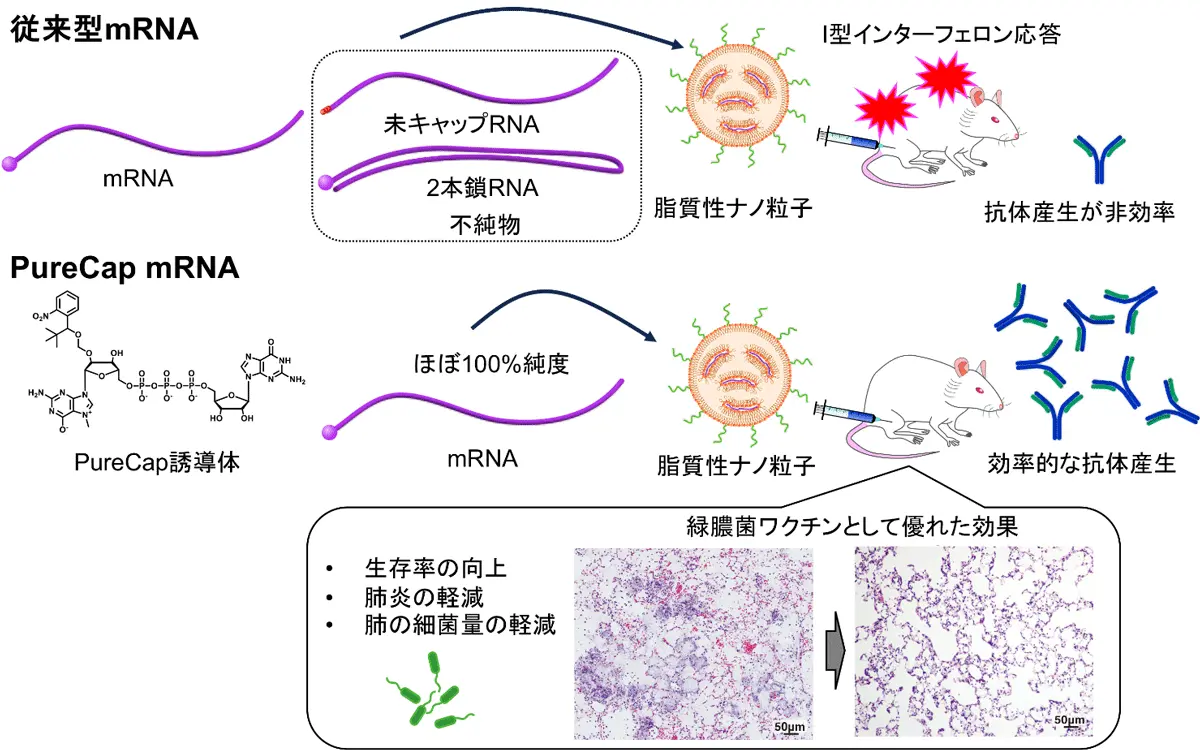
今回、PureCap技術を用いた緑膿菌mRNAワクチンの開発に成功しました。PureCap技術は、これまでのmRNAワクチンに含まれる不純物を除去し、免疫効果向上に寄与します。この技術は、免疫機能の低下した患者に重篤な感染症を引き起こす緑膿菌に対して、安全で効果的なワクチンを提供します。さらに、近い将来人類の脅威となるAMRの対策としても有望です。
背景
抗菌薬耐性(AMR)の脅威が増大する中で、2050年には全世界でのAMRによる死亡数が1,000万人となり、がんによる死亡数を上回ると推定されています。一方で、近年は新たな抗菌薬の開発が鈍化しており、他の戦略が重要となっています。その中で、細菌に対する有効なワクチンの開発は極めて重要です。細菌感染に対するワクチン開発は依然停滞していますが、我々は新型コロナウイルス感染症パンデミックで重要な役割を果たしたmRNAワクチンを用いることを着想しました。しかしながら、従来のmRNAワクチンには、キャップ化されていないRNAや二本鎖RNAなどの不純物が多く含まれていました。これらの不純物は、 I型インターフェロン応答を介して炎症反応を惹起し副反応の原因となるだけでなく、ワクチン効果を減弱します。PureCap技術はこれらの不純物を除去し、免疫効果向上に寄与します。
今回、この技術を用いた緑膿菌mRNAワクチンの開発に成功しました(図1)。一般的に緑膿菌は健常者には感染しませんが、免疫機能が低下した患者に感染し、重篤な症状を引き起こします。抗菌薬の効かない耐性菌が増えてきており、新たな対策が求められています。
研究成果
1)PureCapを用いたワクチン
まず、卵白アルブミンと呼ばれるタンパク質を標的としたワクチンのモデル実験で、PureCap mRNAと従来型のmRNAのワクチンとしての効果を比較しました。mRNAは、新型コロナウイルスワクチンでも用いられた脂質性ナノ粒子に搭載して、マウスの筋肉内に投与しました。すると、PureCap mRNAで従来型のmRNAと比べ、卵白アルブミンに対する抗体が26倍効率的に誘導されました(図2A)。
次にメカニズムを詳細に検討しました。まず、従来型mRNAに含まれるキャップ化されていないRNAと二本鎖RNAという2種類の不純物の両方が、ワクチン効果を減弱させていることが明らかとなりました。これら2種類の不純物は、マウスの体内でI型インターフェロンという炎症性分子の産生を誘導していました。そこで、このI型インターフェロンの働きを抑える抗体を投与してから従来型mRNAを投与したところ、ワクチン効果がPureCap mRNAと同様のレベルまで回復しました(図2B)。すなわち、従来型mRNAに含まれる不純物が誘導したI型インターフェロンが、ワクチン効果を弱めていることが分かりました。一方、PureCap法では、ワクチン効果を弱める不純物がないため、高いワクチン効果が得られます。
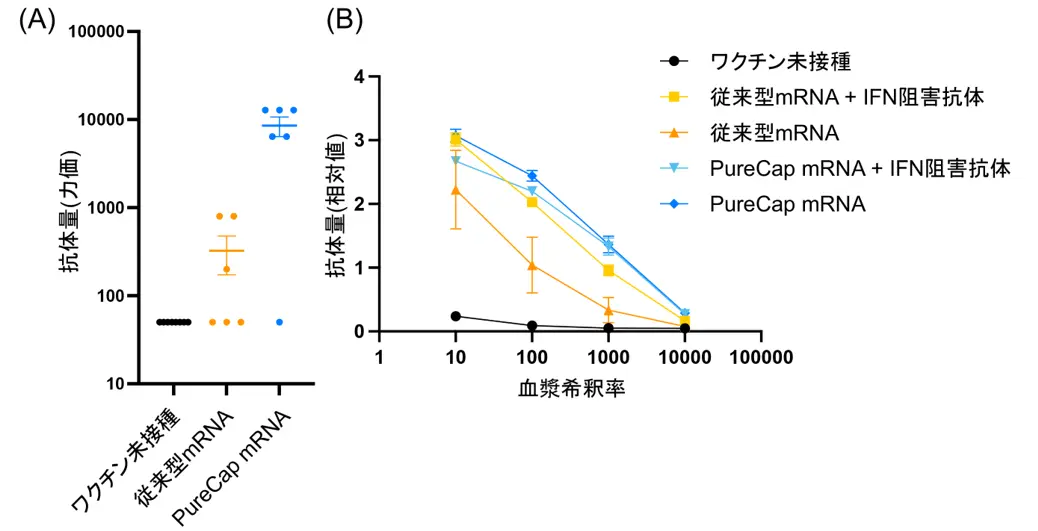
(A)従来型mRNAとPureCap mRNAのワクチン効果を、抗体量(力価)を指標として比較。
(B)ワクチン投与前にI型インターフェロンの働きを抑える抗体(IFN阻害抗体)を投与した際の抗体量。グラフは右上ほど抗体量が多いことを意味する。
2)緑膿菌ワクチンの開発
本研究では、主要なAMR病原体である緑膿菌(Pseudomonas aeruginosa)を標的としたmRNAワクチンを、PureCap技術を用いて開発しました。緑膿菌がヒトの細胞に対して毒素を注入するのに用いるIII型分泌システムの中で、特に毒素の分泌に必須となるPcrVというタンパク質に対するmRNAワクチンを設計しました。具体的には、PcrV抗原をコードするmRNAを、脂質性ナノ粒子を用いてマウスに筋肉内投与しました(図3A)。図2のモデル実験と同様に、PureCap mRNAで従来型mRNAと比べ、より効率的にPcrVに対する抗体が産生されました(図3B)。
さらに、ワクチンを接種したマウスに対して、緑膿菌を肺に投与することで、緑膿菌感染に対する予防効果を調べました(図3C)。すると、ワクチンを投与していないマウスでは、感染後24時間以内に約8割のマウスが死亡し、24時間後の生存率は20%程度でした。一方で、PureCap mRNAでワクチンをした群では、24時間での生存率が60%以上あり、ワクチンによりマウスの生存期間を有意に延長しました。これはワクチンによって効率的に抗体が産生されたためと考えられます。
また、肺に存在する緑膿菌の量を測定したところ、PureCap mRNAでワクチン接種をした群では、ワクチン未接種の群と比べ、緑膿菌量が56分の1に低下していました(図3D)。また、緑膿菌が肺に感染すると、肺に水が溜まり重くなることに加え、肺への好中球の浸潤によりミエロペルオキシダーゼ(MPO)という殺菌作用を持つ酵素の量が増えます。これらを指標に肺での炎症反応を定量しました。すると、PureCap mRNAでワクチンした群で、従来型mRNAを用いた群と比べて、肺の重量が軽くなり(図3E)、さらにMPOの活性も低下していたことから(図3F)、ワクチンにより肺炎が抑えられたことが分かりました。実際に、組織切片を作り、肺を観察したところ、ワクチン未接種では肺炎がみられた一方で、ワクチン接種した群では肺の炎症は軽度でした(図3)。
以上のように、PureCap mRNAワクチンでは、緑膿菌のPcrVに対する抗体が効率的に誘導され、結果的に、肺の傷害が軽減し、肺での炎症や緑膿菌の増殖が抑えられ、マウスの生存率が向上しました。一方で、従来型mRNAでは、抗体産生が効率的ではなく、結果的に緑膿菌感染に対して、ワクチン未接種群と比べて統計学的に有意な予防効果は得られませんでした。これらの結果は、PureCap mRNAが細菌ワクチンの有望なプラットフォームであり、AMRと闘うための有効な戦略を提供することを強く示しています。
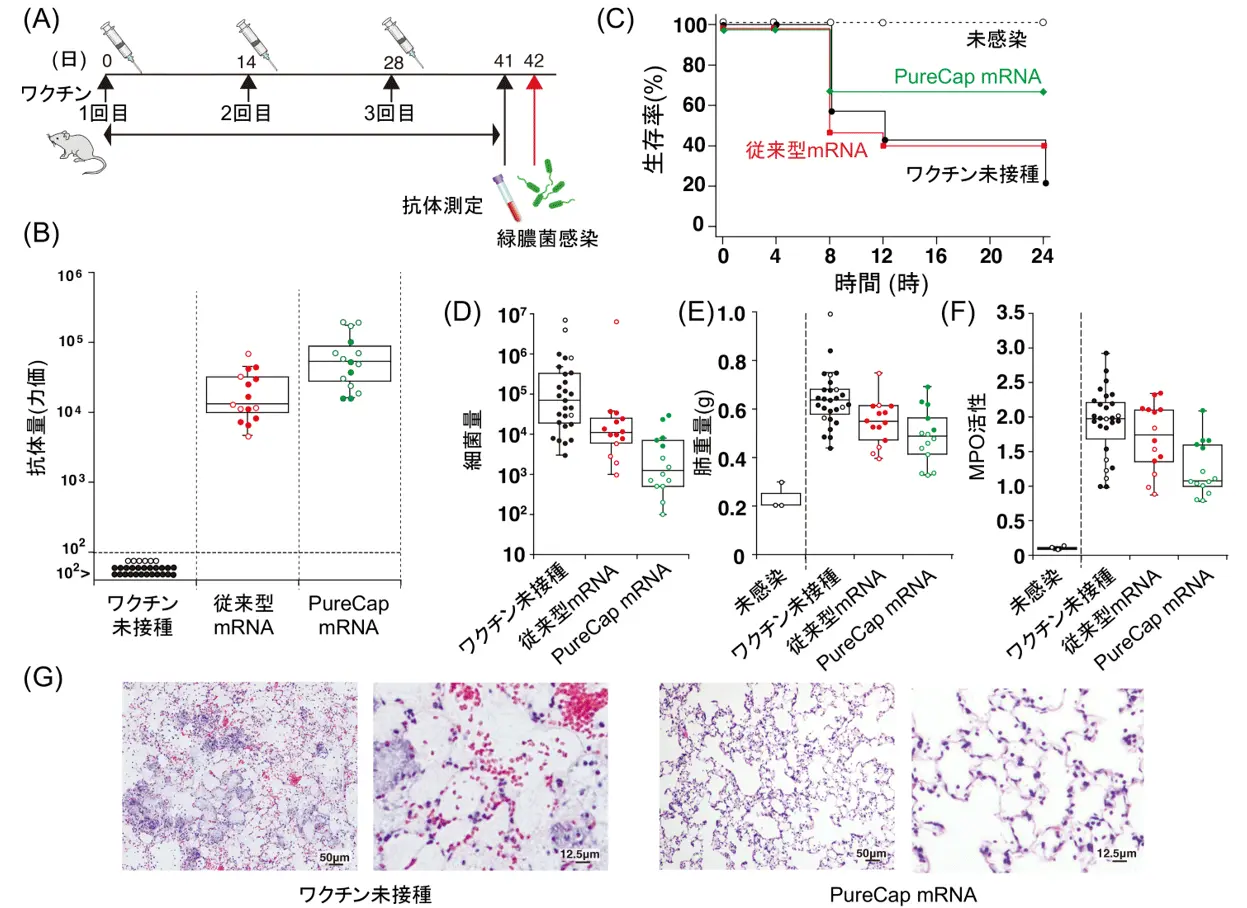
(A)ワクチンスケジュール。(B)PcrV抗原に対する抗体の量。(C)緑膿菌感染後の生存率。(D)肺における緑膿菌の量。(E)肺の重量。(F)ミエロペルオキシダーゼの活性。(G)緑膿菌感染後の肺組織。
今後の展開
本研究では、脂質性ナノ粒子に封入したPureCap mRNAが緑膿菌に対するワクチンとして高い有効性を示しました。従来型mRNAと比較して、PureCap mRNAはタンパク質の発現効率を高め、I型インターフェロン応答を抑制することで、マウスにおける抗体産生を増強しました。PureCap技術は、実際に人々の治療などに使えるようにするための準備が進んでいます。具体的には、「GMP」と呼ばれる厳しい品質管理の基準に従って、安全で安定した製品を大量に作るための製造方法が、ほぼ確立されつつあります。これにより、今後この技術を使ったワクチンや治療薬の実用化が、より現実的な段階に入ってきています。
緑膿菌に対するワクチン接種では、PureCap mRNAが効率的に抗体を産生することで、マウスの生存期間を延長し、肺の組織障害や炎症反応を軽減しました。緑膿菌は、健常者には感染しませんが、免疫機能が低下した患者に重篤な感染症を引き起こします。院内感染や高齢者施設での集団感染も問題になるほか、抗がん剤治療を受けている患者、人工呼吸器をつけている患者、火傷を負った患者さらには透析中の患者での感染も問題になっています。抗菌剤に耐性を持った緑膿菌が増えており、抗菌剤に頼らない対策が求められている中、本研究で開発したワクチンは有望です。さらに、本研究の成果は、毒素を標的細胞に注入する共通の機構を持つ病原性大腸菌、赤痢菌、ペスト菌、百日咳菌など他のグラム陰性菌にも応用することができます。
付記
- 日本医療研究開発機構(AMED):日本医療分野研究開発推進事業(LEAP)(21gm0010008h0001:阿部洋、内田智士、佐和貞治)
- 産学共創プラットフォーム共同研究推進プログラム(COI-NEXT)(JPMJPF2022:内田智士)日本学術振興会科学研究費補助金(文部科学省)(24390403、26670791、15H05008、18H02905、22H03176:佐和貞治/23K1748、21H04962、18H03529:内田智士)
- 東京医科歯科大学難治疾患共同研究拠点(TMDU 2023:阿部洋、内田智士)
論文情報
- 掲載誌:
- Journal of Controlled Release
- タイトル:
- Highly pure mRNA vaccine provides robust immunization against P. aeruginosa by minimizing type I interferon responses
- 著者:
- 京都府立医科大学附属病院 佐和貞治、東京科学大学 総合研究院難治疾 患研究所先端ナノ医工学分野 内田智士
- 共同著者:
- 京都府立医科大学 大学院医学研究科 麻酔科学 川口顕、木下真央、須藤和樹、井上敬太、東京科学大学 総合研究院 難治疾患研究所 先端ナノ医工学分野 Le Bui Thao Nguyen、京都府立医科大学 大学院医学研究科 医系化学 大庭誠、名古屋大学大学院 物質理学専攻化学系 生物有機化学研究室 阿部奈保子、阿部洋
研究者プロフィール
内田 智士 Satoshi UCHIDA 教授
東京科学大学 総合研究院 難治疾患研究所 先端ナノ医工学分野
佐和 貞治 Teiji Sawa 院長
京都府立医科大学附属病院
関連リンク
お問い合わせ
取材申込み
東京科学大学 総務企画部 広報課
- Tel
- 03-5734-2975
- Fax
- 03-5734-3661
- media@adm.isct.ac.jp