概要
東京科学大学 理学院 化学系の植草秀裕教授は、京都大学 大学院薬学研究科の掛谷秀昭教授、Lei Zhang博士後期課程学生、理化学研究所 環境資源科学研究センターの堂前直ユニットリーダー、慶應義塾大学 大学院理工学研究科の平野秀典特任准教授らの研究グループと共同で、新規共有結合性アスパラギン合成酵素(ASNS)阻害剤[用語1]として、スタキボトリス属の糸状菌が生産する新規化合物スタキベンザールA-Cを見出し、非小細胞肺がん[用語2]に対する抗がん剤シーズとしての有望性を明らかにしました。
アスパラギン合成酵素(ASNS)は、L-グルタミン(L-Gln)を窒素源として、L-アスパラギン酸(L-Asp)からL-アスパラギン(L-Asn)を生合成する酵素であり、L-Asnのde novo合成[用語3]における律速酵素です。ASNSは、肺がん、大腸がん、急性リンパ性白血病などで高発現が報告されており、がんの悪性化・再発や抗がん剤耐性に寄与する酵素です。本研究グループは、共有結合性ASNS阻害剤の開発のために、リジン残基模倣化合物N-Boc-L-Lysを用いた簡便かつ高感度な評価系を構築し、スタキボトリス属の糸状菌が産生するメロテルペノイド系新規化合物スタキベンザールA~Cを見出し、ASNSの556番目のリジン残基に共有結合することで酵素活性を阻害し抗がん活性を示すことを明らかにし、がん代謝特性を標的とする新規抗がん剤開発につながることが期待されます。
本研究成果は、2025年7月10日に国際学術誌「Journal of Natural Products」のオンライン版に掲載されました。
背景
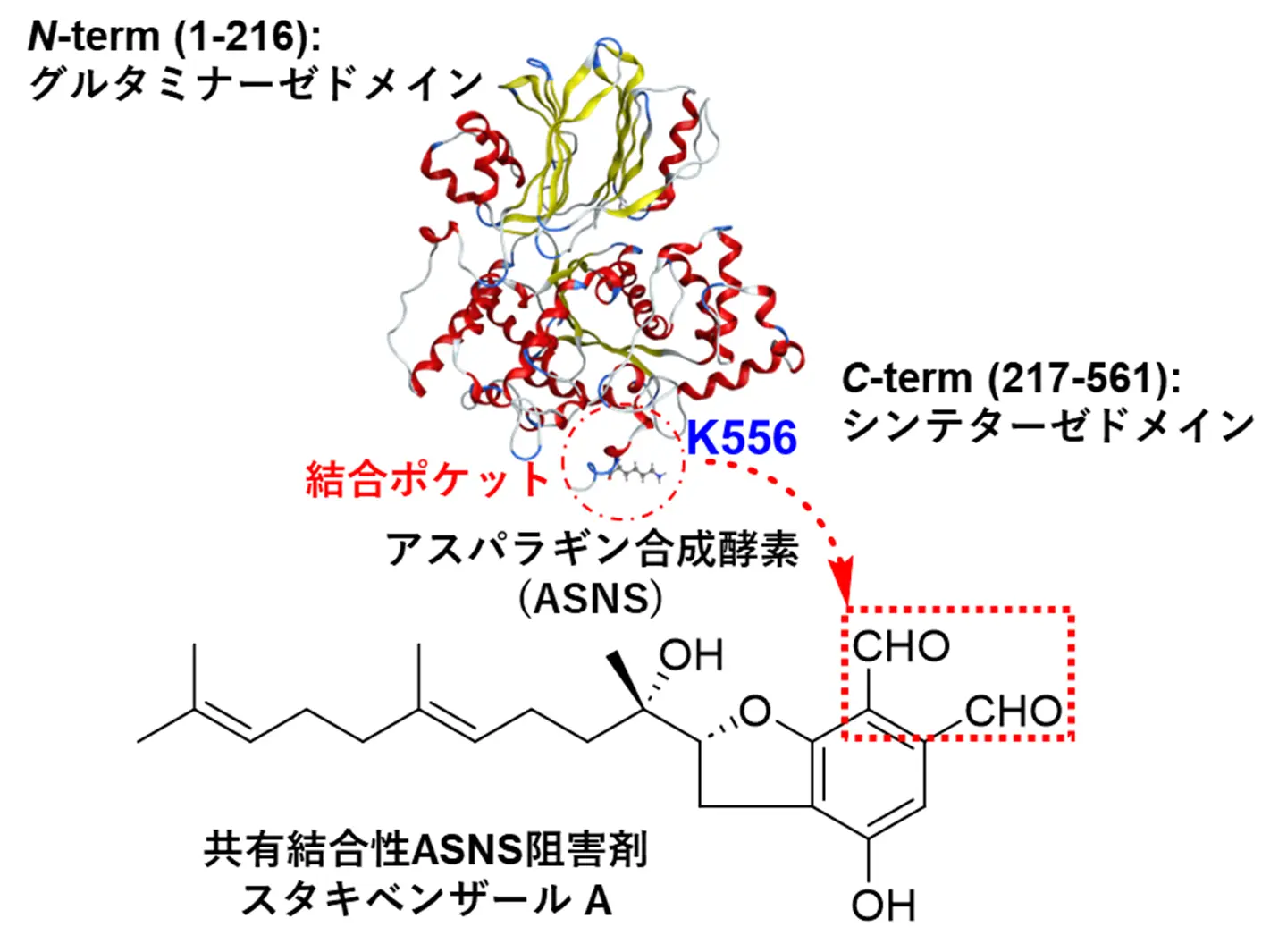
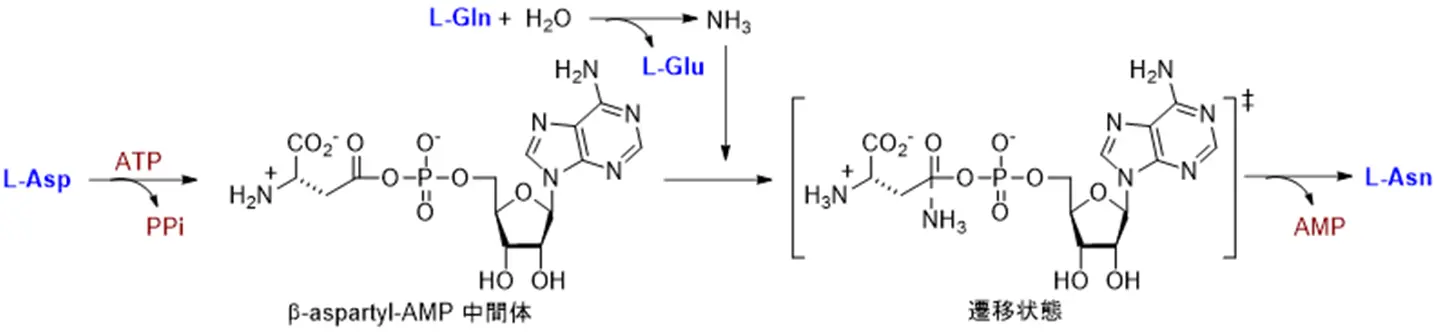
がん細胞は高い栄養要求性があり、L-グルタミン(L-Gln)やL -アスパラギン(L -Asn)などの欠乏は、肺がん、乳がん、白血病細胞、前立腺がんなどの増殖や転移を抑制します。細胞外L-Asnを低下させるL-アスパラギナーゼ[用語4]は急性リンパ性白血病(ALL)の治療薬として承認されていますが、治療に伴う細胞内アスパラギン合成酵素(ASNS:asparagine synthetase)の発現上昇による獲得耐性が大きな課題になっています。ASNSは561残基のアミノ酸からなり、N末側(1-216)にグルタミナーゼドメイン、C末側(217-561)にシンテターゼドメインを有しており、基質となるL -アスパラギン酸(L -Asp)とATPを反応させ活性なβ-aspartyl-AMP中間体を生成すると同時に、L-Glnの加水分解によって生じたアンモニアと反応させ、四面体型遷移状態を経てL -Asnを生成します(図1)。ASNSは、Asnのde novo合成を担い細胞内タンパク質合成の律速酵素であり、肺がん、前立腺がん、膵がんなどで高発現していることに加えて、抗がん剤アパチニブなどの処理時には、アミノ酸応答経路の活性化によるASNSの発現誘導が獲得耐性の主要因であることも報告されており、がん分子標的として非常に注目されています。そこで、本研究は、ASNSを標的とした共有結合性抗がん剤シーズ開発を目指しました。
研究手法・成果
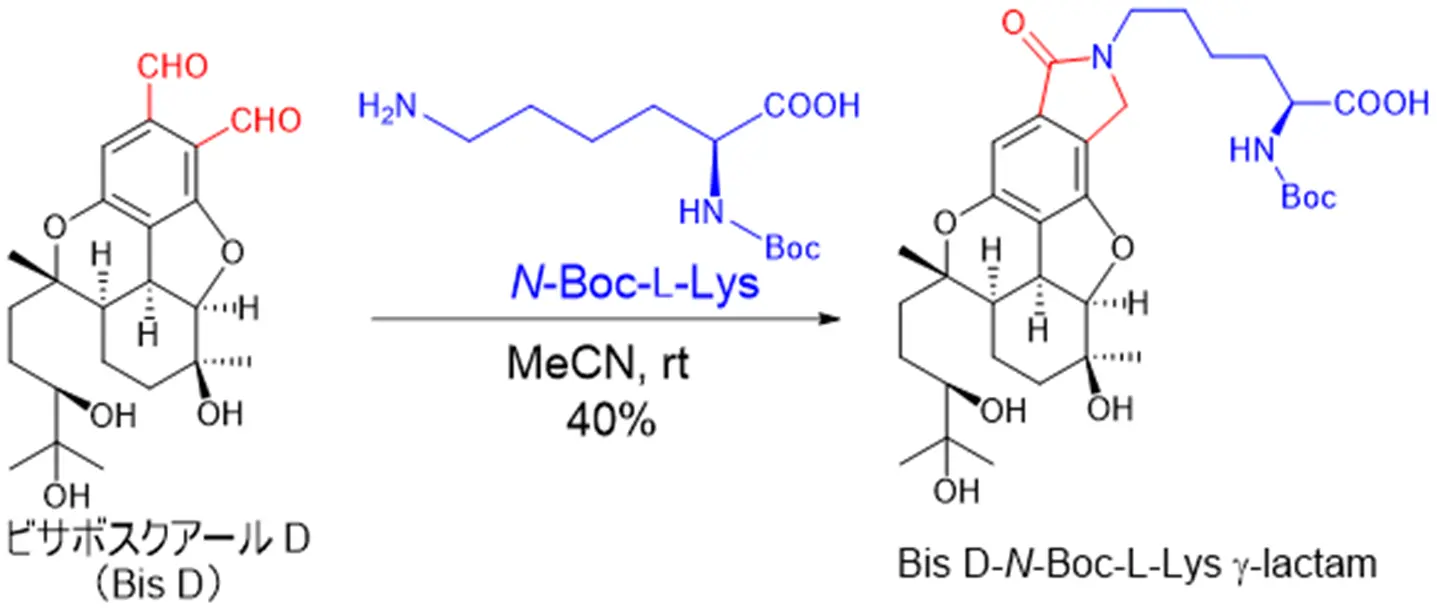
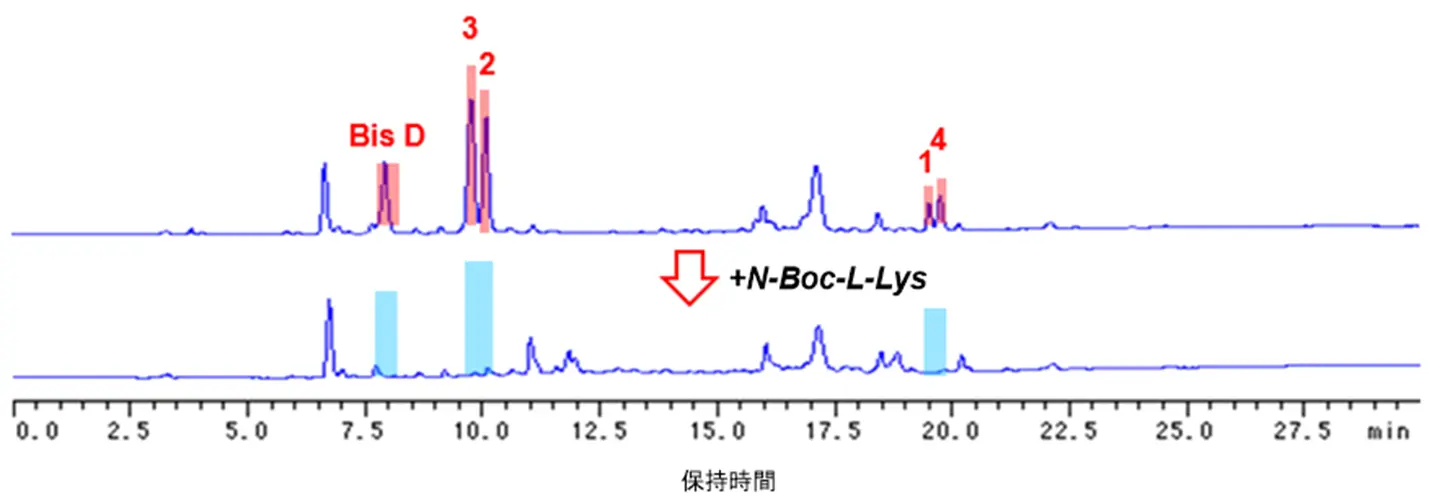
共有結合性抗がん剤シーズは、標的タンパク質ASNS内の求核性アミノ酸残基と共有結合を形成し、強力かつ持続的な作用が期待されます。今回、ASNSの求核性アミノ酸残基をリジン残基に設定し、はじめに、リジン残基反応性微生物代謝産物の検出方法の検討・確立を行いました。すなわち、ビサボスクアールD(Bis D; 本研究グループが先行研究でASNS阻害剤として報告済[参考文献])とリジン残基模倣化合物Na-(t-butoxycarbonyl)-L-lysine; N-Boc-L-Lysを反応後、生成物の化学構造を各種スペクトル解析(NMRスペクトル解析、高分解能MSスペクトルなど)により決定した結果、生成物はN-Boc-L-Lysが共有結合した化合物(BisD-N-Boc-L-Lys g-lactam)であることを明らかにしました(図2)。続いて、糸状菌Stachybotrys ruwenzoriensis RF-6853の培養抽出物とN-Boc-L-Lysを反応後、反応液を高速液体クロマトグラフィー(HPLC)で分析した結果、5つの化合物(1~4、BisD)がN-Boc-L-Lysと反応したことを確認しました(図3)。そこで、S. ruwenzoriensis RF-6853の培養抽出物から各種クロマトグラフィーを用いて化合物1~4の単離精製を行い、各種スペクトル解析(NMRスペクトル解析、高分解能MSスペクトル、X線結晶構造解析、ECDスペクトルなど)により構造解析を行いました。その結果、化合物1~3は、新規メロテルペノイド化合物であったので、スタキベンザールA~C(1~3)と命名しました(図4)。なお、化合物4は、既知化合物pre-SMTP (4)でした。
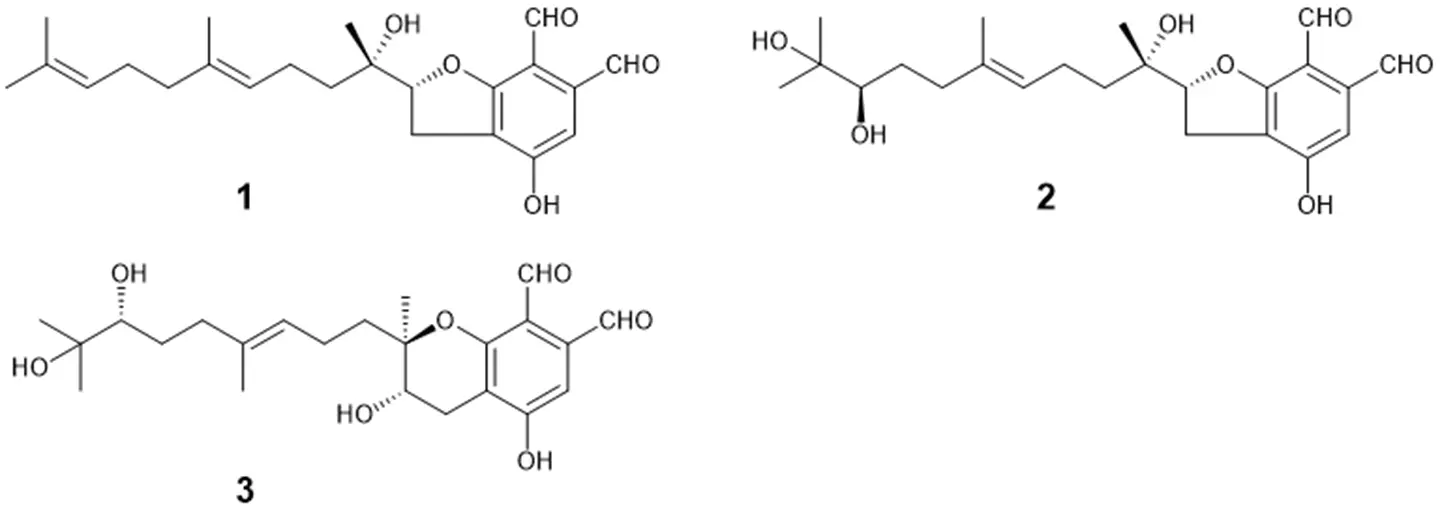
スタキベンザールA~C (1~3)の組換えヒトASNSに対する阻害活性を検討した結果、50%阻害濃度(IC50値)は、それぞれ15.9, 43.2, 46.8 ÅMであり、スタキベンザールA (1)が最も強力な阻害活性を示しました。さらに、スタキベンザールA~C (1~3)のヒト非小細胞肺がんA549細胞株の増殖に対する50%阻害濃度(IC50値)は、15.3, >100, >100 ÅMであり構造活性相関に関する有益な知見が得られました。また、LC-MS/MSを用いたスタキベンザールA (1)とASNSの複合体解析を行った結果、1はASNSの556番目のリジン残基(K556)に共有結合し酵素活性を阻害することを明らかにしました(図5)。
本研究グループは、これまでに、ビサボラン型メロテルペノイドであるビサボスクアール A(Bis A)が同様のメカニズムでASNSを阻害することを報告しており[参考文献]、本研究成果と併せて、ASNSを分子標的とした新規抗がん剤開発につながることが期待されます。
波及効果、今後の予定
本研究成果は、天然物創薬ケミカルバイオロジー研究とがん代謝特性研究などを組み合わせて得られた研究成果であり、スタキベンザール類(1~3)の化学構造は、既存のASNS阻害剤(基質アナログ、遷移状態アナログ、プラチナ製剤など)とは大きく異なり、強力かつ持続的な作用が期待される共有結合性抗がん剤シーズです。スタキベンザールA (1)とASNSとの複合体をより詳細に解析することで、今後の共有結合性ASNS阻害剤の設計・創製に有用な知見をもたらし、オリジナリティーの高い新規抗がん剤の開発につながることが期待されます。
研究プロジェクトについて
本研究は、京都大学、東京科学大学、理化学研究所、慶應義塾大学との共同研究です。また、文部科学省科学研究費助成事業 基盤研究A(課題番号 24H00493)、文部科学省新学術領域研究(課題番号 17H06401)、文部科学省学術変革研究A(課題番号 23H04882)、日本医療研究開発機構 次世代がん医療加速化研究事業(課題番号 JP24ama221540, JP25ama221540)、日本医療研究開発機構 生命科学・創薬研究支援基盤事業(BINDS)(課題番号 JP24ama121034, JP25ama121034)等の支援を受けて実施されました。
参考文献
- [1]
- Y. Pan, T. Suzuki, K. Sakai, Y. Hirano, H. Ikeda, A. Hattori, N. Dohmae, K. Nishio, H. Kakeya. Bisabosqual A: a novel asparagine synthetase inhibitor suppressing the proliferation and migration of human non-small cell lung cancer A549 cells. Eur. J. Pharmacol. 960, 176156, 2023.
用語説明
- [用語1]
- 共有結合性阻害剤(コバレントドラッグ): 分子内に求電子的な反応基を有し、標的タンパク質が持つ求核的アミノ酸残基(リジン、システインなど)と共有結合することで不可逆的にタンパク質機能を阻害する。
- [用語2]
- 非小細胞肺がん:肺がんの8-9割を占め、腺がん、扁平上皮がん、大細胞がんに分類される。
- [用語3]
- de novo合成:生物の代謝経路において、ある物質が原料となる別の物質から新しく生合成されること。
- [用語4]
- L-アスパラギナーゼ:L-アスパラギンを加水分解してL-アスパラギン酸を生成する酵素。
論文情報
- 掲載誌:
- Journal of Natural Products
- タイトル:
- Natural Lysine-Reactive Meroterpenoids, Stachybenzals A–C, as Covalent Asparagine Synthetase Inhibitors(リジン反応性メロテルペノイド骨格を有する天然物スタキベンザールA-Cは、アスパラギン合成酵素に対する共有結合性阻害剤である)
- 著者:
- Lei Zhang, Hidehiro Uekusa, Takehiro Suzuki, Naoshi Dohmae, Akira Hattori, Yoshinori Hirano, Hideaki Kakeya
(Lei Zhang、植草秀裕、鈴木健裕、堂前 直、服部 明、平野秀典、掛谷秀昭)
研究者のコメント
共有結合性酵素阻害剤は、標的酵素の求核性アミノ酸残基と共有結合を形成し、強力かつ持続的な作用が期待されます。今回、微生物代謝産物を探索源として、共有結合性ASNS阻害剤を効率良く検出可能な評価系を確立し、新規ASNS阻害剤スタキベンザール類を見出しました。本研究成果が、がんの代謝特性を標的とした革新的な抗がん剤の開発や化学療法の開発につながることを期待しています。
関連リンク
東京科学大学 総務企画部 広報課
- Tel
- 03-5734-2975
- Fax
- 03-5734-3661
- media@adm.isct.ac.jp