ポイント
- 光遺伝学とクライオ電子線トモグラフィー(cryo-ET)を融合させることで、細胞内の動的な構造変化を分子レベルで可視化する革新的な技術基盤を確立しました。
- 本技術により、細胞の突起「葉状仮足」が形成される過程において、アクチン細胞骨格と細胞膜がどのように再構築されるかをナノスケールで明らかにしました。
- 時間軸を導入した電子顕微鏡観察により、細胞内構造のダイナミックな変化を詳細に解析できるようになり、神経誘導やがん転移などの理解、さらには創薬研究への応用が期待されます。
概要
東京科学大学(Science Tokyo)大学院医歯学総合研究科 細胞生物学分野の中田隆夫教授らの研究グループは、三重大学 大学院医学系研究科 組織学・細胞生物学分野の稲葉弘哲講師、神戸大学 大学院医学研究科の仁田亮教授および今崎剛助教(学内講師)らとの共同研究により、光遺伝学[用語1]ツールを用いて葉状仮足[用語2]の形成を制御し、さらにクライオ電子線トモグラフィー[用語3]によって、その構造を天然に近い状態で詳細に観察することに成功しました。
特に、アクチン細胞骨格[用語4]と細胞膜との相互作用や、形成途上にある新たな構造「mini filopodia」の発見など、細胞運動のメカニズム解明に重要な知見が得られました。
本成果は、神経軸索の誘導、免疫応答、がん転移といったさまざまな生命現象の理解に寄与するだけでなく、細胞内のダイナミックな変化に関する超微細構造の解析を通じた創薬研究にも、新たな道を開くことが期待されます。
本成果は、4月24日付の「iScience」誌に掲載されました。
背景
クライオ電子顕微鏡法は、もともとはウィルスやタンパク質などの精製された生体分子を観察し、平均化画像をとる方法によって分子構造を決定することに用いられてきました。
これに対し、クライオ電子線トモグラフィーとは脳のCT(Computed Tomography)のように少しずつ角度を変えて取得した画像から元の三次元像を再構築する、生体のような均一でない対象も観察出来る方法です。近年のクライオ電子顕微鏡の技術革新により、高分解能解析が可能となりました。これにより各生体高分子が細胞内で実際にどのように分布し、構造をつくっているのかを分子レベルで知ることができるようになりつつあります。これは生命現象の理解にとどまらず、生体分子を標的とした創薬においても重要な情報となります。しかしながら、電子顕微鏡法には基本的に凍結を含め固定する必要があるという制約があるため、細胞内で起きる現象を時間軸に沿って観察することは困難でした。
光遺伝学は、光を用いて光感受性タンパク質を可逆的かつ時空間的に自在に制御することを可能にする技術です。当初は神経科学への応用が進んでいましたが、近年では人工的に設計された光感受性ドメインを用いた多様なツールが開発され、特定の細胞機能を高い精度で制御することが可能となっています。
今回、研究グループは、光遺伝学とクライオ電子線トモグラフィーとを統合することにより、無染色・無固定で高解像度の画像を得ることのみならず、電子顕微鏡法における時間軸の問題の解決を試みました。その技術基盤の構築に向けて、低分子量Gタンパク質Rac1[用語5]の光遺伝学ツールであるPA-Rac1を用い、光刺激によって誘導される葉状仮足の形成過程において、アクチン細胞骨格と細胞膜がどのように再構築されるのかを、ナノメートルスケールで解明することを目指しました。
研究成果
細胞移動は、発生や免疫応答、がんの転移など、さまざまな生命現象において「仮足」と呼ばれる突起構造を形成しながら行われます。なかでも葉状仮足(lamellipodia)は、アクチン繊維が密に集積したシート状の構造であり、細胞移動における代表的な推進力として機能しています。そのため葉状仮足内のアクチンフィラメントの構造は強い興味をもって研究がなされました。しかし、葉状仮足内のアクチンネットワークは非常に複雑かつ高密度な三次元構造を有しているため、光学顕微鏡では詳細な観察が困難です。一方で、従来の電子顕微鏡法では、化学固定や細胞膜を可溶化するため、構造の変化や破綻のリスクがありました。さらに固定観察であるがゆえに、観察対象も等速で運動する定常状態の葉状仮足に限られていました。そのため、形成過程にある葉状仮足の構造解析はほとんど行われていませんでした。
本研究では、光遺伝学ツールPA-Rac1を用いて葉状仮足の形成を光によって開始させ、一定時間後に細胞を急速凍結することで、形成過程を高精度に固定する手法を確立しました(図1)。続いて、クライオ蛍光顕微鏡により葉状仮足を形成している細胞を同定し、クライオ電子顕微鏡線トモグラフィーを用いて、ナノスケールで詳細な三次元構造を可視化しました。
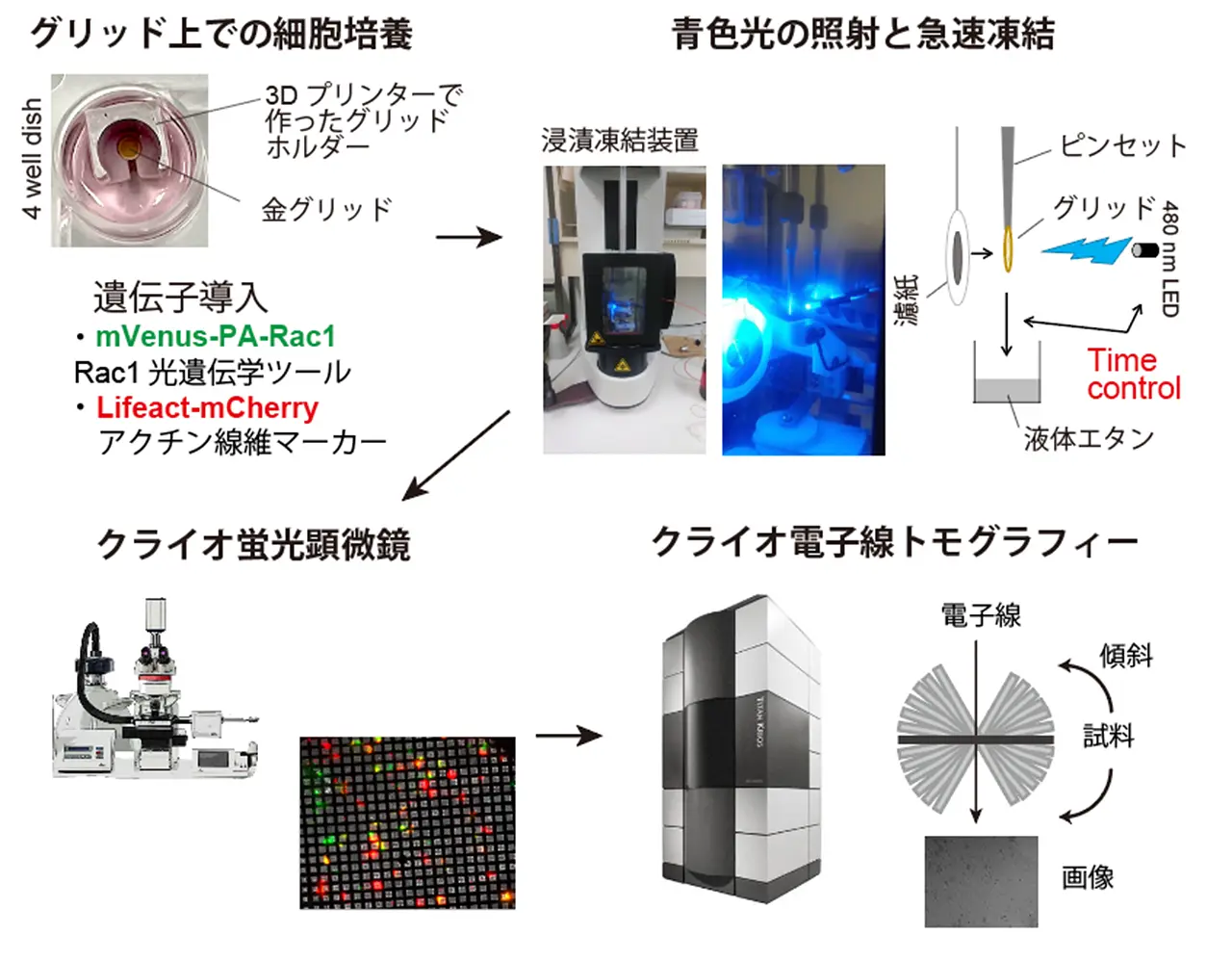
今回は、青色光を2分間照射した後に固定した細胞のみを解析対象としましたが、さまざまな伸長度を持つ葉状仮足の超微細構造の取得に成功しました。特に、先導端(leading edge)において、細胞膜とアクチン繊維との微細構造を可視化することに成功しました。
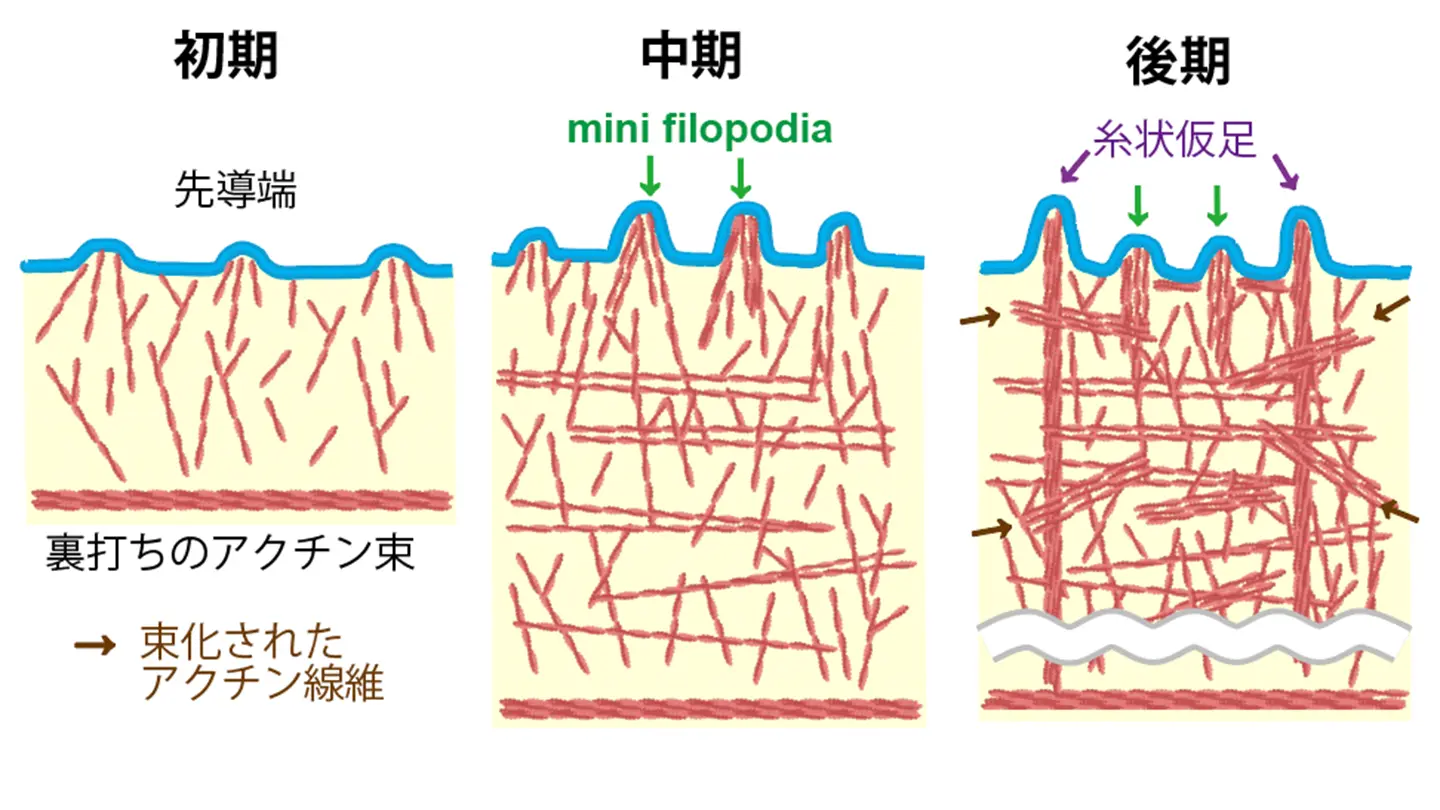
全体として、先導端は細胞膜を外側へ突出させていますが、その膜形状は滑らかではなく微細に波打っており、アクチン繊維の密度が高い「凸部」と、疎な「凹分」が交互に存在することが明らかとなりました。さらに、これらの凸部には、約9 nm間隔で束化された3〜4本のアクチン繊維が存在し、細胞膜を局所的に突出させている様子が観察されました(図2)。
この構造は、従来知られている糸状仮足糸状仮足(filopodia)[用語6]と類似していますが、より短く、繊維の本数も少ないことから、本研究ではこの構造を「mini filopodia」と命名しました。

加えて、葉状仮足内部の構造や、その後端部において、もともと細胞膜を裏打ちしていたと考えられるアクチン繊維束、さらにはその近傍に存在する小胞体および周囲を走行する微小管の可視化にも成功しました。
これらの知見をもとに、図3に示すような葉状仮足形成におけるアクチンネットワーク構築のモデルを提案しました。
今後の展開
本研究では、光によって細胞内反応の開始タイミングを厳密に制御し、それを急速凍結法と組み合わせることで、特定の時間点における細胞構造を固定した”擬似タイムラプス試料”の作製を実現しました。これにより、クライオ電子線トモグラフィーを用いた、ダイナミックな細胞内構造変化の微細な観察が可能となりました。
葉状仮足の形成過程におけるアクチン細胞骨格や細胞膜の再構築をナノスケールで可視化できたことは、細胞運動のメカニズム理解に大きく貢献する成果です。今後は、光刺激からの経過時間を段階的に変えた複数の試料を用意することで、葉状仮足の形成過程を時間軸に沿って再構築し、その動態を分子レベルで明らかにしていくことを目指します。
葉状仮足は、神経軸索ガイダンス、免疫細胞の遊走、がん細胞の浸潤・転移といった多様な現象に関与しており、本研究の成果は、こうした生命現象の理解にとどまらず、疾患のメカニズム解明や創薬研究にも新たな道を開くものと期待されます。
付記
本研究は、文部科学省研究費学術変革領域研究A「クロススケール細胞内分子動態解析が解明する細胞骨格ネットワーク構築とその破綻(クロススケール新生物学)」(JP21H05254、研究代表者:仁田亮、研究分担者:中田隆夫)、内閣府ムーンショット型研究支援事業(JPMJMS2024)、科学技術振興財団(JST)創発的研究支援事業(JPMJFR214K)、日本医療研究開発機構(AMED)革新的先端研究開発支援事業ユニットタイプ(AMED-CREST、JP21gm161003)、創薬等先端技術支援基盤プラットフォーム(AMED-BINDS、JP22am121001)、文部科学省マテリアル先端リサーチインフラ(ARIM)、文部科学省科研費(JP18K15002、JP20K16105、JP22K06219、JP18K19328、JP22K06809、JP22K20680ZA、JP23K14178ZA、JP23K23823、JP23K06674)、武田科学振興財団、上原記念生命科学財団等の支援を受けて行なったものです。
用語説明
- [用語1]
- 光遺伝学:オプトジェネティクスともいう。光学(オプティクス)と遺伝学(ジェネティクス)とを組み合わせた造語。特定の波長の光によって活性化されるタンパク質分子を、遺伝学的手法を用いて特定の細胞に発現させ、その機能を光で操作する技術。天然に存在する光感受性タンパク質だけでなく、光感受性ドメインを応用して、さまざまなシグナル伝達分子を制御するツールが開発され、応用されている。
- [用語2]
- 葉状仮足:細胞移動の際にみられる細胞突起の一種で、扁平に広く拡がった突起であり、アクチン細胞骨格によって形成される。
- [用語3]
- クライオ電子線トモグラフィー:試料を極低温度下で観察できる透過型クライオ電子顕微鏡を用い、連続的に試料を傾けて撮影することで、CTスキャンのように計算機で三次元に再構築する方法。一般的に試料を急速凍結法によって固定するため、氷が結晶化せず、天然に近い状態で固定することが可能で、細胞内の“生の”構造を観察できる方法。
- [用語4]
- アクチン細胞骨格:細胞の形態変化や運動を支える細胞骨格の一つ。アクチン分子が線維状に重合して形成され、結合タンパク質とともに複雑な構造やダイナミックな再構築を担う。
- [用語5]
- Rac1:Rhoファミリーに属する低分子量Gタンパク質の一種で、細胞の突起形成や細胞骨格の制御に関与する。特に葉状仮足の形成における上流シグナル因子として知られる。
- [用語6]
- 糸状仮足(filopodia):葉状仮足と並ぶ代表的な細胞突起で、アクチン線維が束になって細く長い突起を形成する構造。
論文情報
- 掲載誌:
- iScience
- タイトル:
- Cryo-ET of actin cytoskeleton and membrane structure in lamellipodia formation using optogenetics
- 著者:
- Hironori Inaba, Tsuyoshi Imasaki, Kazuhiro Aoyama, Shogo Yoshihara, Hiroko Takazaki, Takayuki Kato, Hidemasa Goto, Kaoru Mitsuoka, Ryo Nitta, Takao Nakata
研究者プロフィール
稲葉 弘哲 Hironori INABA
東京科学大学 大学院医歯学総合研究科 細胞生物学分野 助教
(現所属)三重大学 大学院医学系研究科 組織学・細胞生物学分野 講師
研究分野:細胞生物学、光遺伝学
吉原 壮悟 Shogo YOSHIHARA
東京科学大学 大学院医歯学総合研究科 細胞生物学分野 助教
研究分野:細胞生物学、光遺伝学
今崎 剛 Tsuyoshi IMASAKI
神戸大学 大学院医学研究科生理学・細胞生物学講座生体構造解剖学分野 助教(学内講師)
研究分野:構造生物学、生化学
仁田 亮 Ryo NITTA
神戸大学 大学院医学研究科生理学・細胞生物学講座生体構造解剖学分野 教授
研究分野:構造生物学、細胞生物学
関連リンク
更新履歴
- 2025年5月2日 関連リンクに添付のPDFファイルの誤記を修正しました。