ポイント
- 中枢神経系で髄鞘を形成するオリゴデンドロサイトに対して、細胞外マトリックス(ECM)タンパク質であるラミニン-411と、そのアミノ酸配列に由来する合成ペプチドA4G47が、髄鞘形成を促進することを発見しました。
- 髄鞘形成期の中枢神経系組織に発現しているラミニンを同定し、それらの組換えタンパク質およびペプチドを用いた解析により、ラミニン-411およびA4G47に特異的な活性を確認しました。
- ラミニン-411とA4G47は、髄鞘形成を促進する新たな分子ツールとしての活用が期待され、多発性硬化症やアルツハイマー病、うつ病、加齢に伴う脳機能低下といった疾患への応用可能性が示されました。
概要
東京科学大学(Science Tokyo) 大学院医歯学総合研究科 臨床分析・分子生物学分野の鈴木喜晴准教授らの研究チームは、多発性硬化症に代表される脱髄[用語1]疾患や、加齢による脳機能低下、アルツハイマー型認知症、うつ病などの精神疾患において、主因の一つとして知られる中枢神経系の髄鞘[用語2]機能に着目し、その制御メカニズムの解明を試みています。
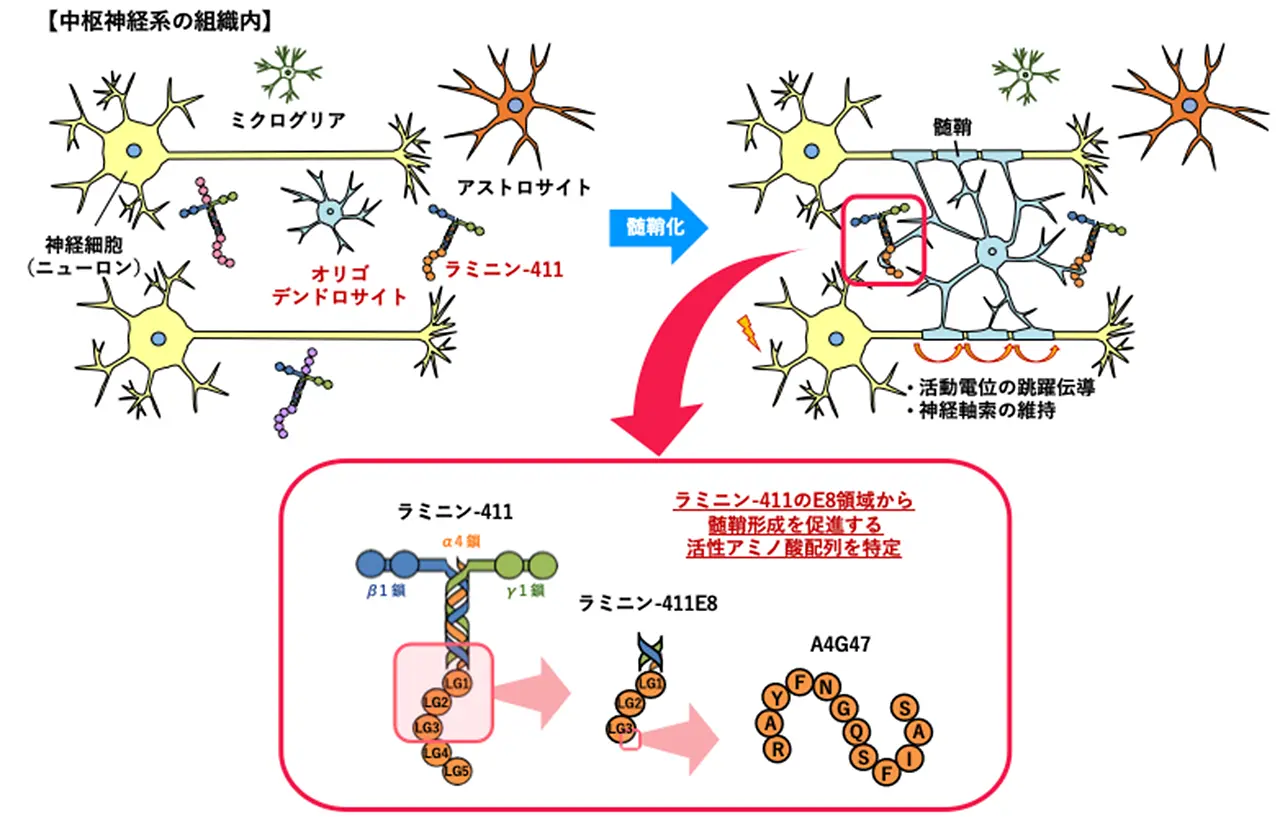
本研究では、東京薬科大学 薬学部 病態生化学教室の野水基義教授(当時)、大阪大学 蛋白質研究所の関口清俊寄付研究部門教授らと共同で、細胞外マトリックス(Extracellular matrix: ECM)[用語3]タンパク質であるラミニン[用語4]の解析を行いました。はじめに、多種類存在するラミニンのサブタイプ(アイソフォーム)の中から、中枢神経系組織で発現しているアイソフォーム(ラミニン-111、-211、-411)を見出しました。次に、それらの組換えタンパク質を用いて、髄鞘形成細胞であるオリゴデンドロサイト[用語5]への影響を調べたところ、ラミニン-411に顕著な髄鞘形成の促進活性が見られました(図1)。さらに、ラミニン-411の受容体であるインテグリン[用語6]が結合する領域であるE8と、その領域に存在する細胞接着アミノ酸配列の合成ペプチド[用語7]A4G47においても、同様の促進活性が認められました(図2)。ECMタンパク質由来の髄鞘形成ペプチドは、今回が初の発見です。
本研究の発見により、髄鞘形成におけるECMタンパク質の役割の一端が明らかとなり、ラミニン-411やA4G47は、有用な髄鞘形成ツール、または髄鞘形成促進剤としての可能性を有し、上述の関連疾患の治療やQOL向上に寄与することが期待されます。
本成果は、5月8日付(現地時間)の「GLIA」誌に掲載されました。
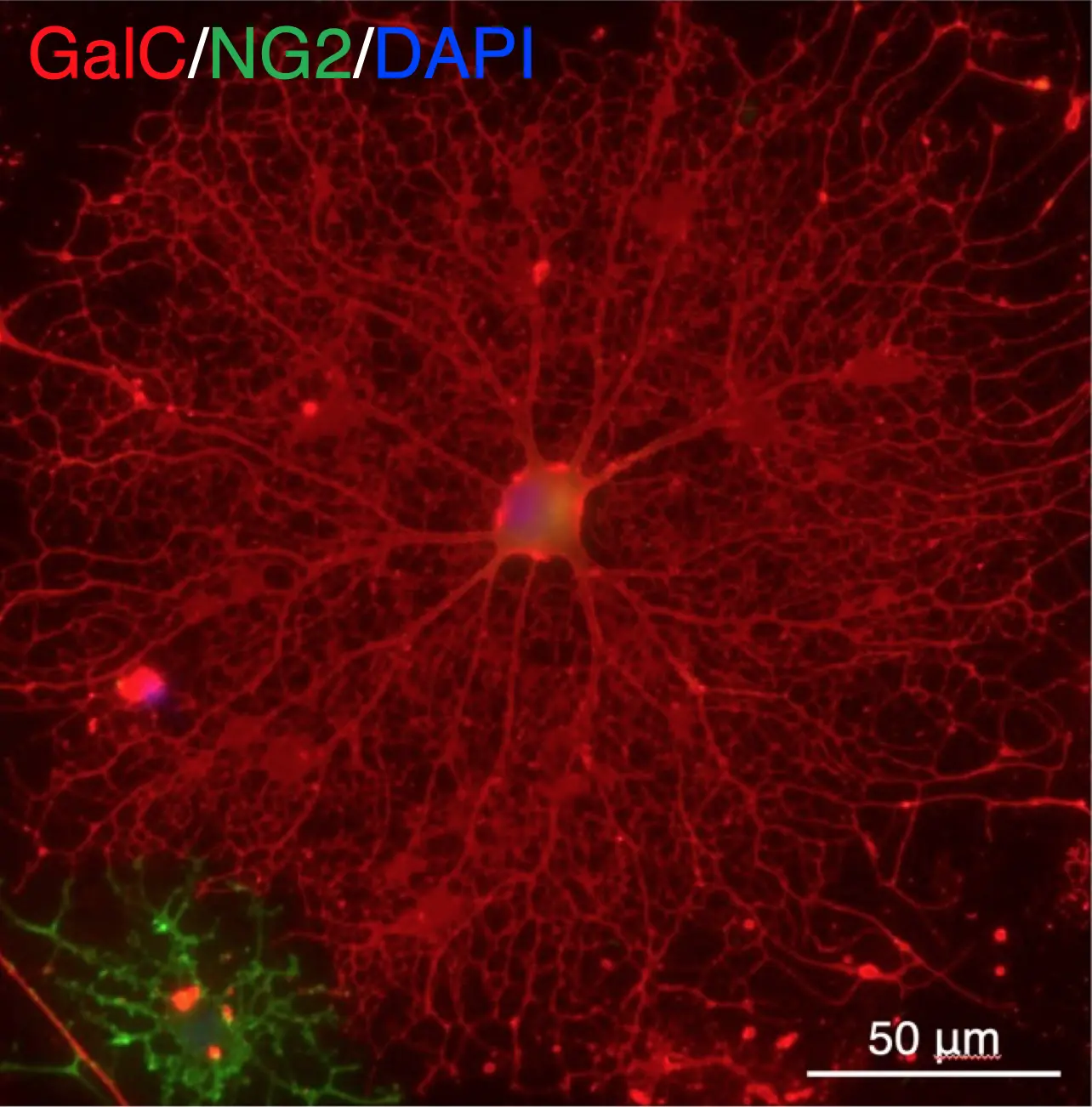
GalC:オリゴデンドロサイトマーカー、NG2:オリゴデンドロサイト前駆細胞マーカー、DAPI: 細胞核(Sasaki et al., 2025, Glia: doi: 10.1002/glia.70027)
背景
中枢神経系では、神経軸索の周囲にオリゴデンドロサイトによって髄鞘が形成されることで、神経活動電位の伝導速度が飛躍的に向上し、神経ネットワークは正常に機能しています。髄鞘は軸索の恒常性を維持する機能も持つため、多発性硬化症をはじめとする脱髄疾患では、最終的に軸索変性が生じ、重篤な神経症状を呈します。近年では、アルツハイマー型認知症やうつ病をはじめとする精神疾患、さらには加齢による脳機能低下においても、髄鞘機能の異常が主因であることが報告されており、その重要性に注目が集まっています[参考文献1-3]。
髄鞘形成の分子メカニズムについては、髄鞘タンパク質や細胞骨格分子、転写因子などの機能が詳細に解明されていますが、中枢神経系組織は間質体積に富むにもかかわらず、細胞外マトリックス(ECM)分子の機能については比較的解明が進んでいません[参考文献4]。また応用面においても、ECM分子は細胞内に導入する必要がないことから、比較的簡便にさまざまな用途へ応用可能です。こうした背景のもと、当研究室ではECM分子の機能解析および応用に向けた研究を展開しています。
本研究では、基底膜の主要構成ECMタンパク質であるラミニンに注目し、多数存在するラミニンアイソフォームがオリゴデンドロサイトに及ぼす影響と髄鞘形成活性を調べ、さらに活性部位の最小化を試みました。
研究成果
ラミニンは、α・β・γの3種類のサブユニット(鎖)から構成されていますが、インテグリンなどの細胞表面受容体と結合するのはα鎖になります。そこで、5種類存在するα鎖(α1〜5)の発現を、髄鞘形成時期の中枢神経系組織で調べたところ、α1、α2、α4が発現していることが明らかとなりました。
次に、それらのα鎖を含むラミニン(ラミニン-111、-211、-411)の組換えタンパク質を用いて、オリゴデンドロサイトへの影響を調べた結果、ラミニン-411において顕著な髄鞘形成活性およびアポトーシス抑制効果が認められました。さらに、ラミニン-411のインテグリン結合領域であるラミニン-411E8においても、髄鞘形成促進効果が確認されました。
最後に、ラミニン-411E8内で同定されていた、10種類の細胞接着アミノ酸配列からなる合成ペプチド(各々12アミノ酸)[参考文献5]の効果を検証したところ、A4G47(RAYFNGQSFIAS(アミノ酸一文字表記[用語8])において、アミノ酸配列依存的な髄鞘形成活性が見られました。
社会的インパクト
ECMタンパク質であるラミニン-411から、わずか12アミノ酸で構成されるペプチドA4G47を同定できたことにより、さまざまな応用研究が可能になることが期待されます。最終的には、多発性硬化症をはじめとする脱髄疾患や、近年注目されているアルツハイマー病、うつ病などの精神疾患における髄鞘機能異常の改善、さらには加齢による脳機能低下の改善にも寄与する可能性が考えられます。
今後の展開
ラミニン-411やA4G47を介したオリゴデンドロサイトの髄鞘形成に関する詳細な分子メカニズムの解明と、上述のような応用研究を目指した発展的な研究を展開していく予定です。
付記
本研究は、主に以下の研究助成の支援を受けて実施されました。
- 日本学術振興会 科学研究費助成事業(20K07756、20KK0188、23721401、24K10486)
- 日本医療研究開発機構(JP24gk0210041)
- 住友財団(200490)
- 武田科学振興財団
- 稲盛財団
参考文献
- [1]
- Depp et al, 2023, Nature:Myelin dysfunction drives amyloid-β deposition in models of Alzheimer's disease
- [2]
- Kaya et al, 2023, Nature Neuroscience:CD8+ T cells induce interferon-responsive oligodendrocytes and microglia in white matter aging
- [3]
- Sasmita et al, 2024, Nature Neuroscience:Oligodendrocytes produce amyloid-β and contribute to plaque formation alongside neurons in Alzheimer's disease model mice
- [4]
- Yamada et al, 2022, Frontiers in Cell and Developmental Biology:The Molecular Regulation of Oligodendrocyte Development and CNS Myelination by ECM Proteins
- [5]
- Katagiri et al, 2012, Archives of Biochemistry and Biophysics:Screening of Integrin-Binding Peptides From the Laminin α4 and α5 Chain G Domain Peptide Library
用語説明
- [用語1]
- 脱髄:一度形成された髄鞘が、何らかの原因によって障害を受け欠落すること。
- [用語2]
- 髄鞘:神経細胞の軸索周囲に形成されるオリゴデンドロサイト(中枢神経系)またはシュワン細胞(末梢神経系)の細胞膜の多層構造。主成分が水である細胞質をほとんど含まず、細胞膜の脂質が豊富な構造となるため、電気的な絶縁体として機能する。
- [用語3]
- 細胞外マトリックス(Extracellular matrix: ECM):生体組織内の細胞以外の部分(間質)に存在する主にタンパク質や糖質からなる組織成分。細胞の正常または病的な状態変化に影響を及ぼす環境となる。
- [用語4]
- ラミニン:主に基底膜に存在する細胞に直接作用するECMタンパク質。α、β、γの3種類のサブユニットから構成され、その組み合わせにより、15種類以上のサブタイプ(アイソフォーム)が知られている。
- [用語5]
- オリゴデンドロサイト:中枢神経系で髄鞘を形成する細胞。
- [用語6]
- インテグリン:多くのECMタンパク質と結合する細胞表面の受容体。
- [用語7]
- ペプチド:アミノ酸が2〜数十個連結された生体高分子。化学的組成は同じだが、数十個以上のアミノ酸が連結して立体構造を取るタンパク質とは区別して表現されることが多い。
- [用語8]
- アミノ酸一文字表記:20種類存在するアミノ酸をアルファベット一文字で表記する方法。(R:アルギニン、A:アラニン、Y:チロシン、F:フェニルアラニン、N:アスパラギン、G:グリシン、Q:グルタミン、S:セリン、I:イソロイシン)
論文情報
- 掲載誌:
- GLIA
- タイトル:
- Myelin Formation by Oligodendrocytes Is Enhanced Through Laminin-411 and Its Derived Peptide
- 著者:
- Binri Sasaki, Momo Oishi, Tomoka Aoki, Mai Hyodo, Chinami Onchi, Nanako Yamada, Hitomo Misawa, Momona Yamada, Chikako Hayashi, Kiyotoshi Sekiguchi, Keisuke Hamada, Yuji Yamada, Yamato Kikkawa, Motoyoshi Nomizu, and Nobuharu Suzuki
- DOI:
- 10.1002/glia.70027
研究者プロフィール
佐々木 敏莉 Binri SASAKI
東京科学大学 大学院医歯学総合研究科 臨床分析・分子生物学分野 大学院生
研究分野:分子生物学、神経科学
大石 桃 Momo OISHI
東京科学大学 大学院医歯学総合研究科 臨床分析・分子生物学分野(旧遺伝子細胞検査学分野) 大学院生(当時)
研究分野:分子生物学、神経科学
青木 智花 Tomoka AOKI
東京科学大学 大学院医歯学総合研究科 臨床分析・分子生物学分野 大学院生
研究分野:分子生物学、神経科学
兵頭 舞 Mai HYODO
東京科学大学 大学院医歯学総合研究科 臨床分析・分子生物学分野(旧遺伝子細胞検査学分野) 大学院生(当時)
研究分野:分子生物学、神経科学
恩知 千菜美 Chinami ONCHI
東京科学大学 大学院医歯学総合研究科 臨床分析・分子生物学分野(旧遺伝子細胞検査学分野) 大学院生(当時)
研究分野:分子生物学、神経科学
山田 渚湖 Nanako YAMADA
東京科学大学 大学院医歯学総合研究科 臨床分析・分子生物学分野 大学院生
研究分野:分子生物学、神経科学
三澤 瞳 Hitomi MISAWA
東京科学大学 大学院医歯学総合研究科 臨床分析・分子生物学分野 大学院生
研究分野:分子生物学、神経科学
山田 桃奈 Momona YAMADA
東京科学大学 大学院医歯学総合研究科 臨床分析・分子生物学分野(旧遺伝子細胞検査学分野) 大学院生(当時)
研究分野:分子生物学、神経科学
林 千香子 Chikako HAYASHI
東京科学大学 大学院医歯学総合研究科 臨床分析・分子生物学分野(旧遺伝子細胞検査学分野) 大学院生(当時)
研究分野:分子生物学、神経科学
関口 清俊 Kiyotoshi SEKIGUCHI
大阪大学 蛋白質研究所 寄附研究部門教授
研究分野:生化学、細胞生物学
濵田 圭祐 Keisuke HAMADA
東京薬科大学 薬学部 病態生化学教室 助教
研究分野:生体分子化学
山田 雄二 Yuji YAMADA
東京薬科大学 薬学部 病態生化学教室 講師
研究分野:生体分子化学
吉川 大和 Yamato KIKKAWA
東京薬科大学 薬学部 病態生化学教室 准教授
研究分野:細胞生物学、生化学
野水 基義 Motoyoshi NOMIZU
東京薬科大学 薬学部 病態生化学教室 教授(当時)
研究分野:生体分子化学、細胞生物学
鈴木 喜晴 Nobuharu SUZUKI
東京科学大学 大学院医歯学総合研究科 臨床分析・分子生物学分野(旧遺伝子細胞検査学分野) 准教授
研究分野:分子生物学、神経科学