ポイント
- 免疫受容体LGP2が、ウイルスRNA上を移動しながらMDA5の活性化を開始する新しい分子メカニズムを解明
- LGP2はウイルスRNA上でMDA5の足場となり、短いRNA上でも効率的なMDA5フィラメント形成と免疫シグナル活性化を促進することを提示
- 本成果は、ウイルスRNA認識の理解を深めるとともに、より安全で効果的なmRNAワクチン設計への応用に期待
概要
東京科学大学(Science Tokyo)総合研究院 免疫機構研究ユニットの加藤一希テニュアトラック准教授と、東京大学 理学系研究科の濡木理教授、栗原新奈大学院生(研究当時)らの研究チームは、免疫受容体LGP2がウイルス感染を検知し、宿主の免疫を活性化させる仕組みを明らかにしました。
私たちの身体には、免疫受容体がウイルスや細菌などの病原体の感染を検知し、免疫応答を活性化させる仕組みが備わっています。中でも、MDA5やLGP2と呼ばれる免疫受容体は、細胞内でウイルス由来RNAを検知し、強力な免疫応答を引き起こします。この過程において、LGP2とMDA5が協調してウイルスRNAを認識することは知られていましたが、具体的にどのように作用するのかは分かっていませんでした。
そこで研究グループは、LGP2およびMDA5タンパク質とウイルス様RNAをさまざまな条件で混合し、どのような構造体が形成されるかを調べました。高速原子間力顕微鏡[用語1]を用いてLGP2とウイルス様RNAの混合物を観察したところ、LGP2がウイルスRNA上を移動する様子が観察されました。さらに、LGP2とMDA5を混合すると、それらがウイルス様RNAとともに短い凝集体構造を形成することが明らかになりました。
次に、クライオ電子顕微鏡[用語2]を用いてこの凝集体構造の立体構造を解析したところ、LGP2を起点として、複数のMDA5タンパク質がRNAに沿って規則正しく配向し、フィラメントと呼ばれる構造体を形成していることが分かりました。これらの結果から、LGP2がMDA5のフィラメント化を促進することが明らかになりました。
以上より、LGP2がウイルスRNAを認識し、MDA5と協調して免疫応答を活性化する仕組みが明らかになりました。本成果を応用することで、より安全で有効性の高いRNAワクチンの開発につながることが期待されます。
本研究成果は、1月19日(米国東部標準時)付で、国際学術誌「Molecular Cell 」にオンライン掲載されました。
背景
私たちの身体には、ウイルスや細菌などの病原体の侵入を検知し、排除しようとする「自然免疫」という仕組みが備わっています。細胞内に侵入したウイルスのRNAを検知するセンサーとして機能するのが、RIG-I様受容体(RLR)と呼ばれるタンパク質ファミリーです。このファミリーの1つであるMDA5は、ウイルス増殖の過程で生じる長い二本鎖RNA(dsRNA)を認識し、自身が数珠つなぎに連なった「フィラメント」と呼ばれる構造を形成することで、免疫応答を活性化させます。
一方、LGP2という受容体は、MDA5によるRNA認識を助けることが知られていましたが、LGP2自身はシグナル伝達に必要なドメインを欠いているため、どのようにMDA5をサポートしているのか、その具体的な分子メカニズムは長年の謎でした。
研究成果
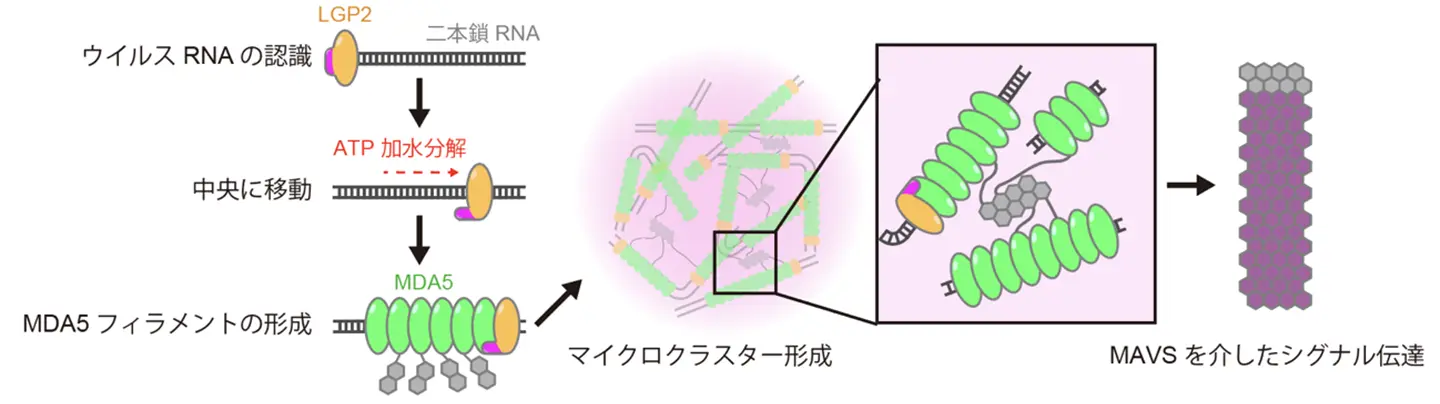
本研究チームは、生化学的解析、クライオ電子顕微鏡(クライオ電顕)、および高速原子間力顕微鏡(HS-AFM)を組み合わせることで、LGP2がMDA5を活性化させるメカニズムを明らかにしました。HS-AFMを用いた観察により、LGP2が二本鎖RNA(dsRNA)の末端に結合した後、ATPのエネルギーを利用してRNA上を移動(トランスロケーション)する様子を直接捉えることに成功しました。
クライオ電顕による構造解析から、RNA上を移動したLGP2が、後続するMDA5分子を呼び込むための「足場」として機能することが判明しました(図1)。LGP2が起点となることで、通常はMDA5が反応しにくい短いdsRNA上においても、効率的にフィラメント形成(核形成)が誘導されます。
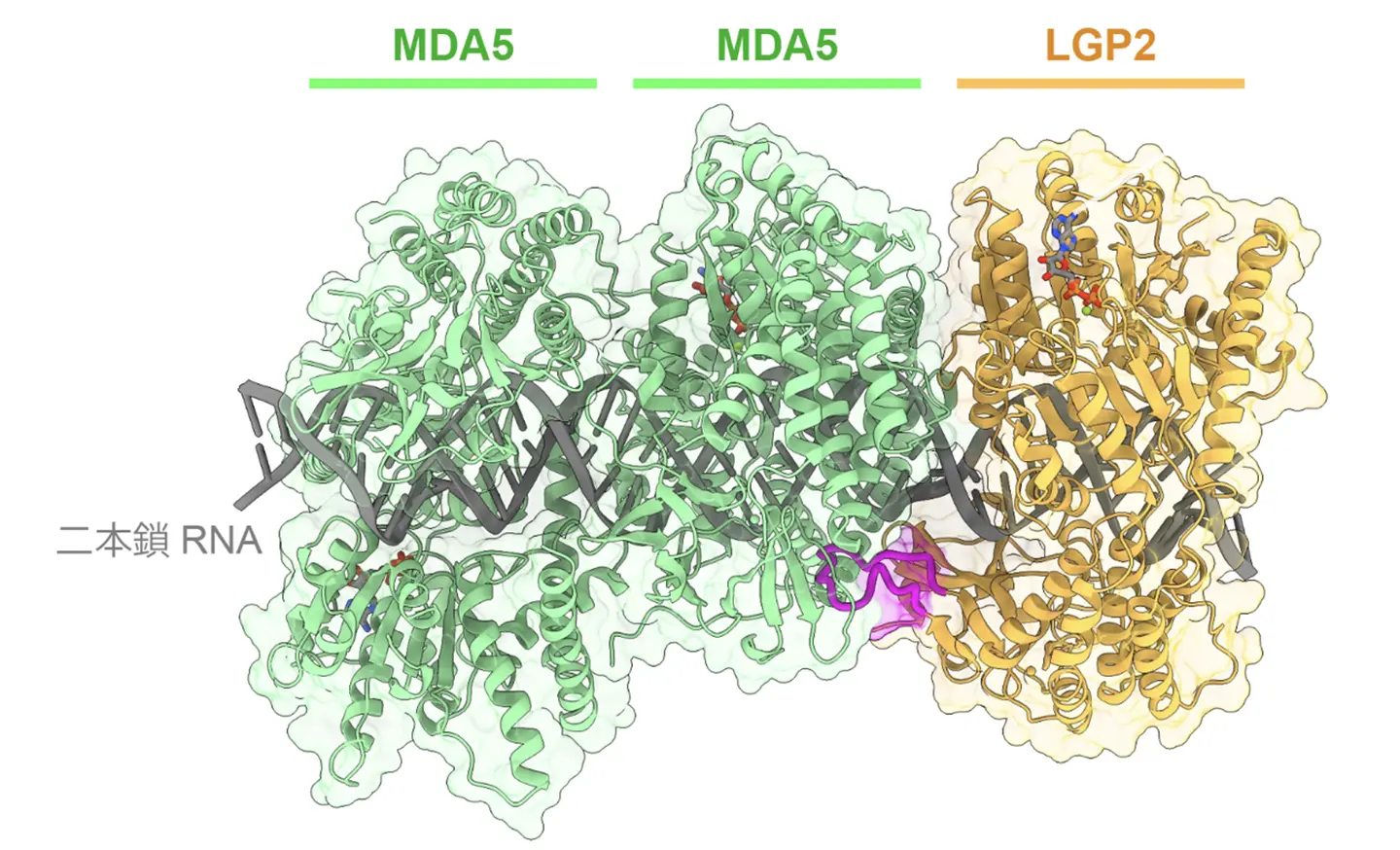
さらに、LGP2によって形成された短いフィラメント同士が、MDA5の2CARDドメインを介して架橋されることで、「マイクロクラスター」と呼ばれる構造体を形成することが明らかになりました。このクラスターがシグナル伝達の足場となり、下流のMAVSタンパク質の重合を強力に促進することで、抗ウイルス応答が引き起こされます(図2)。
社会的インパクト
本研究による発見は、ウイルス感染に対する生体防御の基本原理を明らかにしたものです。ウイルスが生成する多様な配列や構造をもつRNAを、免疫システムがどのようにして漏れなく検知しているのかを説明する重要な知見となります。
今後の展開
本研究の成果は、免疫受容体を人為的に制御する技術の基盤となり、より安全で効果的なmRNAワクチンの設計や、免疫応答を調節する新たな治療薬の開発につながることが期待されます。
付記
この研究は、武田科学振興財団、上原記念生命科学財団、第一三共生命科学財団、AMED BINDS、並びにJSPS科研費(23H04768, 25H01315)の支援のもとで行われたものです。
用語説明
- [用語1]
- 高速原子間力顕微鏡(HS-AFM): 非常に細い針で試料表面をなぞることで、タンパク質などの微細な分子が動く様子を、液中でリアルタイムに観察できる顕微鏡。
- [用語2]
- クライオ電子顕微鏡:タンパク質などの生体分子を水溶液中で急速凍結し、電子顕微鏡で観察する手法。原子に近い解像度でタンパク質の立体構造を決定できる。
論文情報
- 掲載誌:
- Molecular Cell
- タイトル:
- Molecular mechanism of MDA5 nucleation and filament formation by LGP2
- 著者:
- Nina Kurihara, Yukari Isayama, Jiayang Zhang, Takashi Yamashita, Kentaro Awaji, Yukiko Ito, Ayumi Yoshizaki, Takahisa Kouwaki, Hiroyuki Oshiumi, Hiroshi Nishimasu, Mikihiro Shibata, Osamu Nureki*, Kazuki Kato*
*Correspondence
研究者プロフィール
加藤 一希 Kazuki Kato
東京科学大学 総合研究院 免疫機構研究ユニット テニュアトラック准教授
研究分野:免疫学、生化学、構造生物学
栗原 新奈 Nina Kurihara
東京科学大学 総合研究院 免疫機構研究ユニット 外部研究生(研究当時)
研究分野:免疫学、生化学、構造生物学