ポイント
- オートファゴソームの新生過程の一部を試験管内で再現。
- たんぱく質液滴が酵素反応を促進し、オートファゴソームの種となる膜小胞を集める仕組みを解明。
- 本研究で解明されたオートファジーの始まるメカニズムは、高い特異性を持ったオートファジー促進剤創出の基盤的知見となることに期待。
概要
北海道大学 遺伝子病制御研究所の藤岡優子准教授および野田展生教授、東京科学大学(Science Tokyo) 総合研究院 細胞制御工学研究センターの中戸川仁教授らの研究グループは、オートファジーの中核であるオートファゴソーム[用語1]新生の初期過程を試験管内で再構成することに成功し、液−液相分離[用語2]によりオートファジーが始まるメカニズムの詳細を明らかにすることに成功しました。
オートファジーとは、有害凝集体や損傷ミトコンドリアなどの分解を行う現象であり、細胞の恒常性を維持する役割を持ちます。オートファジーは栄養飢餓などで活性化されますが(=オートファジー誘導)、この異常に伴って神経変性疾患やがんが引き起こされます。
オートファジーが誘導されると、Atgたんぱく質[用語3]が液-液相分離によりPAS[用語4]という液滴[用語5]を作ります。このPAS液滴が作られることで、オートファゴソームの新生が進むと考えられていますが、その機能は未解明でした。
本研究では主要Atgたんぱく質を高純度精製してPAS液滴を試験管で再構成し、各因子の液滴濃縮度を定量比較した結果、Atg8[用語6]の脂質化を担うE3酵素であるAtg12–Atg5–Atg16複合体[用語7]が最も濃縮されることが分かりました。そしてPAS液滴においてAtg8の脂質化が高効率で進行すること、それにともない膜小胞がPAS液滴内部へ取り込まれることが分かりました。
以上の結果から、PAS液滴がAtg8の脂質化を行う場所として働き、オートファゴソームの最初の膜の種であるAtg9小胞[用語8]を集めることで、オートファゴソーム新生を開始するという一連のメカニズムが明らかになりました。本研究の成果は、オートファゴソーム新生の全過程のメカニズム解明と、高い特異性を持ったオートファジー促進剤・阻害剤創出の基盤になることが期待されます。
なお、本研究成果は、2025年9月16日公開の「Nature Structural & Molecular Biology」に掲載されました。
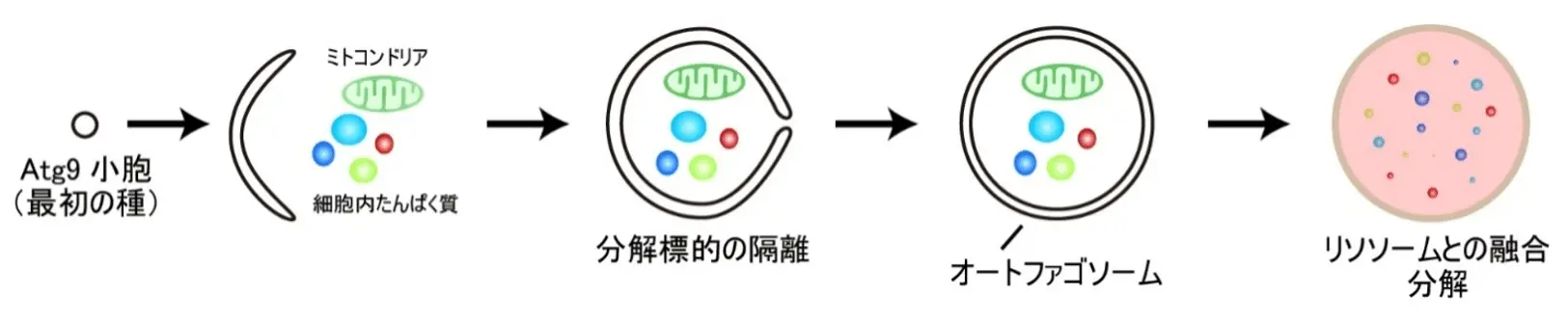
Atg9小胞と呼ばれる膜小胞を最初の種として、分解標的を取り囲みながら膜が拡大し、閉じてオートファゴソームとなる。オートファゴソームはリソソームと融合し、内容物(たんぱく質やミトコンドリアなど)はリソソーム酵素の働きで分解される。
背景
オートファジーは細胞内の主要な分解経路であり、有害なたんぱく質凝集体や傷ついたミトコンドリアなどの分解を通して、細胞の恒常性維持に働いています。そしてオートファジーの異常は神経変性疾患やがんなど、重篤な疾病を引き起こすことが知られています。したがって、オートファジーは、生体にとって極めて基本的かつ重要な現象であり、その仕組みを知ることは疾病の治療や予防法の開発のために欠かせません。
オートファジーでは、オートファゴソームと呼ばれる脂質膜の袋を新たに作り出し、分解対象を包み込んでリソソームへと運び、分解します(図1)。オートファゴソームの新生は、オートファジーにおける最も特徴的かつ基本的な過程であり、多くのAtgたんぱく質が担っています(関連するプレスリリース参照)。栄養飢餓でオートファジーが誘導されると、Atgたんぱく質が液-液相分離と呼ばれる物理現象により集まって、PASと呼ばれる液体状の集合体(液滴)を形成します。そしてこのPAS液滴からオートファゴソームの新生が進むと考えられてきましたが、その際PAS液滴が具体的にどのような役割を担うのかは分かっていませんでした。
研究手法
すべての主要Atgたんぱく質を高純度に精製し、それぞれ蛍光色素で標識しました。そしてこれらの精製たんぱく質を用いてPAS液滴を試験管内で再構成し、蛍光顕微鏡を用いて各Atgたんぱく質のPAS液滴への濃縮度合いを調べました。
またオートファゴソームの種として働くと考えられているAtg9小胞を模倣した膜小胞を、様々な脂質分子を混ぜ合わせることで作成し、この再構成系に導入しました。そしてPAS液滴における膜小胞への修飾反応を生化学的手法で調べるとともに、膜小胞とPAS液滴の相互作用を蛍光顕微鏡やレプリカ電子顕微鏡を用いて調べました。
研究成果
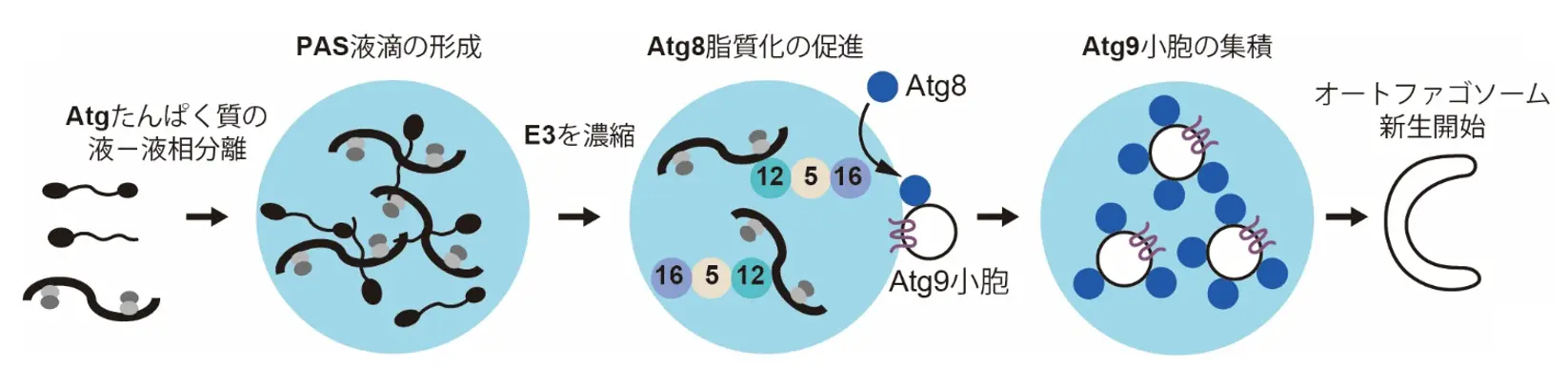
試験管内で再構成したPAS液滴に対する各Atgたんぱく質の濃縮度を定量して比較した結果、Atg12-Atg5-Atg16複合体が最も効率的に濃縮されることが分かりました。この複合体はAtg8というたんぱく質と、膜を構成するリン脂質の一つであるホスファチジルエタノールアミンとの間で共有結合を形成させるE3酵素として知られており、このAtg8の脂質化反応はオートファジーの進行にとても重要です。
そこでAtg8の脂質化反応に必要なあと2種類の酵素(E1とE2)およびATP、さらにAtg9小胞を模倣した膜小胞(成分としてホスファチジルエタノールアミンを含む)を、E3が濃縮したPAS液滴に混合したところ、Atg8の脂質化反応がPAS液滴において効率的に進行しました(図2中央)。さらにその際のPAS液滴と膜小胞の位置関係を調べたところ、PAS液滴の表面に来た膜小胞が、Atg8の脂質化が進むにつれてPAS液滴の内部へと移行しました(図2右)。
これらの成果から、PAS液滴がAtg8の脂質化を行う場所として働き、オートファゴソームの最初の膜の種であるAtg9小胞を集めることで、オートファゴソーム新生を開始するという一連のメカニズムが明らかとなりました。
今後への期待
本研究は、オートファゴソーム新生の初期過程を試験管内で再構成することに初めて成功しました。オートファゴソーム新生の全過程の分子機構の理解につながることが期待できます。また本研究で明らかになったオートファジー新生の開始メカニズムは、高い特異性を持ったオートファジー促進剤や阻害剤の開発基盤になることが期待されます。
謝辞
本研究は、JSPS科研費JP21H05731、JP23H02429、JP23H04923、JP23K27122、JP22K06818、JP22H04654、JP22K06123、JP25K09544、JP22H00446、JP22K19282、JP19H05708、JP25H01322、JP23K20044、JP19H05707、JP24H00060、JP25H00966、JP25H01320、JP25H01321、AMED PRIME JP20gm6410009、JST 戦略的創造研究推進事業CREST JPMJCR20E3、長瀬科学技術振興財団、武田科学振興財団の助成を受けたものです。
用語説明
- [用語1]
- オートファゴソーム:オートファジーが誘導されると、細胞質に新たに作り出される二重膜のオルガネラのことであり、オートファジーにおける最も特徴的かつ基本的な構造体である。オートファゴソームで囲まれたものはリソソームへと運ばれて分解される。
- [用語2]
- 液-液相分離:均一な溶液が複数の液相に分離する現象であり、日常生活でも水と油の分離としてよく観察される。細胞内ではたんぱく質や核酸が液-液相分離することが知られている。
- [用語3]
- Atgたんぱく質:酵母で同定されたオートファジーに関与するたんぱく質群の名称で、これまでに40種類以上報告されている。
- [用語4]
- PAS:プレオートファゴソーム構造体の略。酵母において、栄養飢餓になると液胞近傍の1ヵ所にAtgたんぱく質が集まるが、この集まった構造を指す。
- [用語5]
- 液滴:たんぱく質や核酸が液-液相分離することで形成した液体状の会合体。液滴は膜のないオルガネラとも呼ばれ、細胞内で様々な機能を担っている。
- [用語6]
- Atg8:ユビキチンと類似したたんぱく質で、E1、E2、E3酵素の働きで脂質修飾されることでオートファジーに働く。
- [用語7]
- Atg12-Atg5-Atg16複合体:Atg8の脂質修飾を担うE3酵素のこと。この複合体自体がE1、E2酵素の働きでAtg12とAtg5が共有結合することで形成される。
- [用語8]
- Atg9小胞:ゴルジ体で形成される、膜たんぱく質Atg9を含んだ膜小胞のこと。オートファゴソーム新生の最初の膜の種として働くと考えられている。
論文情報
- 掲載誌:
- Nature Structural & Molecular Biology(構造生物学、分子生物学の専門誌)
- タイトル:
- Phase separation promotes Atg8 lipidation and vesicle condensation for autophagy progression(相分離は、オートファジーの進行に向けてAtg8の脂質化と小胞の凝縮を促進する)
- 著者:
- Yuko Fujioka1、Takuma Tsuji1、Tetsuya Kotani2、Hiroyuki Kumeta3、Chika Kakuta2、Junko Shimasaki2、Toyoshi Fujimoto4、Hitoshi Nakatogawa2、Nobuo N. Noda1,5(1北海道大学遺伝子病制御研究所、2東京科学大学総合研究院、3北海道大学大学院先端生命科学研究院、4順天堂大学大学院医学研究科、5公益財団法人微生物化学研究会微生物化学研究所)
- 公表日:
- 2025年9月16日(オンライン公開)
関連リンク
北海道大学 遺伝子病制御研究所
准教授 藤岡 優子
- Tel
- 011-706-7826
- Fax
- 011-706-7826
東京科学大学 総合研究院 細胞制御工学研究センター
教授 中戸川仁
- Tel
- 045-924-5735
- Fax
- 045-924-5743
JST事業に関すること
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
沖代 美保
- crest@jst.go.jp
- Tel
- 03-3512-3524
- Fax
- 03-3222-2064