ポイント
- アレルギーを引き起こす免疫細胞「好塩基球」において、RNA結合タンパク質「トリステトラプロリン(TTP)」が炎症分子の産生を抑制するブレーキ役であることを発見しました。
- アトピー性皮膚炎のマウスモデルにおいて、TTPが好塩基球における皮膚アレルギー炎症を抑制する鍵分子であることを明らかにしました。
- 好塩基球のTTPやmRNA転写後調節をターゲットにした新しいアレルギー治療法開発への応用が期待されます。
概要
東京科学大学(Science Tokyo)※ 総合研究院の伊藤潤哉(大学院生)、三宅健介准教授、烏山一特任教授らの研究チームは、システム発生・再生医学分野の淺原弘嗣教授および米国国立環境衛生科学研究所(NIEHS)との共同研究により、RNA結合タンパク質[用語1]のトリステトラプロリン(TTP:Tristetraprolin)が、希少な免疫細胞である好塩基球[用語2]におけるアレルギー反応のブレーキ役として機能することを明らかにしました。
好塩基球は、血液中の白血球にわずか0.5%程しか存在しない希少な細胞ですが、近年の研究によりアレルギーや寄生虫感染など、さまざまな疾患に関わる重要な細胞であることが判明しています。しかし、これまで好塩基球の活性化を制御する分子メカニズムについては、よく理解されていませんでした。
本研究により、TTPが好塩基球の活性化を制御する重要な分子であることが明らかになり、今後、好塩基球のTTPを標的とする新しいアレルギー治療法の開発につながることが期待されます。
本成果は、11月15日付(英国時間)で「Allergology International」誌にオンライン発表されました。
- 2024年10月1日に東京医科歯科大学と東京工業大学が統合し、東京科学大学(Science Tokyo)となりました。
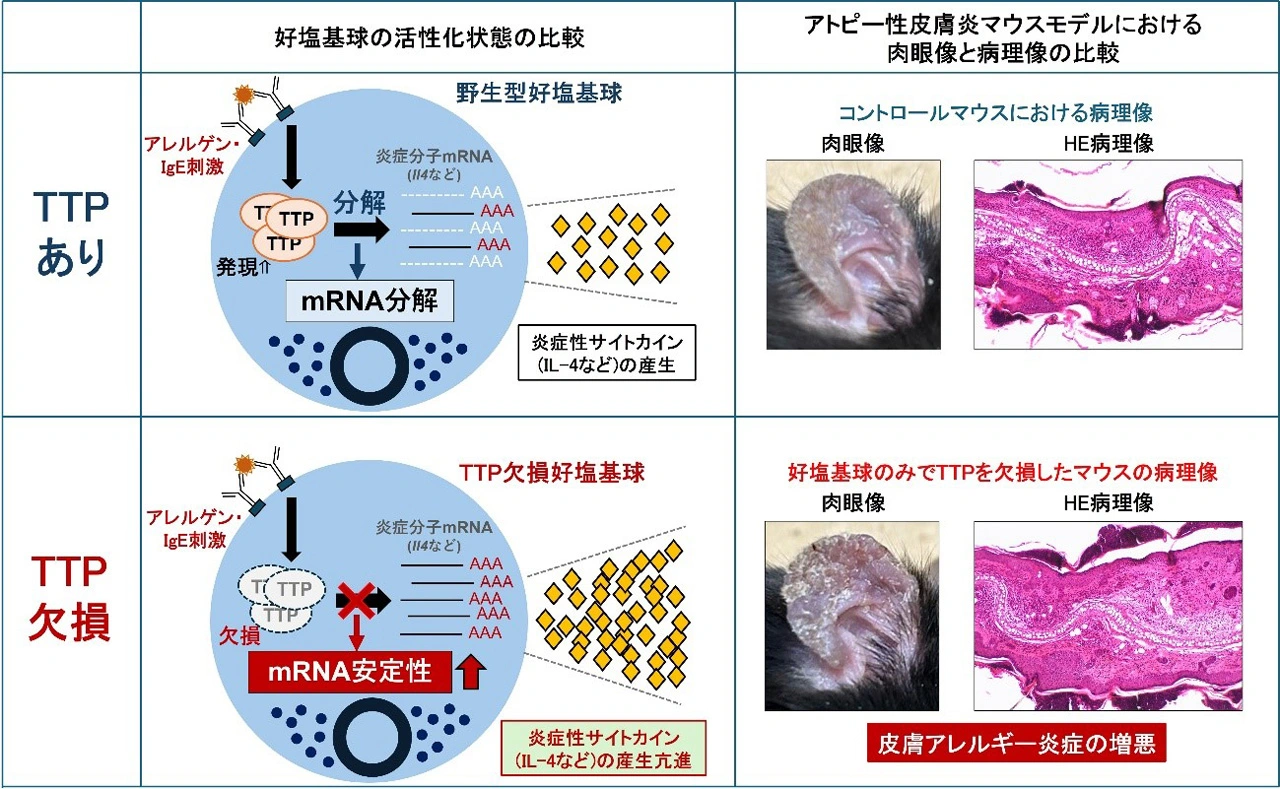
好塩基球が活性化すると、TTPの発現が誘導され、炎症分子のmRNAの転写後の分解を促し、好塩基球の過剰な活性化を防ぐ。このTTPが欠損した場合、TTPによって抑えられていた炎症分子の産生量は増加するため、結果として、好塩基球が関与する皮膚アレルギー炎症は悪化する。
背景
好塩基球は、末梢血中の白血球の中でわずか0.5%ほどしか存在しない希少な免疫細胞です。その数の少なさもあって、長い間、好塩基球が生体内でどのような役割を果たしているのかについてはよく分かっていませんでした。しかし、ここ10年ほどで私たちの研究室をはじめとする複数の研究グループが好塩基球に関する研究ツールの整備が進んだことで、好塩基球がアレルギーや寄生虫感染などにおいて重要な役割を担っていることが明らかになってきました。
好塩基球が活性化すると、炎症性サイトカインであるインターロイキン4(IL-4)[用語3]をはじめとするさまざまな炎症分子を産生し、アレルギーなどのさまざまな免疫反応に関与します。好塩基球の活性化を制御する分子メカニズムが解明されれば、好塩基球を標的とする新しい治療薬の開発につながると期待されますが、これまでそのメカニズムはほとんど解明されていませんでした。
マクロファージなど、好塩基球以外の免疫細胞においては、RNA結合タンパク質による転写後調節機構が知られています。免疫細胞が活性化すると、炎症分子のmRNAが転写され免疫応答が引き起こされますが、その後も炎症分子のmRNAが細胞内に残り続けると、過剰な免疫応答によって自己組織が損傷を受ける可能性があります。これを防ぐために、RNA結合タンパク質が一度転写されたmRNAの分解を促す「ブレーキ役」として働き、免疫応答を収束させるように制御しています。しかし、好塩基球において、どのRNA結合タンパク質が関与しているのかは、まったく明らかにされていませんでした。
そこで、研究グループは好塩基球の活性化を制御するRNA結合タンパク質を特定し、その役割を解明することを目指して研究を行いました。
研究成果
研究グループはまず、好塩基球の活性化を制御するRNA結合タンパク質の候補を特定するため、好塩基球の活性化に伴って発現量が変化するRNA結合タンパク質を調べた結果、RNA結合タンパク質であるTTPが、活性化に伴い発現量が増加することが判明しました。そこで、研究グループはTTP欠損マウスを作成し、好塩基球におけるTTPの機能を解析しました。その結果、TTPを欠損した好塩基球では、野生型の好塩基球と比較して、活性化時にIL-4などの炎症性サイトカインやケモカインのmRNA発現量が増加していることが分かりました。さらに、TTP欠損好塩基球では、これらの炎症性サイトカインやケモカインのタンパク質産生も増加していることが確認されました。以上の結果から、TTPは活性化した好塩基球において炎症性分子の発現を抑制する役割を果たしていることが明らかになりました。
続いて研究グループは、好塩基球におけるTTPがどのようにして炎症分子の発現を抑制しているのか、そのメカニズムを解明しました。TTPは他の細胞においてmRNAの分解を促進することが知られているため、好塩基球においてもTTPがmRNAの分解に関与しているのか調べました。ゲノム全体のあらゆるmRNAの転写後の分解速度を解析したところ、TTP欠損好塩基球ではIL-4などの炎症性サイトカインやケモカインのmRNAの転写後の分解速度が野生型と比べて遅くなっていることが分かりました。この結果から、好塩基球においてTTPはmRNAの分解を促進することで炎症分子の発現を抑制していることが示されました。
最後に研究グループは、好塩基球のTTPが実際のアレルギー反応においても重要な役割を果たしているかを確認するため、好塩基球のみでTTPが欠損しているマウスを作成し、このマウスにアトピー性皮膚炎モデル[用語4]を誘発しました。その結果、TTP欠損マウスでは、対照群と比較して皮膚炎症が悪化しました。以上の結果から、好塩基球のTTPは皮膚アレルギー反応全体を制御する重要なブレーキ分子であることが明らかになりました。
社会的インパクトおよび今後の展開
本研究により、好塩基球における炎症分子の産生がRNA結合タンパク質TTPによって制御されていることが明らかになり、これまで不明だった好塩基球の活性化を制御するメカニズムの一端が解明されました。好塩基球は、皮膚アレルギーをはじめとするさまざまな病態に関与する重要な細胞であるため、本研究の成果は、好塩基球を標的とした新たな治療法の開発に貢献することが期待されます。
付記
この研究は、文部科学省科学研究費補助金・基金(課題番号:22K007115, 20H05696, 22H02845466)、国立研究開発法人日本医療研究開発機構(AMED)の生命科学・創薬研究支援基盤事業(AMED-BINDS)(課題番号:JP23ama121045)、日本学術振興会特別研究員奨励費(課題番号:23KJ0837)、武田科学振興財団、先進医薬研究振興財団、内藤記念科学振興財団、アステラス病態代謝研究会、第一三共生命科学研究振興財団、化学及血清療法研究所、国立研究開発法人科学技術振興機構ACT-X「生命現象と機能性物質」(課題番号:JPMJAX232I)、旧東京医科歯科大学次世代研究者育成ユニット、旧東京医科歯科大学重点領域研究、および米国国立環境衛生科学研究所の支援のもとでおこなわれたものです。
用語説明
- [用語1]
- RNA結合タンパク質:RNAに結合することでその分解・安定化・修飾などを引き起こすタンパク質の総称。近年の免疫学研究により、免疫細胞においてRNA結合タンパク質が転写されたmRNAの転写後の安定化や不安定化を引き起こすことで、免疫細胞の活性化や炎症分子の産生を緻密に制御していることが解明されている。TTPはRNA結合タンパク質の一つで、マクロファージなどにおいてはmRNAの転写後調節を担うことがすでに報告されている。
- [用語2]
- 好塩基球:末梢血の白血球のうちわずか0.5%程しか存在しない希少な免疫細胞であり、近年アレルギー炎症や寄生虫感染防御に関わる重要な細胞であることが認識されてきている。アレルゲン・IgE刺激などにより活性化し、IL-4などの炎症分子を分泌することでアレルギー炎症を引き起こすことが知られている。
- [用語3]
- インターロイキン4(IL-4):アレルギーを引き起こすサイトカインの一種で、好塩基球やT細胞などが産生する。IL-4は上皮細胞、T細胞、2型自然リンパ球など様々な細胞に作用することで皮膚アレルギーを引き起こすことが明らかになっている。近年、アトピー性皮膚炎や喘息患者に対しての治療薬としてIL-4の作用を阻害する抗体製剤が使用されている。
- [用語4]
- アトピー性皮膚炎モデル:ヒトのアトピー性皮膚炎を模倣したマウスモデルがいくつか開発されている。その中でも、本研究ではハプテン(キャリアタンパク質と結合して免疫反応を起こす低分子物質)の一種であるオキサゾロンをマウスの耳介に頻回に塗布するモデルを採用した。研究グループの以前の報告により、このモデルでは皮膚に浸潤した好塩基球の産生するIL-4が炎症増悪に寄与することが明らかとなっている。
論文情報
- 掲載誌:
- Allergology International
- 論文タイトル:
- Tristetraprolin-mediated mRNA destabilization regulates basophil inflammatory responses
- 著者:
- Junya Ito, Kensuke Miyake, Tomoki Chiba, Kazufusa Takahashi, Yutaro Uchida, Perry J. Blackshear, Hiroshi Asahara and Hajime Karasuyama
研究者プロフィール
伊藤 潤哉 Junya ITO
東京科学大学 総合研究院
大学院医歯学総合研究科 システム発生・再生医学分野
MD-PhDコース大学院生
研究分野:免疫学、アレルギー学

三宅 健介 Kensuke MIYAKE
東京科学大学 総合研究院 准教授
研究分野:免疫学、アレルギー学

烏山 一 Hajime KARASUYAMA
東京科学大学 総合研究院 特任教授
研究分野:免疫学、アレルギー学

淺原 弘嗣 Hiroshi ASAHARA
東京科学大学 大学院医歯学総合研究科
システム発生・再生医学分野 教授
研究分野:分子生物学(遺伝子発現)、発生・再生医学、整形外科学、リウマチ学

関連リンク
お問い合わせ
東京科学大学 総合研究院 大学院医歯学総合研究科
准教授 三宅 健介
- Tel
- 03-5803-4029
- Fax
- 03-5803-4029
- miyake.mbch@tmd.ac.jp