新しい数値指標『siRMSD』で副作用を予測し、安全なsiRNA医薬の設計へ
化学修飾による分子の形の変化を数値化し、副作用(オフターゲット効果)の仕組みを解明
ポイント
- siRNAの化学修飾による「分子のゆがみ」を数値化する新指標「siRMSD」を開発。
- 分子シミュレーションでAGO2タンパク質内のsiRNA構造変化を解析し、副作用の強さと相関することを確認。
- 副作用の原因が「結合の強さ」だけでなく「構造の変化」にあることを初めて実証。
- 副作用が少なく安全なsiRNA医薬の新しい設計原理を提示。
概要
東京科学大学(Science Tokyo)国際医工共創研究院 核酸・ペプチド創薬治療研究センターの安成鎮特任研究員、程久美子特任教授(兼務:東京大学 大学院理学系研究科)、名古屋大学 大学院理学研究科 物質理学専攻 化学系の阿部洋教授らの研究チームは、siRNA[用語1]に化学修飾[用語2]を加えたときに、副作用の原因となる「オフターゲット効果[用語3]」がどのように抑えられるかという仕組みを解明しました。
siRNAは「核酸医薬」と呼ばれる新しいタイプの薬の一つで、標的遺伝子の発現を選択的に抑制することができます。しかし一方で、標的遺伝子以外も抑制してしまう、望ましくない効果「オフターゲット効果」を引き起こすことが課題でした。
研究チームは、このオフターゲット効果を生じさせる原因となる「シード領域[用語4]」と呼ばれる部分(siRNAガイド鎖の2〜8番目の塩基)のうち、特に2〜5番目に化学修飾を導入しました。その際、siRNAが体内で働くときに取り込まれるAGO2タンパク質[用語5]表面の溝の中で、構造がどのように変化するかを量子化学計算で解析しました。そして、新しい指標「siRMSD[用語6]」を開発し、その数値の大きさが実際のオフターゲット効果の強さとよく一致することを突き止めました。
この成果は、従来の「mRNAとsiRNAの対合力の強さ」だけでは説明できなかった現象を、「分子の立体構造の変化」という視点から説明できるようにした点で画期的です。 これにより、副作用の少ない安全で効果的なsiRNA医薬品を設計するための新しい道筋が示されました。この研究成果は、2025年9月16日(米国東部時間)付の「Molecular Therapy – Nucleic Acids」誌に掲載されました。
背景
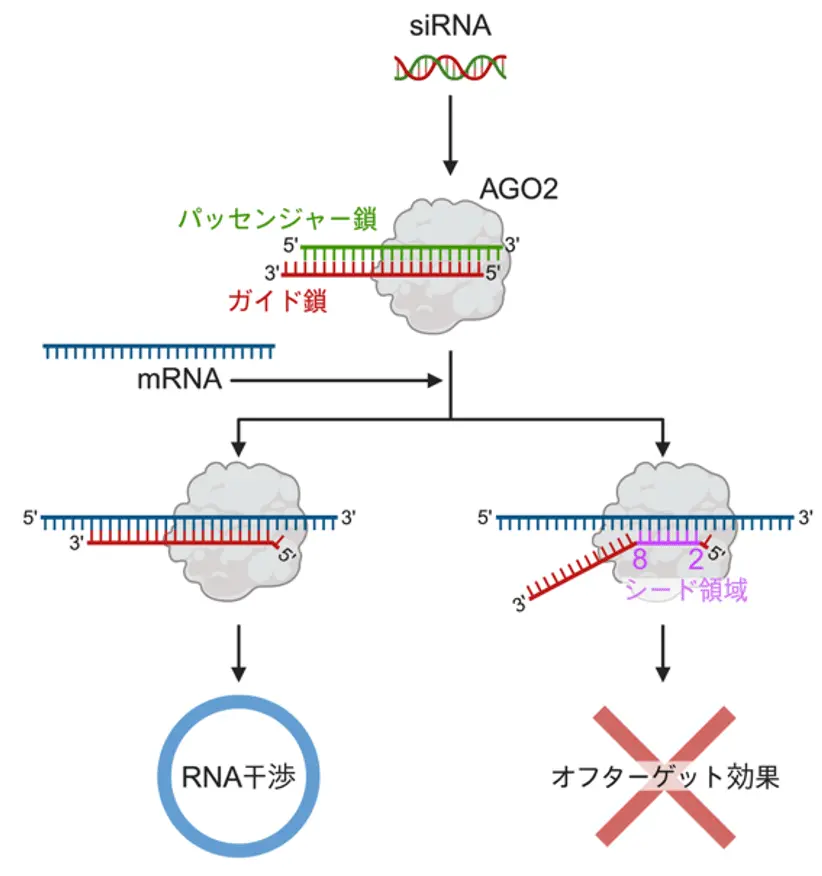
siRNAは、長さが約21塩基の小さな二本鎖RNA分子です。ひとつは「ガイド鎖」と呼ばれ、標的となるmRNAを認識して切断を誘導します。もうひとつは「パッセンジャー鎖」で、ガイド鎖と対になっています(図1)。細胞内でガイド鎖が標的mRNAに対合すると、そのmRNAが分解されて遺伝子発現が抑制されます。この仕組みは「RNA干渉(RNA interference, RNAi)」と呼ばれています[参考文献1]。
この原理を利用すると、疾患関連遺伝子の発現を選択的に阻害するsiRNAを核酸医薬として利用することが可能になります[参考文献2]。
ただし、siRNAは標的のmRNA配列と完全に一致しない場合でも結合してしまい、関係のない遺伝子まで抑えてしまうことがあります。これが「オフターゲット効果」と呼ばれるもので、siRNA医薬の安全性と精度を低下させる副作用の原因となる可能性があり、副作用の原因となり、siRNA医薬の安全性や精度を下げる大きな課題になっています[参考文献3]。
これまでの研究で、オフターゲット効果は特にガイド鎖の2~8番目の塩基(「シード領域」と呼ばれる部分)に強く影響されることがわかっています。一方で、私たちは先行研究で、siRNAに特定の化学修飾を加えると、 siRNAが結合するAGO2タンパク質上で構造が変化し、その結果オフターゲット効果が弱まることを示してきました[参考文献4] [参考文献5]。しかし、どのような構造変化がオフターゲット効果の低減につながっているのかは、これまで明らかになっていませんでした。
そこで本研究では、シード領域に化学修飾を加えたsiRNAが、AGO2タンパク質の中でどのように構造を変えるのかを「Gaussian[用語7]」と呼ばれるソフトウェアを用いた構造最適化計算[用語8]で解析しました。その結果、どのような構造変化がオフターゲット効果を弱めるのかを明らかにし、より安全で効果的なsiRNA医薬の設計に役立つ知見を得ることを目的としました。
研究成果
本研究では、化学修飾によって引き起こされるされる副作用「オフターゲット効果」を予測するための新しいパラメータ「siRMSD」を開発し、siRNA治療薬の改良に挑みました。
通常、siRNAは標的とする遺伝子のmRNA配列に塩基配列相補的に対合し、そのmRNAを分解することで遺伝子機能を抑制し、疾患関連遺伝子を標的とした治療を可能とします。しかし実際には、意図しないmRNAにも結合してしまい、予期しない作用「オフターゲット効果」が起こることが臨床応用の大きな課題となっています。
これまでに、化学修飾を加えるとsiRNAの分解に強くなったり、オフターゲット効果が減ることは知られていましたが、その根本的なメカニズムはよくわかっていませんでした。
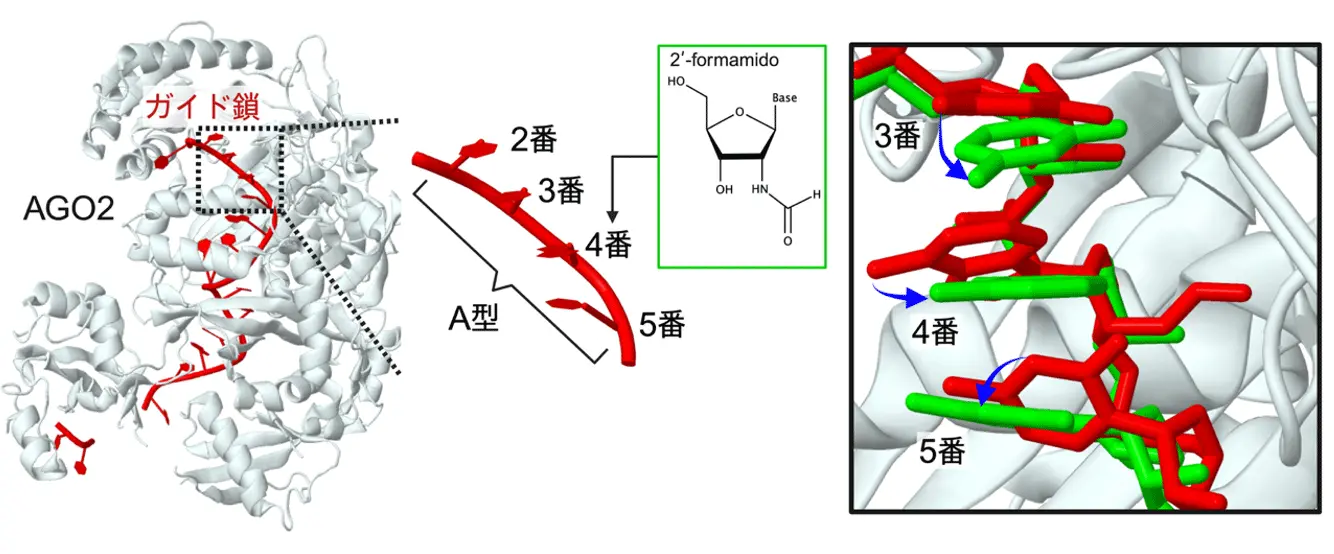
本研究では、化学修飾によって生じる「分子構造的なゆがみ」がオフターゲット効果を決定づけることを明らかにしました。具体的には、2'-O-メトキシエチル、2'-O-メチル、2'-ホルムアミドといった化学修飾をガイド鎖の2〜5番目の塩基に導入すると、siRNAが結合するAGO2タンパク質の中で本来の二重らせん構造(A型RNA二重らせん[用語9]が崩れ(図2)、標的mRNAとの安定した塩基対合が妨げられることがわかりました。一方で、6〜8番目の塩基に化学修飾を加えた場合には、構造的なゆがみはほとんど起こらず、むしろ「結合の安定性(熱力学的安定性)」が影響していると考えられました。
社会的インパクト
今回開発した「siRMSD」という指標は、siRNAに化学修飾を加えたときに分子構造に与える影響を定量的に評価できる初めての方法です。これにより、オフターゲット効果を弱める構造的要因を明確に示すことができました。
この指標は、新しく設計される化学修飾siRNAにもすぐに応用でき、研究の初期段階から安全性を予測したり、候補化合物のスクリーニングを迅速化することが可能になります。その結果、より安全で精度の高いsiRNA医薬を、これまでより短い期間と低いコストで開発できるようになることが期待されます。
さらに、この成果はsiRNAにとどまらず、RNA医薬全体の実用化を加速させる可能性があり、革新的な治療法の社会実装に向けた大きな一歩となります。
今後の展開
今回開発した「siRMSD指標」と構造解析の方法をさらに発展させ、今後はさまざまな化学修飾パターンについて、構造変化とオフターゲット効果との関係を体系的に調べる予定です。
特に、すでに実際に使われているsiRNA医薬品の多くは、複数の修飾が連続して組み込まれています。そのため、AGO2タンパク質の上で複数の修飾が互いにどう影響し合うのかを解析し、より正確な「構造と効果の関係」を明らかにすることを目指します。
こうした知見を積み重ねることで、臨床応用に直結するより高度な設計指針を確立し、siRNA医薬品の実用化を加速させることを期待しています。
付記
本研究は、文部科学省科学研究費補助金(21H02465)、公益財団法人日立財団倉田記念日立財団助成金、日本医療研究開発機構(AMED、21ae0121032h0001、25ae0121057h0002、程 久美子) の支援を受けて実施されました。
参考文献
- [1]
- Ralph, G.S., Mazarakis, N.D., and Azzouz, M. (2005). J. Mol. Med., 2005, 83, 413–419.
- [2]
- Hu, B., Zhong, L., Weng, Y., Peng, L., Huang, Y., Zhao, Y., and Liang, X.-J. Signal Transduct. Target. Ther., 2020, 5, 101.
- [3]
- Jackson, A.L., and Linsley, P.S. Nat. Rev. Drug Discov., 2010, 9, 57–67.
- [4]
- Iribe, H., Miyamoto, K., Takahashi, T., Kobayashi, Y., Leo, J., Aida, M., and Ui-Tei, K., ACS Omega, 2017, 2055–2064.
- [5]
- Kobayashi, Y., Fukuhara, D., Akase, D., Aida, M., and Ui-Tei, K., ACS Omega, 2022, 2398-2410
用語説明
- [用語1]
- siRNA(small interfering RNA):長さ約21塩基の二本鎖RNA分子で、片方のRNA鎖が特定の遺伝子のmRNAと相補的に塩基対を形成し、そのmRNAをAGO2タンパク質が分解することで遺伝子発現を抑制する。核酸医薬としてアンチセンス核酸やmicroRNAと並び注目されている。
- [用語2]
- 化学修飾:分子の構造に特定の原子や官能基を付加・置換することで、性質や機能を変化させる技術。siRNAの場合、安定性の向上、分解酵素からの保護、標的との結合性や選択性の調整などを目的として使用されている。
- [用語3]
- オフターゲット効果:本来の標的とするmRNA以外の部分的に相補的な配列をもつmRNAに結合し、その遺伝子の発現を予期せず抑制してしまう現象。siRNA核酸医薬品としては副作用ととらえられる。
- [用語4]
- シード領域:siRNAガイド鎖の2〜8番目の塩基配列で、AGO2タンパク質の溝状構造にはまる領域であり、最初にmRNAと対合する部分と考えられており、オフターゲット効果の主要因となる。
- [用語5]
- AGO2(Argonaute 2)タンパク質:RNA干渉(RNAi)で中核となるタンパク質。siRNAやmiRNAをガイドとして標的mRNAを切断する。
- [用語6]
- siRMSD(Root Mean Square Deviation for siRNA):本研究で新たに開発した指標で、化学修飾によるsiRNA構造変化の大きさを3次元座標の二乗平均平方根偏差として定量化したもの。
- [用語7]
- Gaussian:分子の構造最適化やエネルギー計算を行う量子化学計算ソフトウェア。
- [用語8]
- 構造最適化計算:分子のエネルギーが最小となる構造を探索する計算手法。
- [用語9]
- A型RNA二重らせん:RNA二重鎖がとる安定した立体構造の一種。
論文情報
- 掲載誌:
- Molecular Therapy – Nucleic Acid
- タイトル:
- An siRMSD parameter of structural distortion induced by chemical modification is predictive of the off-target effect of siRNA
- 著者:
- Seongjin An, Kohei Nomura, Yoshiaki Kobayashi, Yasuaki Kimura, Hiroshi Abe, Kumiko Ui-Tei
研究者プロフィール
安 成鎮 Seongjin An
東京科学大学 国際医工共創研究院
核酸・ペプチド創薬治療研究センター 研究員
研究分野:siRNA、核酸医薬
程 久美子 Kumiko Ui-Tei
東京科学大学 国際医工共創研究院
核酸・ペプチド創薬治療研究センター 特任教授
研究分野:siRNA、miRNA、核酸医薬、生物情報科学