ポイント
- IgG1抗体のヒンジ領域を改変すると抗体が半分に分かれる現象を発見。
- 核磁気共鳴法などによる原子レベルでの構造解析で、ヒンジ構造の変化が抗体全体の構造と機能に影響することを解明。
- 受容体FcγRIにのみ結合する特性を利用した次世代抗体医薬の設計に期待。
概要
東京科学大学(Science Tokyo) 物質理工学院 材料系の小関悠希大学院生(博士後期課程1年)と同 総合研究院 フロンティア材料研究所の谷中冴子准教授、九州大学 大学院薬学研究院のカアベイロ・ホセ教授、大阪大学 大学院工学研究科の内山進教授、山口祐希助教、自然科学研究機構の加藤晃一教授、村田和義特任教授、名古屋大学 大学院理学研究科/自然科学研究機構 生命創成探究センターの内橋貴之教授らの研究チームは、免疫を担う重要なタンパク質であるIgG1抗体[用語1]において、ヒンジ領域[用語2]が、抗体の柔軟性を生み出すだけでなく、機能制御に深く関わる重要な構造であることを明らかにしました。
ウイルスや細菌を認識し排除する役割を持つ抗体は一般的に「Y字型」をしており、Y字型の腕と胴体はヒンジ領域でつながっています。今回の研究では、IgG1抗体のヒンジ領域に存在するプロリン230(Pro230)[用語3]のアミノ酸残基を1個削除したところ、抗体が「半分の抗体(Half-IgG1[用語4]))」に分かれる現象を確認しました。この結果は、ヒンジ領域が単なる「つなぎ目」ではなく、抗体全体の構造を形づくる要であることを示しています。さらに、このHalf-IgG1は免疫細胞に存在するFcγRI[用語5]という高親和性受容体には結合し、免疫応答を引き起こす一方、他のFcγ受容体には結合できないことが判明しました。この結果は、ヒンジ領域は抗体の柔軟性を与えるだけでなく、IgG全体の構造と機能を決定する鍵となっていることを示しており、従来の理解を書き換えるものです。
今回発見された「半分の抗体」の特性を応用することで、免疫反応をピンポイントで制御する新しい抗体医薬の開発につながる可能性があります。
本成果は、1月29日付(現地時間)の「Journal of Medicinal Chemistry」誌に掲載されました。
背景
免疫応答の中心的な分子である抗体は、ウイルスや細菌などを認識する2つのFab領域と、免疫細胞を活性化させるFc領域がY字型につながった構造をしており、このY字型が免疫機能の発現に重要な役割を果たしています。抗体医薬は、がんや自己免疫疾患の治療に広く利用されていますが、抗体の構造柔軟性が設計の難しさを生んでいます。特にFab領域とFc領域をつなぐ重要な部分である柔軟なヒンジ領域は、全体構造の柔軟性を生む源となっており、抗体の機能発現にも重要な領域ですが、抗体全体の構造や機能への影響はこれまで十分に理解されていませんでした。
研究成果
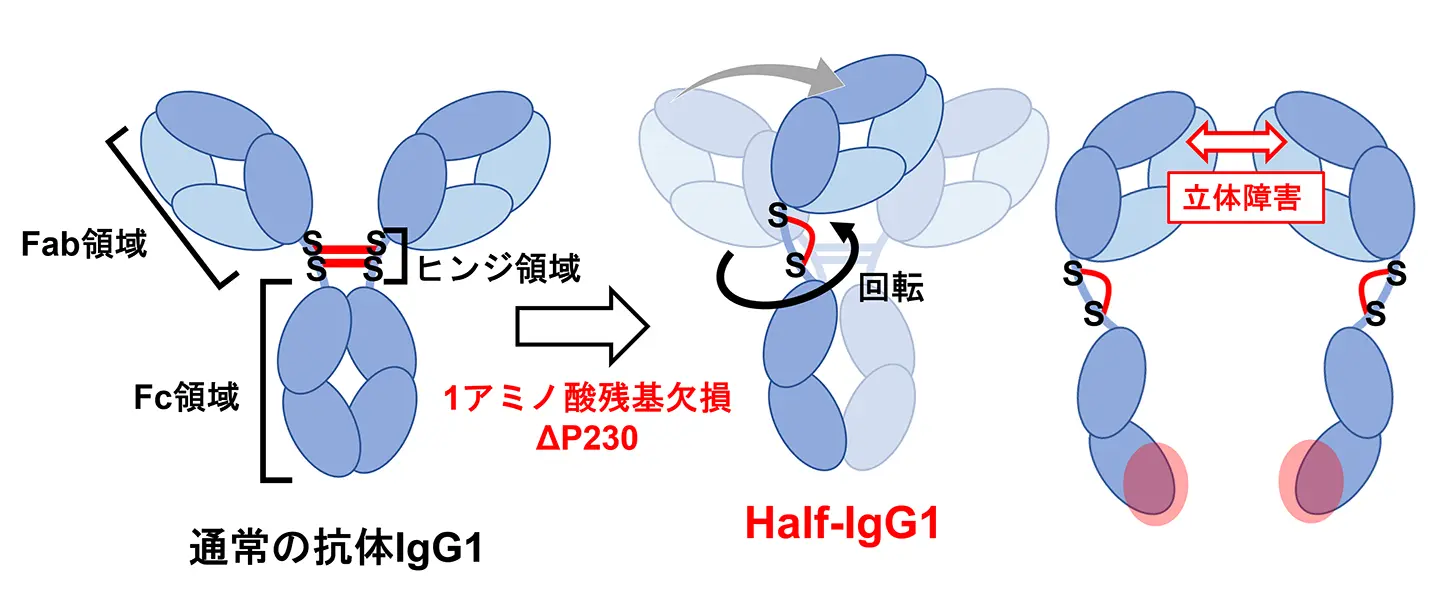
本研究では、抗体の一種であるIgG1抗体のヒンジ領域が構造と機能に果たす役割を明確にすることを目指して、ヒンジ領域のプロリン230(Pro230)のアミノ酸残基を1個削除した変異体を作成しました(図1左)。この変異体を解析したところ、抗体は通常のY字型構造を維持できず、「半分の抗体(Half-IgG1)」に分かれることが確認されました(図1中央)。この現象は、ヒンジ領域が単なるつなぎ目ではなく、抗体の全体構造を決定する重要な要素であることを示しています。またこのHalf-IgG1は、免疫細胞に存在する高親和性受容体FcγRIには結合し、免疫応答を誘導する一方で、他のFcγ受容体には結合できないことが明らかとなりました。
さらにこのHalf-IgG1に対して、核磁気共鳴法、電子顕微鏡、質量分析といった、原子レベルでの構造解析を可能とする手法を駆使した詳細な構造解析を実施しました。その結果、ヒンジ領域の改変によってFab領域とFc領域の配置が変化しているため、立体障害[用語6]が生じることも明らかになりました(図1右)。これらの成果は、ヒンジ領域が抗体の柔軟性を与えるだけでなく、抗体全体の構造と機能を決定する設計要素であることを示しており、従来の理解を大きく書き換えるものです。
社会的インパクト
FcγRIに特異的な免疫応答を示すHalf-IgG1は、免疫反応をピンポイントで制御する抗体医薬の設計に新しい可能性を切り開きます。従来の抗体は複数のFcγ受容体と広く相互作用するため、標的外の免疫を活性化しますが、本研究で得られたHalf-IgG1はFcγRIにのみ選択的に作用するため、免疫応答を精密に制御できる点が大きな利点になります。この特性は、標的型免疫制御を実現し、副作用を低減する抗体医薬の開発に直結します。さらに、FcγRIはマクロファージや単球など、がん免疫療法や自己免疫疾患治療において重要な細胞に発現していることから、今回の成果はHalf-IgG1を基盤とした新しい治療戦略の展開に寄与すると考えられます。
今後の展開
今後はHalf-IgG1構造を応用した新しい抗体プラットフォームの開発が進むと期待されます。これにより、抗体の構造を精密に制御し、特定の免疫応答を選択的に誘導する設計指針を提供できます。さらに、他のヒンジ領域変異による構造・機能変化を体系的に解析することで、抗体の設計原理をより深く理解し、次世代抗体医薬の開発に向けた包括的な知見を蓄積することが可能になります。
付記
本研究は、文部科学省 科学研究費助成事業(JP22H02755、JP25H02252[S.Y.]、JP24H00599[K.K.]、JP20H03228[J.M.M.C.])、日本医療研究開発機構(AMED)(JP21ae0121020、JP23ak0101209[S.Y.]、JP21ae0121013[K.K.])、文部科学省 共同利用・共同研究システム形成事業~学際領域展開ハブ形成プログラム~(CURE)(JPMXP1323015482、JPMXP1323015488)、JST 次世代研究者挑戦的研究プログラム(SPRING)(JPMJSP2180)、AMED 創薬等ライフサイエンス研究支援基盤事業(BINDS)(JP23ama121031[J.M.M.C.])、生命創成探究センター共同利用研究(23EXC312、24EXC341[J.M.M.C.]、22EXC601[K.K.、T.U.]、25EXC341[S.Y.])、国際・産学連携インヴァースイノベーション材料創出(DEJI2MA)プロジェクト、および生理学研究所共同研究(24NIPS209[K.K.]、25NIPS236[S.Y.])の助成を受けて行われました。
用語説明
- [用語1]
- IgG1抗体:免疫を担うタンパク質の一種で、血液中に多く存在する抗体クラス。ウイルスや細菌を認識し、排除する役割を持つ。医薬品としても広く利用される。
- [用語2]
- ヒンジ領域:抗体のY字型構造において、腕(Fab)と胴体(Fc)をつなぐ柔軟な部分。抗体の動きを調整し、抗原認識と免疫応答の両方に関わる。
- [用語3]
- プロリン230(Pro230):ヒンジ領域に存在するアミノ酸残基の一つ。今回の研究で、この残基を削除すると抗体の構造が大きく変化することが判明した。
- [用語4]
- Half-IgG1:通常のIgG1抗体は2本の重鎖が結合した構造を持つが、ヒンジ領域の変化により片方の重鎖だけで存在する「半分の抗体」を指す。
- [用語5]
- FcγRI:免疫細胞に存在する高親和性の受容体で、抗体のFc部分と結合する。結合により免疫応答が活性化される。Fcγ受容体の中で最も強く抗体と結合する性質を持つ。
- [用語6]
- 立体障害:分子内の原子や置換基が空間的に混み合うことで反応や結合を妨げる現象。
論文情報
- 掲載誌:
- Journal of Medicinal Chemistry
- タイトル:
- Key Role of Pro230 in the Hinge Region on the Architecture and Function of IgG1
- 著者:
- Yuuki Koseki, Yuki Yamaguchi, Michihiko Aoyama, Kentaro Hiraka, Minoru Tada, Atsuji Kodama, Akinobu Senoo, Akiko Ishii-Watabe, Takayuki Uchihashi, Kazuyoshi Murata, Susumu Uchiyama, Koichi Kato, Saeko Yanaka*, Jose M.M. Caaveiro* (*責任著者)
研究者プロフィール
小関 悠希 Yuuki Koseki
東京科学大学 物質理工学院 材料系 大学院生(博士後期課程1年)
研究分野:生体分子工学、構造生物学
谷中 冴子 Saeko Yanaka
東京科学大学 総合研究院 フロンティア材料研究所 准教授/
自然科学研究機構 生命創成探究センター 准教授(兼任)
研究分野:生体分子工学、構造生物学
内山 進 Susumu Uchiyama
大阪大学 大学院工学研究科 生物工学専攻 高分子バイオテクノロジー領域 教授/
自然科学研究機構 生命創成探究センター 客員教授
研究分野:バイオ医薬品の物性解析
山口 祐希 Yuki Yamaguchi
大阪大学 大学院工学研究科 生物工学専攻 高分子バイオテクノロジー領域 助教
研究分野:バイオ医薬品の質量分析
加藤晃一 Koichi Kato
自然科学研究機構 生命創成探究センター 教授/
名古屋市立大学大学院薬学研究科 特任教授
研究分野:生体分子工学、構造生物学
村田和義 Kazuyoshi Murata
自然科学研究機構 生命創成探究センター/生理学研究所 特任教授
研究分野:電子顕微鏡解析
内橋貴之 Takayuki Uchihashi
名古屋大学 大学院理学研究科 教授/
自然科学研究機構 生命創成探究センター 客員教授
研究分野:高速原子間力顕微鏡解析
カアベイロ・ホセ Jose Caaveiro
九州大学 副理事/同 大学院薬学研究院 教授
研究分野:生体分子工学、構造生物学