ポイント
- 自由エネルギー摂動(FEP)計算で分子構造が大きく異なる化合物間の結合自由エネルギー差を効率的に計算する手法PairMapを開発
- 中間化合物を導入することで複雑な分子構造変換を橋渡しし、高精度なFEP計算を実現
- 計算機による低分子化合物の標的分子への結合予測を効率化し、医薬品開発の初期段階を加速
概要
東京科学大学(Science Tokyo)※ 情報理工学院 情報工学系の大上雅史准教授、古井海里博士後期課程学生らとアリヴェクシス株式会社の共同研究チームは、創薬における標的分子への低分子化合物の結合能を推定する自由エネルギー摂動(FEP)計算[用語1]計算をより効率的に行うための新たな手法を開発しました。
近年、計算機を用いた医薬品開発プロセスでは、弱い活性を持つ医薬品候補化合物からより強固な活性を持つ化合物へと最適化を行うために、分子シミュレーションの一種であるFEPが大きく貢献しています。FEP計算では2つの化合物の間で仮想的に構造変換(アルケミカル変換)させながらシミュレーションを行うことで結合自由エネルギーの差を求めますが、2つの化合物の分子構造が大幅に異なる場合は適用が難しく、正しいエネルギー値を得られないことが大きな課題となっていました。
大上准教授らは、分子構造が大幅に異なる化合物間の構造変換を直接計算せず、中間化合物[用語2]を介して簡単な構造変換に分解して計算することで、高精度かつ効率的にFEP計算を実施するPairMap法を開発しました。この新手法により、これまでは困難だった複雑な構造変換においても、高精度なFEP計算ができるようになりました。この研究によって、医薬品開発プロセスにおけるFEP計算の利便性や適用範囲を拡大し、創薬にかかる膨大な時間と費用の削減に貢献します。
本成果は、2025年1月12日付(現地時間)の「Journal of Chemical Information and Modeling」誌に掲載されました。
- 2024年10月1日に東京医科歯科大学と東京工業大学が統合し、東京科学大学(Science Tokyo)となりました。
背景
医薬品の開発には十数年の期間と数千億円の費用が必要と言われており、この膨大なコストや開発期間の削減が喫緊の課題となっています。一方で、医薬品は標的となるタンパク質に結合して作用するものが多いため、計算機を用いて標的タンパク質に結合しそうな化合物を設計できるようになると、医薬品開発のプロセスが加速されると考えられます。そのため、医薬品候補化合物の分子設計を支援するためのさまざまな計算手法が開発されてきました。
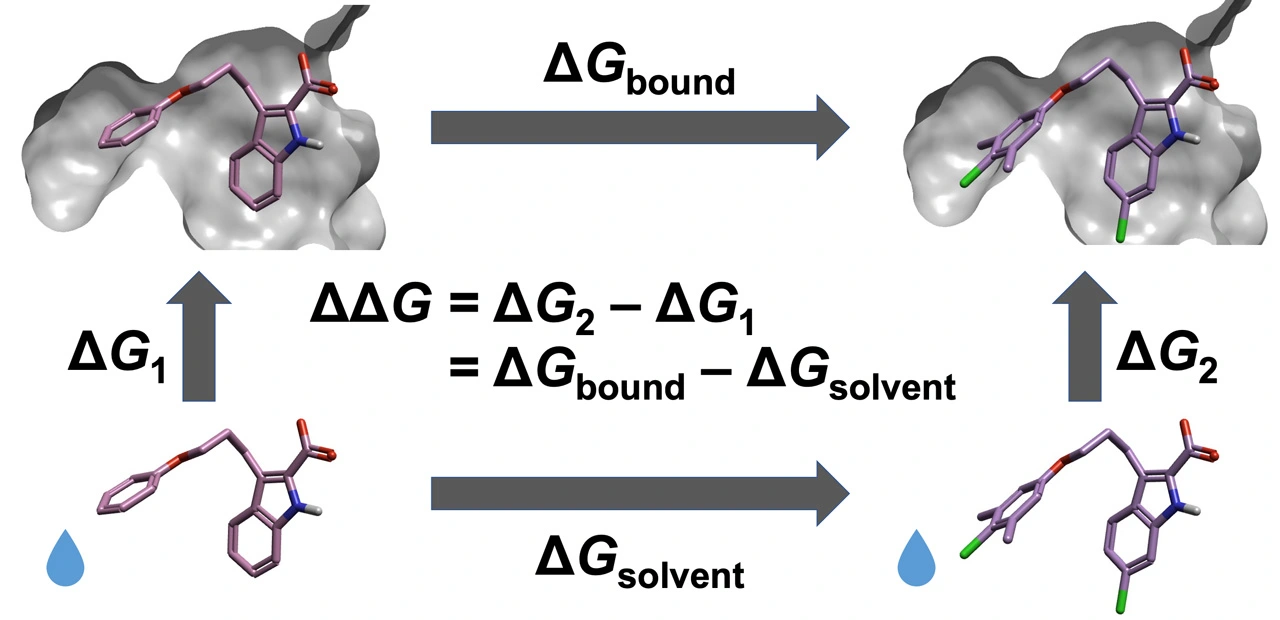
自由エネルギー摂動(free energy perturbation, FEP) 計算は、2つの化合物の間で仮想的に分子構造を変換(アルケミカル変換)させながら分子シミュレーションを行う計算手法の一種です(図2)。この手法は、2つの化合物間の結合自由エネルギーの差(ΔΔG)を精度良く推定することができるため、計算による医薬品候補化合物の設計によく用いられています。しかしながら、2つの化合物の分子構造が大幅に異なる場合は適用が難しく、正しいエネルギー値を得られないことが大きな課題となっていました。
研究成果
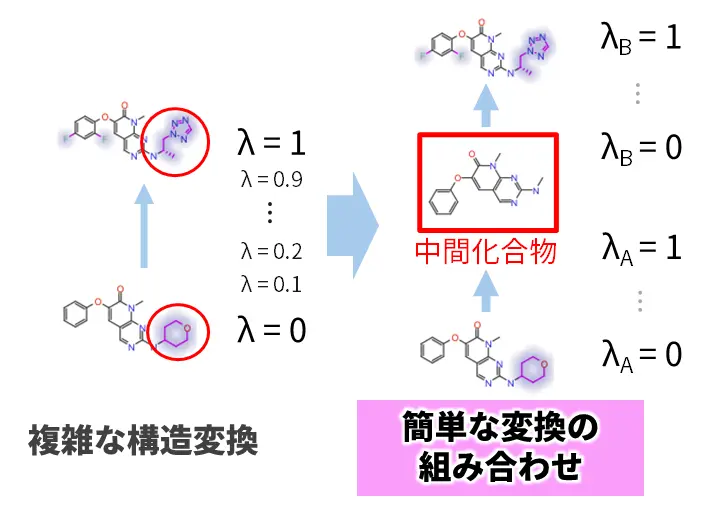
本研究では、大きな構造変化を伴う化合物構造の変換に対するFEP計算を可能にするため、この場合に必要な複雑な構造変換を、中間化合物を介した複数の簡易なステップへと分解するアプローチを採用しました(図3)。
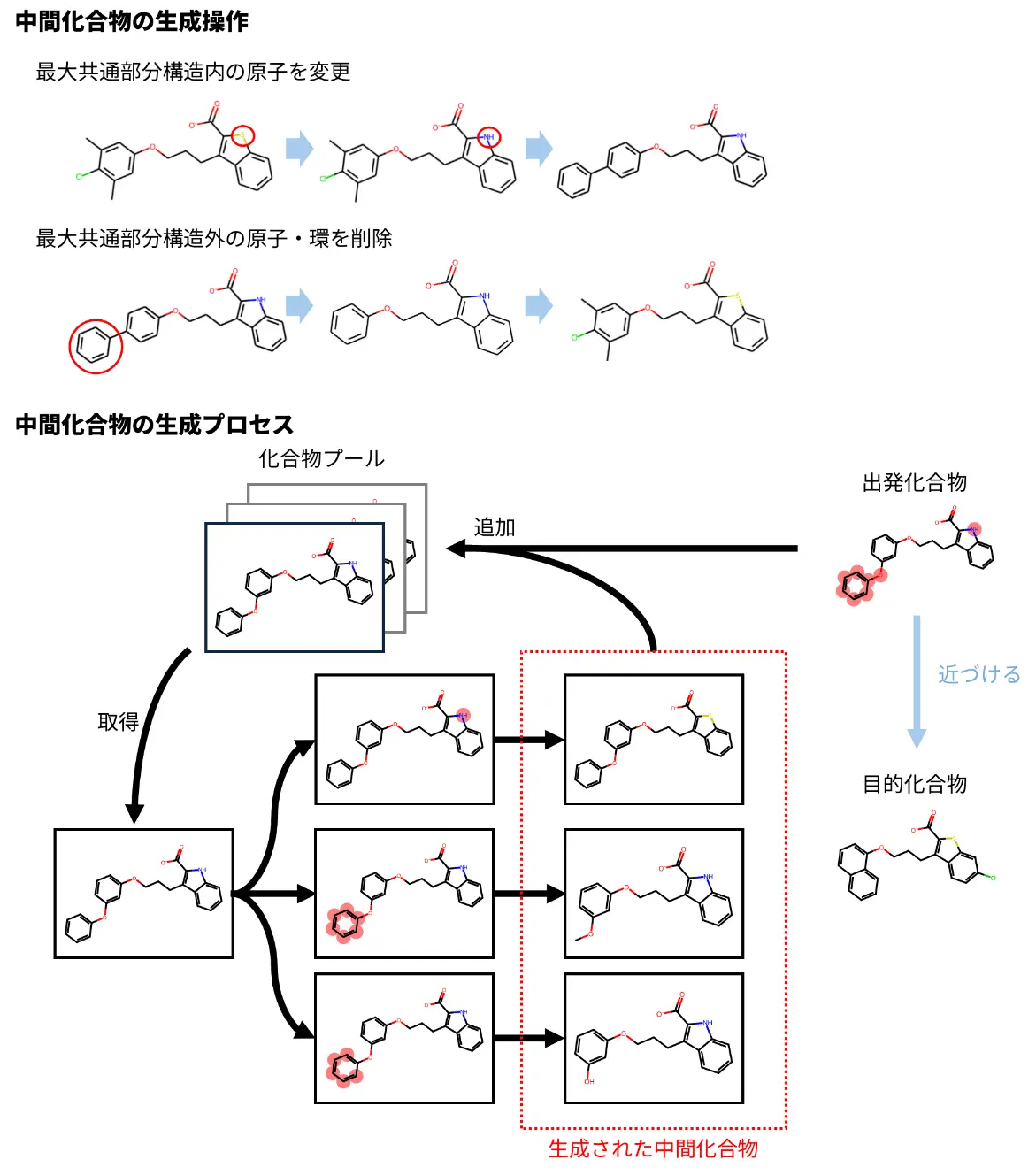
まず、入力された化合物ペアに対して最大共通部分構造[用語3]を基準とした原子の削除・置換などの操作を行い、多様な中間化合物の候補を網羅的に生成するアルゴリズムを開発しました(図4)。次に、得られた中間化合物集合から必要最小限の中間化合物を選抜し、もとの複雑な構造変換を可能な限り簡略化できる組み合わせを自動的に選択する手法を構築しました(図5)。そして、ΔΔGを計算するために実際にどの化合物ペア間のFEP計算を実施すべきかを計画する摂動マップ[用語4]を構築しました(図6)。このとき、摂動マップ内に熱力学的サイクル[用語5]を導入することで、計算誤差を低減させる工夫も行っています。
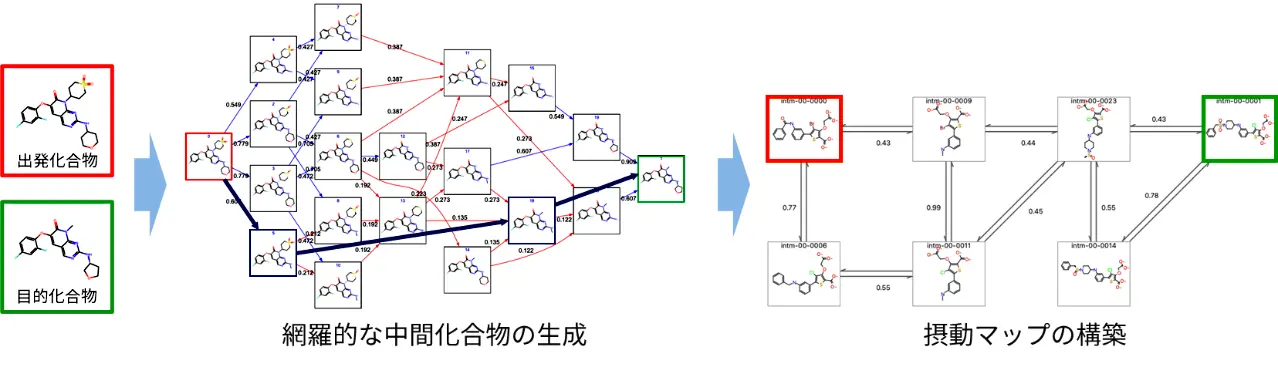
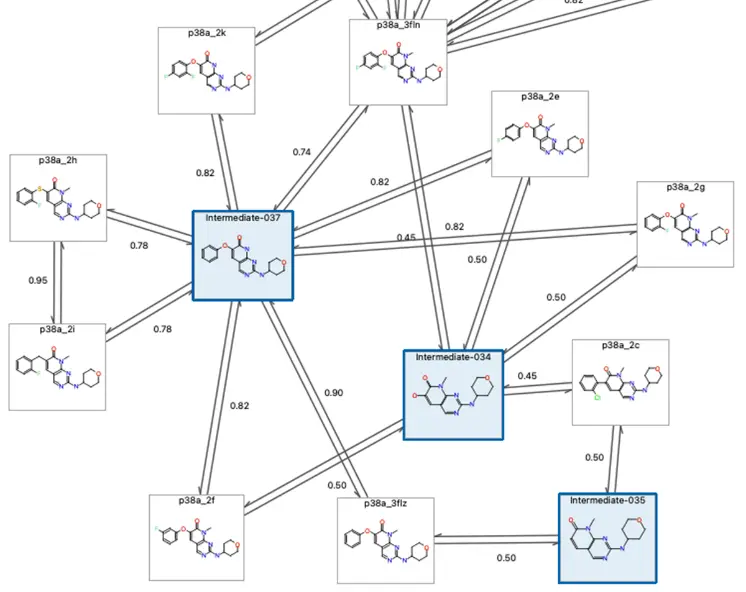
さらに、PairMapを1つの化合物ペアだけでなく、共通の基本骨格を有する化合物集合に対しても適用できるように拡張しました(図6)。この拡張により、化合物集合に対する摂動マップ上にFEP計算が困難なペアが発生した場合に、PairMapによる中間化合物を導入することで、ネットワーク全体としての計算精度を向上させられるようになりました。実際に、すでに活性値が実験によって明らかになっている複数のベンチマークデータセットから、特に複雑な構造変換を含む化合物ペアを選抜してFEP計算を実施したところ、従来法では精度が悪かった化合物ペアでも、本手法によって計算時間の大幅な増加を抑えつつ、計算精度を高められることを実証しました。またPairMapは既存の中間化合物の生成方法よりも高速であり、網羅性も考慮されていることから、より少ない中間化合物の導入で計算の最適化ができることも示しました。
社会的インパクト
今回開発したPairMapは、オープンソースソフトウェアとしてプログラム共有サイトGitHubからダウンロード可能となっています。PairMapの利用により、創薬の化合物最適化プロセスで重要となるスキャフォールドホッピング[用語6]や、分子量が大きめの化合物の設計など、これまでFEPの適用が難しかった状況にも対応が可能になります。これにより、医薬品開発プロセスの初期段階でより多くの有望な化合物の選別・最適化を迅速に行えるようになり、医薬品開発コストの削減と、効率的で持続可能な創薬が実現すると期待されます。
今後の展開
研究チームはPairMapをさらに拡張し、電荷変化を伴う変換への対応を行っています。さらにAIとの組み合わせによって、膨大な化合物空間を効率的に探索する手法の開発をすでに進めています。これにより、さらに幅広い化合物群を対象とした高精度なFEP計算が可能になり、創薬支援技術のより一層の革新が見込まれます。
付記
本研究は、東京科学大学とアリヴェクシス株式会社による共同研究契約に基づいて実施されました。また、日本学術振興会 科学研究費助成事業(大上雅史:JP23H04880、JP23H04887、古井海里:JP24KJ1091)、日本医療研究開発機構 創薬等先端技術支援基盤プラットフォーム(BINDS)(大上雅史:JP24ama121026)、科学技術振興機構 創発的研究支援事業(大上雅史:JPMJFR216J)による支援を受けています。
用語説明
- [用語1]
- 自由エネルギー摂動(FEP)計算:標的タンパク質への化合物の結合自由エネルギーを求める分子シミュレーション手法。
- [用語2]
- 中間化合物:2つの化合物間の構造変換を分解する際に用いる仮想的な中間段階の化合物。
- [用語3]
- 最大共通部分構造:複数の分子の共通部分のうち、最大となるもの。
- [用語4]
- 摂動マップ:どの化合物ペアについてFEP計算を行うかを表現した化合物ネットワーク。
- [用語5]
- 熱力学的サイクル:摂動マップ内にサイクル(1周できるルート)があると、そのサイクル内ではΔGの総和が0になる。このことを利用して、ΔGの計算値を修正することができる。
- [用語6]
- スキャフォールドホッピング:既知の化合物を出発点に、同等の機能や活性を持った異なる分子骨格の化合物を創出すること。
論文情報
- 掲載誌:
- Journal of Chemical Information and Modeling
- タイトル:
- PairMap: An Intermediate Insertion Approach for Improving the Accuracy of Relative Free Energy Perturbation Calculations for Distant Compound Transformations
- 著者:
- 古井 海里1、清水 喬史2、秋山 泰1、木村 俊2、寺田 央2、大上 雅史1
(1東京科学大学情報理工学院情報工学系、2アリヴェクシス株式会社)
研究者プロフィール
大上 雅史 Masahito OHUE
東京科学大学 情報理工学院 情報工学系 准教授
研究分野:創薬インフォマティクス、バイオインフォマティクス
古井 海里 Kairi FURUI
東京科学大学 情報理工学院 情報工学系 知能情報コース 博士後期課程1年
研究分野:計算化学、AI
関連リンク
東京科学大学 総務企画部 広報課
- media@adm.isct.ac.jp
- Tel
- 03-5734-2975
- FAX
- 03-5734-3661