ポイント
- 単一細胞レベルで細胞周期依存的な薬剤応答を解析する「シングルセル型PLOM-CON法(sc-PLOM-CON法)」を開発。
- 従来法では捉えにくい、薬剤作用のごく初期段階におけるタンパク質ネットワークの乱れを検出。
-
抗がん剤シタラビンによるS期停止の前段階で、G2期のサイクリンB1を薬効発現の「予兆タンパク質シグナル」として同定。
- 薬剤の作用機序の違いを分子レベルで層別化できることを実証。
- 新規バイオマーカー探索や、個別化医療・創薬研究に広く応用可能。
概要
東京科学大学(Science Tokyo)総合研究院 細胞制御工学研究センターの加納ふみ教授らの研究グループは、培養細胞に対する薬剤の効果を単一細胞レベルで高感度に評価する新手法「シングルセル型PLOM-CON(sc-PLOM-CON)法」を開発しました。本手法は、多重免疫蛍光染色と画像ベースの共変動ネットワーク[用語1]解析を統合することで、薬剤による細胞周期依存的な早期の細胞状態変化をタンパク質の共変動ネットワークで可視化できます。
細胞周期は細胞分裂後に成長するG1期、染色体DNAが複製されるS期、複製が完了し細胞分裂に至るまでのG2期に分かれますが、抗がん剤シタラビンやブレオマイシンを用いた解析では、薬剤処理後わずか4時間(一般的には24時間後の細胞で解析する)の段階で、従来法では見逃されていた細胞周期別のタンパク質ネットワークの乱れを検出しました。そしてさらに、sc-PLOM-CON法に使用する同じデータセットを用い、動的ネットワークバイオマーカー(DNB)理論を用いた薬効発現の予兆検出にも挑みました。その結果、シタラビン処理群ではG2期におけるサイクリンB1が「予兆タンパク質シグナル」として浮かび上がり、薬剤が誘導するS期停止の前兆を捉えることに成功しました。一方、別の抗がん剤ブレオマイシンやがん予防の効果が知られているアスピリンではこのような初期応答は観察されず、薬剤作用機序の違いを分子ネットワークレベルで層別化できることが実証されました。本成果は、薬剤応答の早期段階における新規バイオマーカーの発見に道を開くとともに、創薬や個別化医療への応用が期待されます。
本研究は、東京科学大学 総合研究院 細胞制御工学研究センターの加納ふみ教授、村田昌之特任教授(東京大学名誉教授)、國重莉奈助教と、東京大学 国際高等研究所 ニューロインテリジェンス国際研究機構(WPI-IRCN)の野口誉之学術専門職員、合原一幸エグゼクティブ・ディレクター(東京大学特別教授)、大阪大学 大学院情報科学研究科の山下洋史助教(情報数理学)との共同研究によって行われ、10月30日付(英国時間)の「Communications Biology」誌に掲載されました。
背景
創薬研究における薬効評価は、多くの場合、培養細胞を対象に行われます。しかし一見均一に見える細胞集団も、実際には細胞周期や代謝状態の違いにより高度な不均一性を示します。この不均一性は薬剤応答に強く影響し、同一の薬剤が細胞ごとに異なる作用を示す要因となります。従来の生化学的方法では、細胞の持つ構造的特性を破壊し、細胞全体をすり潰しライセート化(液化)して平均的な分子データを解析するため、こうした細胞周期依存的な差異を捉えることが困難でした。また、細胞周期同調法を用いた解析では、細胞周期を揃える目的で使われる化学的あるいは物理的な刺激が細胞ストレスとなり、細胞内のシグナル伝達系を乱して、本来の細胞恒常性を損なう可能性があり、真の薬効評価には限界がありました。
この問題に対し、近年注目されているのが「単一細胞解析」です。特にシングルセルRNAシーケンスは、細胞間の遺伝子発現の違いを高解像度で明らかにできる強力なツールですが、特殊な装置や解析基盤を必要とするため、汎用性には課題があり、かつ、多くの薬剤の作用が遺伝子ではなくタンパク質に作用することを考えるとやはり細胞内のタンパク質情報の解析が重要と考えられます。一方、タンパク質情報を解析できるフローサイトメトリーや単一細胞プロテオミクスの進展も目覚ましいものの、前者は細胞集団の接着特性の喪失が細胞内シグナル、代謝、ストレス応答に与える正確な影響は未解明であり、後者は依然として感度や定量性や汎用性など技術的・設備的な制約が大きいのが現状です。
そこで本研究グループが注目したのが、多重免疫蛍光染色(Cyclic IF法)[用語2]と定量的な顕微鏡画像解析です。前者により、単一細胞レベルで複数タンパク質の「量」だけでなく、リン酸化やSUMO化などの「質(翻訳後修飾)」、さらに細胞内「局在や形態」情報を同時に取得できます。また、後者として、チームはこれまで、このタンパク質の「量」「質」「局在」の定量的な細胞染色画像の時間的変化を相関解析し、共変動ネットワークを構築する「時間相関型PLOM-CON(Protein Localization and Modification-based Covariation Network)解析法[用語3]」を開発してきました(Noguchi et al. iScience 2021; 旧・東工大プレスリリース)。この二つの技術の組み合わせにより、細胞ごとのタンパク質変動の相関関係をネットワークとして定量的に解析することが可能になりました。
この相乗効果を最大限に活かして開発されたのが、シングルセル型PLOM-CON法です。この方法開発により、薬剤による初期応答や細胞周期依存のネットワーク変化を高感度に評価でき、従来では検出が難しかったネットワーク変化を予兆するタンパク質シグナルを抽出することが可能となりました。
研究成果
本研究では、多重免疫蛍光染色(Cyclic IF法)と本研究グループが既に構築済みの時間相関型PLOM-CON法を組み合わせ、単一細胞レベルの PLOM-CON(シングルセル型PLOM-CON法:sc-PLOM-CON)解析を確立し、細胞周期依存的な抗がん剤の初期の細胞応答を明らかにしました(図1)。これにより、従来の平均化データや単純な蛍光強度解析では捉えられない、細胞集団内の個々の細胞の微細な変化を検出できるようになりました。
まずHeLa細胞を接着状態のまま、抗がん剤シタラビン、ブレオマイシン、がん予防効果が期待されているアスピリンの3種の薬剤を処理後4時間で細胞を固定し、Cyclic IF法を用いて、細胞周期、代謝、細胞ストレス応答、シグナル伝達経路など、30種類のタンパク質に対する抗体を用い、多重染色画像を得ました。また、接着状態のままの単一細胞核のDAPI蛍光染色強度を基にG1、S、G2/M期に細胞集団を層別化することにも成功しました。これらの画像データに基づき、各染色タンパク質の蛍光強度やオルガネラ形態など、さまざまなパラメータを定量化し最終的に30種のタンパク質の102種類の特徴量を取得しました。これにより、細胞周期ごとの、細胞状態推定に必要な基礎データセットを構築しました。
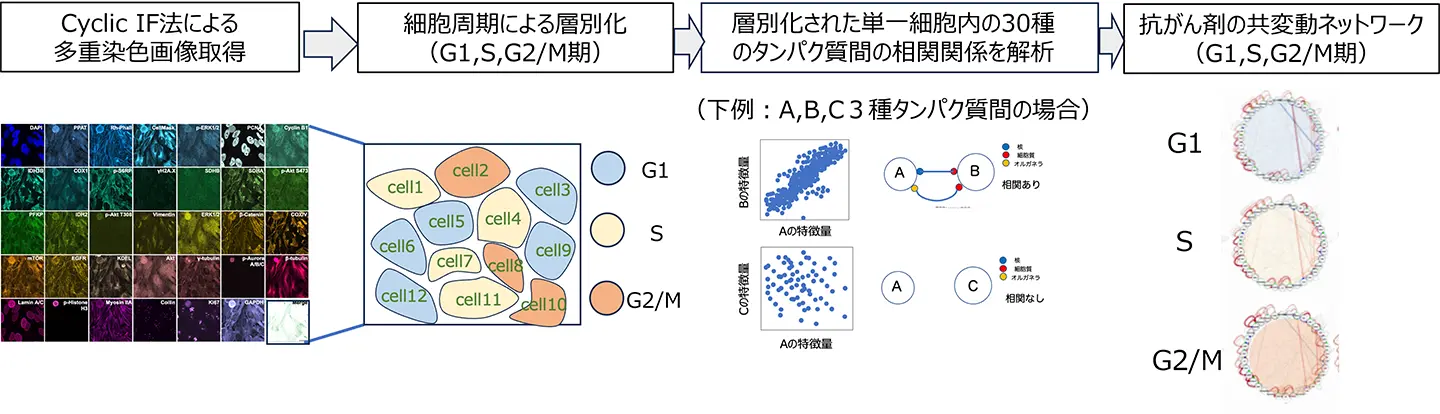
最初に、構築した接着細胞の細胞周期同定法を用い、従来法で知られているシタラビンによるS期停止、ブレオマイシンによるG2/M期停止といった、これら抗がん剤特有の薬剤作用が薬剤処理24時間後に確認されました。一方、薬剤処理4時間後では、従来の染色タンパク質の蛍光強度解析だけをもとにしたUMAP(次元圧縮法)[用語4]や主成分分析(PCA)[用語5]では細胞周期別にタンパク質の挙動に有意な変化は認められず、従来手法の限界が明らかになりました。
そこで次に、新しい解析法「sc-PLOM-CON」を開発と、それによる、薬剤処理4時間後という早期段階での、細胞周期依存的な薬剤応答の微細な変化の検出に挑戦しました。この方法では、細胞ごとに得られた30種類のタンパク質の特徴量同士の「相関関係」に注目し、細胞周期によって層別化された細胞集団ごとに「共変動ネットワーク」を描き出すことができます。つまり、単一細胞内で30種のタンパク質同士がどのように連動して変化しているかを共変動ネットワークという新しいツールを使って可視化するのです。このアプローチの強みは、個々のタンパク質の量的変化だけを見るのではなく、細胞全体でのタンパク質間の量的・質的・局在の関係性の変化を捉えられることです。細胞の中では、タンパク質が互いに直接あるいは間接的に影響し合いながら(相互作用しながら)働いており、その相互作用のパターン(関係性)は細胞周期や薬剤の有無によって変わることが予測されます。本研究グループの手法は、まさにその関係性を「共変動ネットワーク」として描き出すことで、従来は見えにくかった細胞状態の僅かな違いを明らかにします。
結果として、水コントロール(水)および3種類の薬剤(シタラビン、ブレオマイシン、アスピリン)処理に対して、G1、S、G2/M期それぞれの12種類の共変動ネットワークを生成しました(図2)。得られた共変動ネットワークは、解析した30種類のタンパク質や核や細胞の面積などを「ノード(節点)」にし、ノード間の相関関係の有無とその強さを太さの異なる「エッジ(辺)」で示しています(図2)。ネットワークを詳しく比べると、細胞周期ごとに薬剤ことに類似点や相違点があることが見て取れます。そこで、3種類の薬剤および各細胞周期ステージにおけるネットワークの差異を体系的に解析・議論するため、12個の共変動ネットワークの構造的特徴を定量解析する手法として「相関異常度[用語6]」に着目しました。これは、共変動ネットワークのタンパク質(特徴量)間のつながり方の乱れ具合を数値化し、細胞状態の違いを生む要因となる特徴量を見つける指標です。
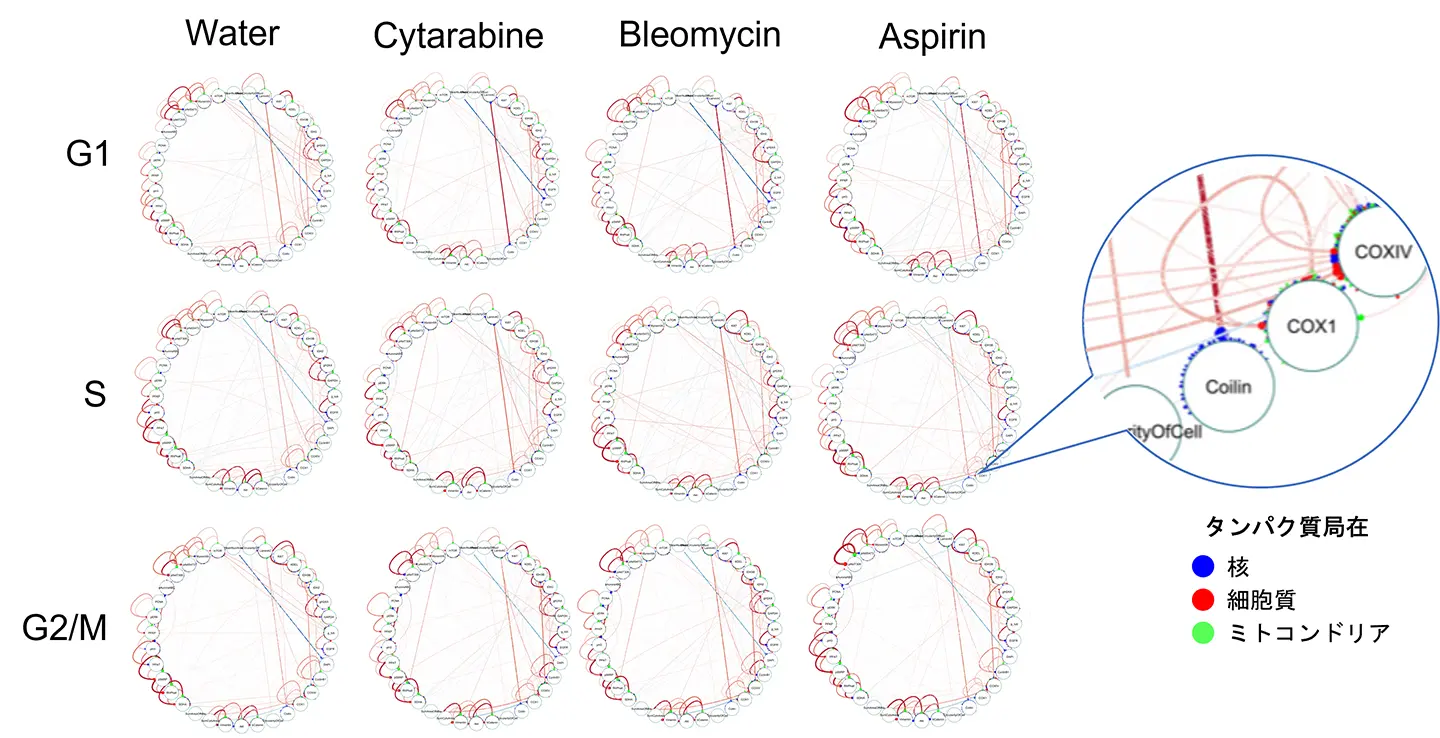
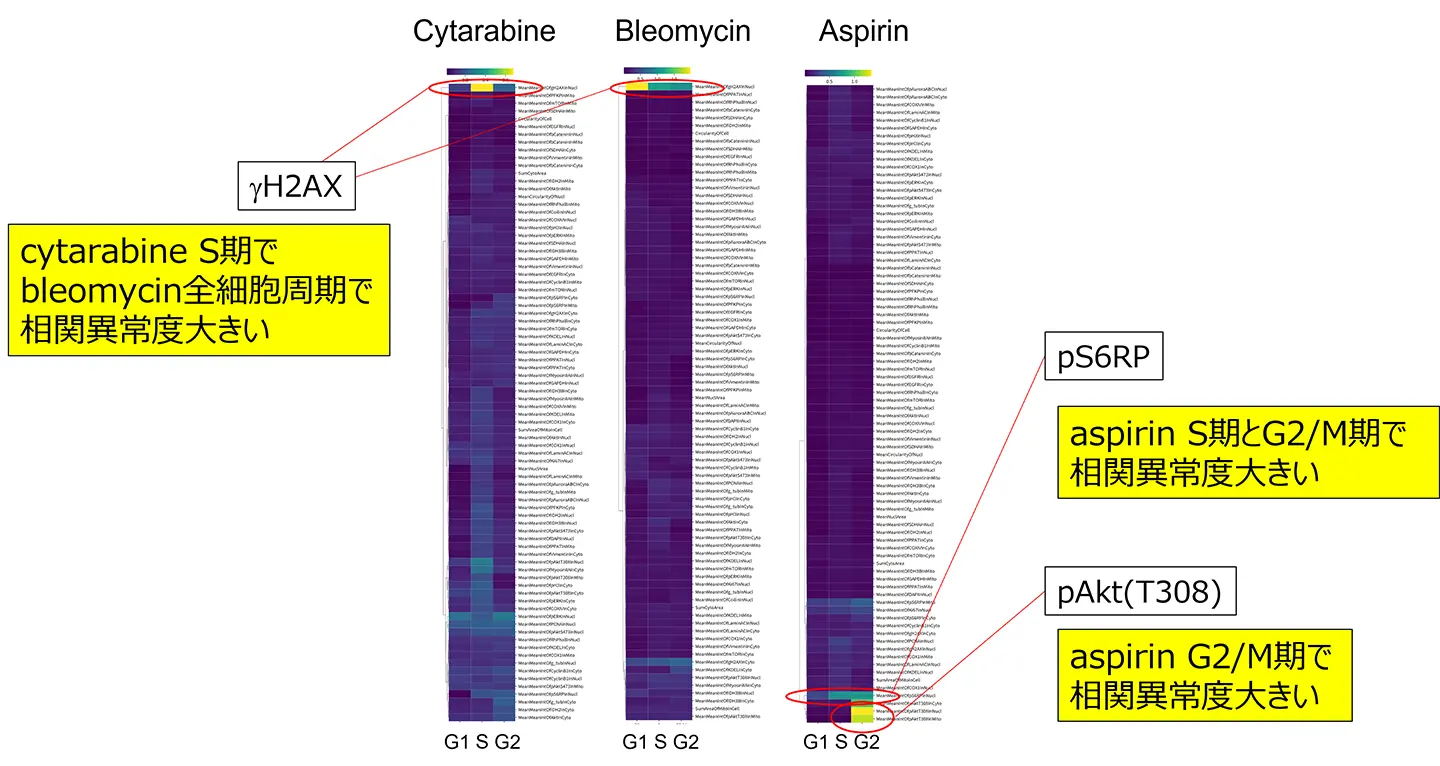
シタラビンの場合、相関異常度が高い特徴量は主にS期の核領域におけるγH2AXの平均蛍光強度に関連していました(図3)。γH2AXはDNA損傷のマーカーであり、DNA二本鎖切断(DSB)により核内で増加します。この結果は、シタラビンによるS期でのDNA複製阻害に関連すると考えられます。また、ブレオマイシン処理細胞では、核領域のγH2AX平均蛍光強度の相関異常スコアがG1、S、G2期のいずれでも高くなりました(図3)。ブレオマイシンには細胞周期全体でDNA切断機能があり、それをうまく説明します。これらの結果は、薬剤の可視的な細胞周期停止作用が現れる前(薬剤処理後、24時間)よりもずっと早期(薬剤処理後、4時間)に、共変動ネットワークレベルで異常が始まっていることを示す重要な知見です。アスピリンの場合、相関異常スコアが高い特徴量は主にS期およびG2/M期の核領域におけるリン酸化S6RPの平均蛍光強度に関連していました(図3)。リン酸化S6RPはタンパク質翻訳に関与し、アスピリン処理でその異常はタンパク質合成の阻害につながることを示せました。また、G2/M期のリン酸化Akt(S308)も相関異常度が高く、M期の細胞がアスピリン処理で増加した影響によるものと考えられます。
加えて、本研究では、動的ネットワークバイオマーカー(Dynamical Network Biomarker, DNB)理論を適用し、薬剤応答の「予兆タンパク質シグナル」を探索しました。DNB理論は、細胞集団が臨界転換点に近づく際に、特定の分子群においてネットワーク相関の強度や揺らぎが急増するという原理に基づいており、この相関や揺らぎの増大を検出することで、疾患進行や薬剤応答の早期前兆(予兆)を同定できます。本研究では、sc-PLOM-CONで構築された単一細胞ネットワークをそのままDNB解析に利用でき、既存のデータセットを二次利用することで、新たな解析や追加実験の手間を最小化できる点も特徴です。
DNB解析の結果、シタラビン投与群では、S期停止の前段階においてG2期のcyclin B1が特徴的なネットワーク揺らぎを示し、S期停止の「予兆タンパク質シグナル(presage protein signal)」として同定されました(図4)。つまり、抗がん剤シタラビンによるS期での細胞周期停止の予兆として、処理細胞のG2/M期では細胞質と核内のcyclin B1の量的相関の揺らぎが大きくなることが分かりました。実際、シタラビンと同じ薬効を示す複数の抗がん剤にこの予兆が出現すること、また、シタラビン機能を不活化させた細胞ではこの予兆が消失することも実験的に確認できました。このように、DNB理論の検証に細胞実験を利用することの利点もこの結果は示しています。一方で、ブレオマイシンやアスピリンでは特定の予兆タンパク質は抽出されませんでした。これらの結果は、薬剤作用の分子メカニズムの早期解明や、細胞周期依存的な薬剤感受性の層別化に新しい視点を提供します。つまり、特定の薬剤の薬効や副作用の出現に特定のタンパク質が「予兆」として振る舞うことを検出できれば、薬剤の毒性・安全性評価や薬効・薬剤のデザインのためのバイオマーカーとしても利用が期待できます。
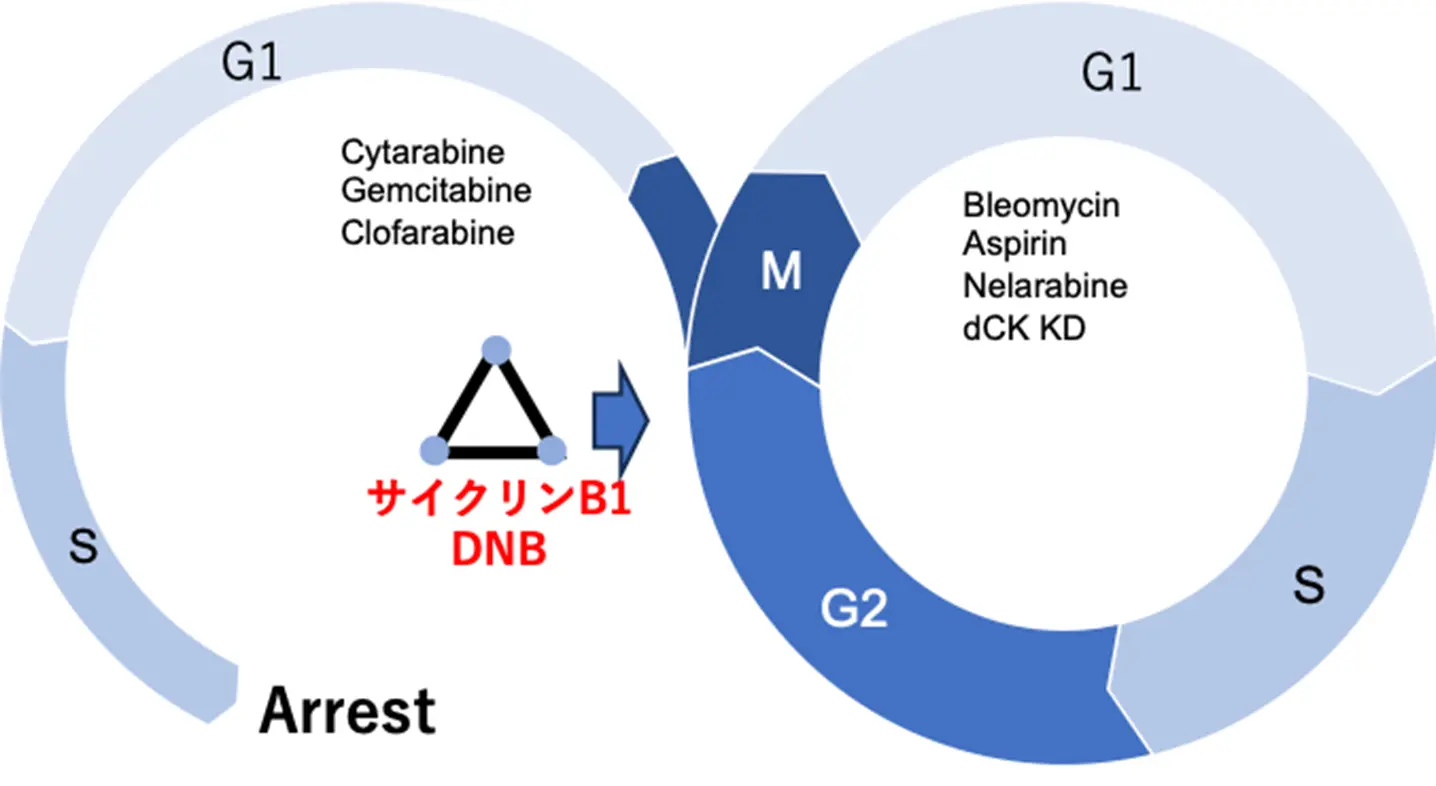
本研究では、薬剤作用による細胞周期の乱れを早期に検出する「予兆シグナル」をDNB理論で同定しました。従来、この予兆シグナルは病気進行など一方向性の時間変化の状態遷移点予測に用いられてきましたが、本研究は初めて周期現象である細胞周期に適用し、シタラビン等によるS期停止の前兆を特定しました。これは安定した周期過程からの逸脱予測を可能にするものであり、概日リズムや性周期など他の周期的生物現象への応用も十分期待できることが分かりました。
本研究で示したsc-PLOM-CONアプローチは、以下の点で大きな意義を持つと考えられます。
(1)細胞周期依存的な薬剤応答の層別化が可能になります。
(2)初期段階の薬剤作用を、従来法では検出困難なネットワーク相関の乱れとして検出できます。
(3)同じデータセットを利用して、DNB理論に基づき、薬効発現などの「予兆タンパク質シグナル」を抽出できます。
これらの特徴は、薬剤作用機序やMoA(Mode of Action)の分類に資することができるばかりか、薬剤の安全性やデザインに重要な分子情報を提供します。
社会的インパクト
本研究の最大の意義は、従来の解析法では捉えられなかった薬剤作用の「初期兆候」を単一細胞レベルで検出できる技術基盤を確立した点にあります。これは、新薬開発における作用機序の理解を深化させ、そのタンパク質情報を基にしたより精密な薬剤スクリーニングや薬効開発や薬剤デザインを可能にします。また、解析対象となる細胞集団を、細胞周期や病態進行度、細胞種や細胞分化状態の違いによって層別化し、薬剤応答のタンパク質ネットワーク解析[用語7]を実施できることから、がん細胞の多様性を考慮した個別化医療にも大きく貢献すると期待されます。今回は抗がん剤作用の初期効果に焦点を当て、シングルセル型PLOM-CON法とDNB理論の統合が示す研究成果を実証実験とした示した論文でしたが、本手法は、細胞老化や神経変性疾患など、病態が顕在化するまで長い時間を要する疾患進行過程に見られる、細胞状態のヘテロ性・多様性の解明にも即応用可能な解析システムであり、その多様性に対する薬効や薬剤の安全性評価に対するバイオマーカー同定にもつながることも期待できます。
今後の展開
今後は、本手法を他の抗がん剤や異なる細胞種に適用し、より包括的に「薬剤 × 細胞周期 × 分子ネットワーク」の関係を解明することが期待されます。また、臨床検体に応用することで、薬剤感受性予測や個別化医療に直結する可能性もあります。この研究結果から、sc-PLOM-CON 法と DNB理論を組み合わせることは、細胞周期依存的な薬剤効果を単一細胞レベルで可視化・層別化する強力な手法になりうること、細胞集団のヘテロ性や多様性を対象にした、創薬・細胞医薬研究、細胞生物学などの基礎生命科学研究に対する新しいシングルセル解析法となりうることが分かりました。
加えて、今回開発した「シングルセル型 PLOM-CON 法」と、本研究グループが先に報告した「時間相関型 PLOM-CON 法」(Noguchi et al. iScience, 2021; 旧・東工大プレスリリース; Kunishige et al. Commun. Biol., 2025)は、それぞれ異なる強みを持ちます。前者は細胞間の不均一性や細胞周期依存的など層別化された細胞集団の応答を精緻に解析でき、後者は細胞集団全体の時間発展や動的変化を捉えることに優れています。両者を最適に組み合わせることで、薬剤作用の初期兆候から集団レベルでの薬効進行までを一貫して把握でき、創薬研究や疾患原因の同定において、従来にない包括的な解析基盤を提供できると考えています。
付記
本研究は下記の支援により行われました。
-
AMED-PRIME
研究領域:ソロタイプ「プロテオスタシスの理解と革新的医療の創出」研究開発領域
研究課題:シングルセル共変動ネットワーク解析による代謝関連タンパク質のプロテオスタシス変動制御機構の解明 -
AMED-PRIME
研究領域:ソロタイプ「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域
研究課題:共変動ネットワークによる疾患特異的iPS細胞の神経分化過程の解析と理解 -
JST ムーンショット型研究開発事業
目標2「2050年までに、超早期に疾患の予測・予防をすることができる社会を実現」
研究課題:複雑臓器制御系の数理的包括理解と超早期精密医療への挑戦
参考文献
- [1]
- Kunishige, R. et al.: Protein covariation networks for elucidating ferroptosis inducer mechanisms and potential synergistic drug targets. Commun Biol 8, 480 (2025). 10.1038/s42003-025-07886-3
- [2]
- Noguchi, Y. et al. Microscopic image-based covariation network analysis for actin scaffold-modified insulin signaling. iScience 24, 102724 (2021). 10.1016/j.isci.2021.102724
用語説明
- [用語1]
- 共変動ネットワーク:異なる要素間の共変動(時間的同調性)を表現することで、動的な関係性を効果的に捉えることができるネットワーク。
- [用語2]
- 多重免疫蛍光染色(Cyclic IF法):蛍光抗体法によるタンパク質染色→共焦点レーザー顕微鏡で撮像→蛍光消光→別のタンパク質に対する抗体を用いて蛍光抗体法 という一連の過程を繰り返し、同じ視野での多数のタンパク質染色と撮影が可能である。
- [用語3]
- PLOM-CON(Protein Localization and Modification-based Covariation Network)解析法:2021年に加納ふみ教授らの研究グループが開発したネットワーク解析法。細胞に入力したシグナルに応答して引き起こされるタンパク質の「量・質・局在」の変化を蛍光抗体染色法により捉え、その時間的同調性に基づいて共変動ネットワークとして可視化する手法。このネットワークには、タンパク質のリン酸化をはじめとする翻訳後修飾情報(「質」)と、タンパク質の機能に関わる「局在」情報が反映される。ネットワークにおいて、抗体により染色される各タンパク質はノード(節点)として、時間的相関の有無がエッジ(辺)として表され、局在情報はサブノード(ノードの周りの小円)の色で示される。
[参考1] 加納研究室ホームページ
[参考2]Noguchi, Y. et al. Microscopic image-based covariation network analysis for actin scaffold-modified insulin signaling. iScience 24, 102724 (2021). 10.1016/j.isci.2021.102724 - [用語4]
- UMAP(次元圧縮法):高次元データを2次元や3次元に非線形次元削減する手法。局所的な類似性を保ちやすいため、生物学ではシングルセルRNAシーケンス解析などで広く用いられ、細胞集団の分類や特徴を可視化する目的で活用されている。
- [用語5]
- 主成分分析(PCA):高次元データを線形に次元削減する手法。データのばらつきが大きい方向から新しい直交軸(主成分)を作り、そこへデータを投影して少数次元での可視化を可能にする。データの特徴抽出や可視化、ノイズ低減などに広く利用されている。
- [用語6]
- 相関異常度:変数間の関係の強弱を表す二つのネットワークにおいて、両者の相違に最も寄与する頂点を定量的に表す指標(Idé, T. et al. Proceedings of the 2009 SIAM International Conference on Data Mining. 2009)。
- [用語7]
- ネットワーク解析:グラフ理論を基礎として物事をノード(節点)とエッジ(辺)からなるグラフとして抽象化する手法。多数の要素間の複雑な関係性の理解に有効であり、社会ネットワーク分析やWebページの検索システムなど、多様な分野や場面で活用されている。
論文情報
- 掲載誌:
- Communications Biology
- タイトル:
- Unveiling and Stratifying Cell Cycle-Dependent Drug Efficacy Using a Single-Cell PLOM-CON Approach with Correlation Anomaly and Presage Protein Signals
- 著者:
- Yoshiyuki Noguchi, Rina Kunishige, Naeko Shinozaki-Narikawa, Hiroshi Yamashita, Kazuyuki Aihara, Masayuki Murata, Fumi Kano
研究者プロフィール
加納 ふみ Fumi Kano
東京科学大学 総合研究院 細胞制御工学研究センター 教授
研究分野:細胞デザイン、細胞編集

関連リンク
東京大学 国際高等研究所 ニューロインテリジェンス国際研究機構(WPI-IRCN)エグゼクティブ・ディレクター、主任研究者、東京大学特別教授
合原 一幸