ポイント
- 肝がんで特異的に発現が抑制される4つのヒト内在性レトロウイルス(HERV)エレメントを同定。
- ヒストン修飾因子SETDB1の抑制によるHERVエレメント発現の上昇と抗腫瘍免疫反応を活性化するメカニズムを解明。
- HERVエレメントが新たな予後バイオマーカーや治療標的として応用できる可能性を示唆。
概要
東京科学大学(Science Tokyo)※ 大学院医歯学総合研究科 分子腫瘍医学分野の田中真二教授、秋山好光講師、島田周助教、波多野恵助教、五十嵐陽介連携研究員、および肝胆膵外科学分野の渡邊秀一助教らの研究グループは、同大学 肝胆膵外科学分野、東京慈恵会医科大学 外科学講座、信州大学 医学部外科学教室との共同研究により、以下の成果を明らかにしました。
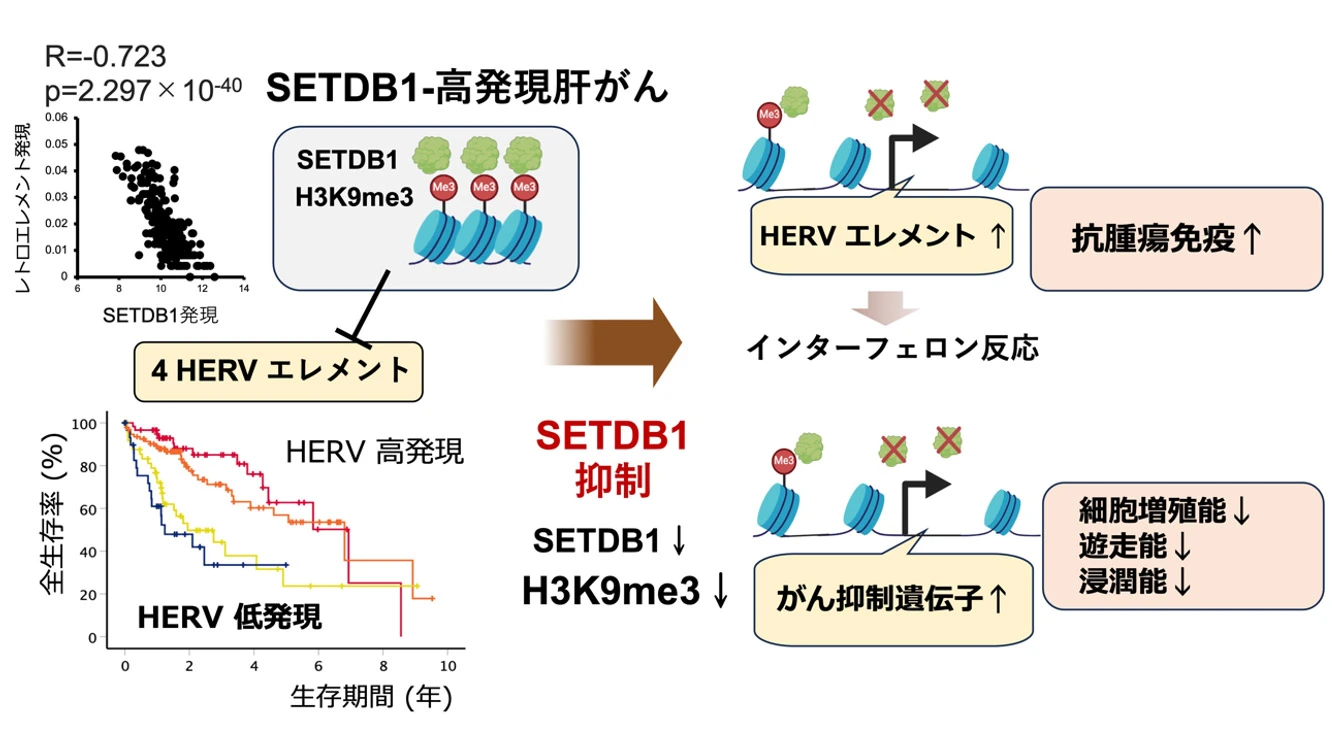
研究グループは、肝がんTCGA[用語1]症例の一次データをスーパーコンピューターで再解析し、ヒストンH3K9(ヒストンH3の9番目のリジン残基)をメチル化する酵素SETDB1[用語2]によって発現が抑制される4つのHERV(ヒト内在性レトロウイルス)[用語3]エレメントを同定しました。これら4つのHERVの発現低下をスコア化して組み合わせることで、患者の予後を的確に反映できることが明らかになりました。また、SETDB1の発現を抑制することでHERVエレメントの発現が上昇し、インターフェロン反応[用語4]を介した抗腫瘍免疫反応が活性化されることを見出しました。SETDB1によって発現が抑制される4つのHERVエレメントは、肝がんの予後予測マーカーであるとともに、新たな治療戦略の標的となる可能性が示唆されました。
本研究成果は、2月20日付(英国時間)で欧州肝臓学会誌「JHEP Reports」に掲載されました。
- 2024年10月1日に東京医科歯科大学と東京工業大学が統合し、東京科学大学(Science Tokyo)となりました。
背景
ヒト内在性レトロウイルス(HERV)は、進化の過程で感染したレトロウイルス由来のゲノム配列であり、その発現異常はさまざまな悪性腫瘍の発生、増殖、進展に関連しています。また、HERVの活性化は「viral mimicry[用語5]」として抗腫瘍免疫を亢進させる作用があり、治療標的としても注目されています。しかし、肝がんにおけるHERVの役割やその制御機構については、ほとんど解明されていませんでした。
SETDB1はヒストンH3K9(ヒストンH3の9番目のリジン残基)のメチル化修飾を担う酵素であり、遺伝子およびレトロエレメント(RE)[用語6]の発現を抑制する働きが報告されています。また、SETDB1は肝がんを含む多くの悪性腫瘍で高発現しており、がん促進機能を有することが報告されています。
ヒト肝がんにおける内在性ウイルス発現を網羅的かつ大規模に解析した初めての研究によって、SETDB1によって発現制御されるHERVを同定し、その臨床的意義について解析を行いました。
研究成果
肝がん組織に内在する多様なウイルス遺伝子群を臨床検体で解析するため、NCBI dbGaPからTCGA症例の一次データへのアクセス許可を取得しました(Project ID: 34527)。肝がん242症例のRNA-seq解析の一次データをスーパーコンピューター「SHIROKANE」で再解析した(EV242)結果、13,062個のHERV エレメントを含む、合計33,966個のREが確認されました。
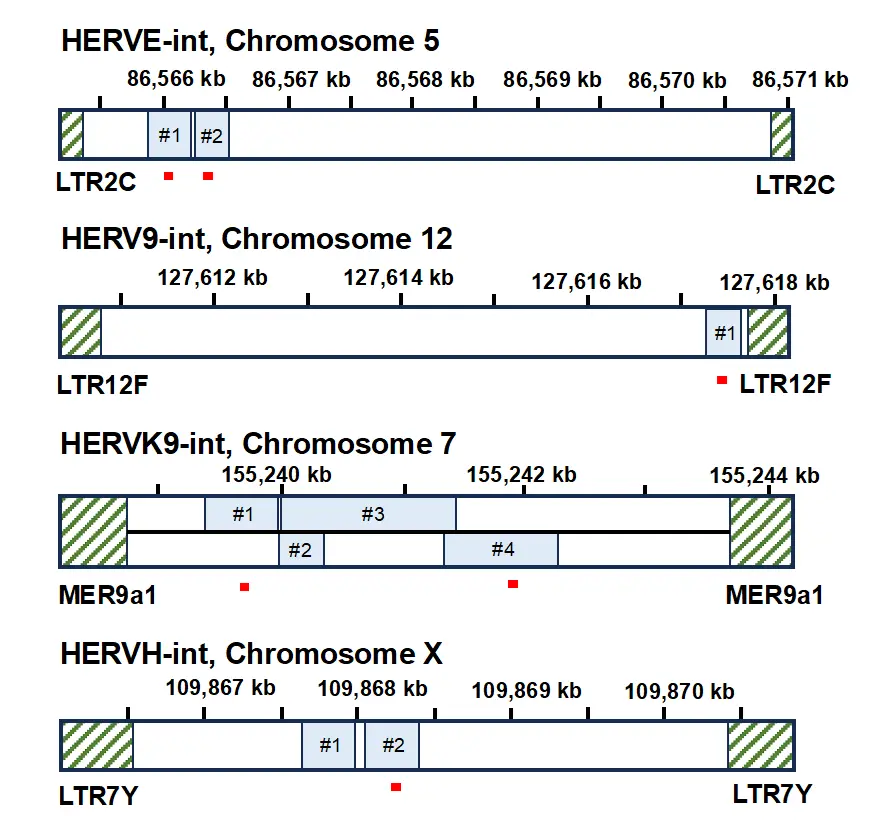
次にSETDB1と REの発現について検討したところ、両者の発現には逆相関が認められました(R=-0.723; p=2.297×10-40, 図1)。SETDB1が高発現している肝がんで発現が低いREとして、9つのHERVが同定されました。これら9つのHERVは、長鎖末端反復配列(LTR)[用語7]に囲まれた特有の構造に基づいて4つのHERVクラスターに分類されました(図2)。
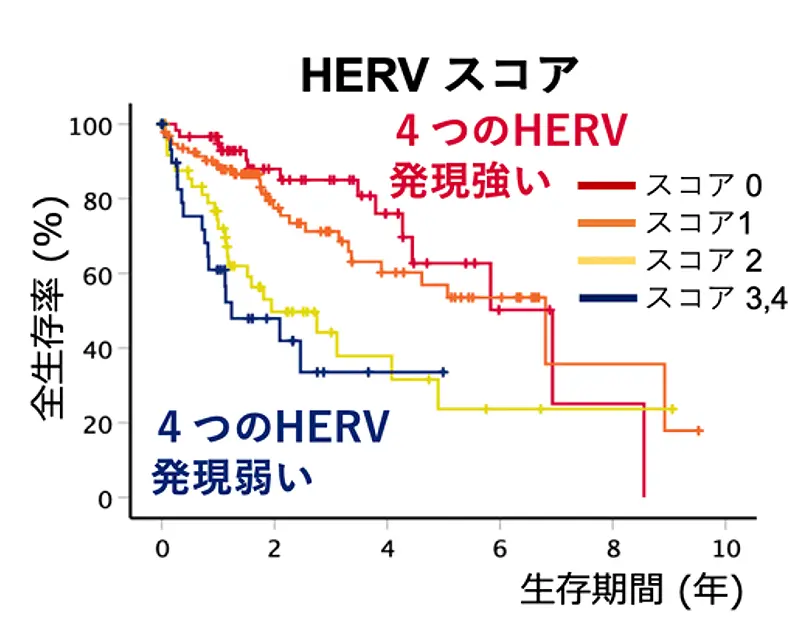
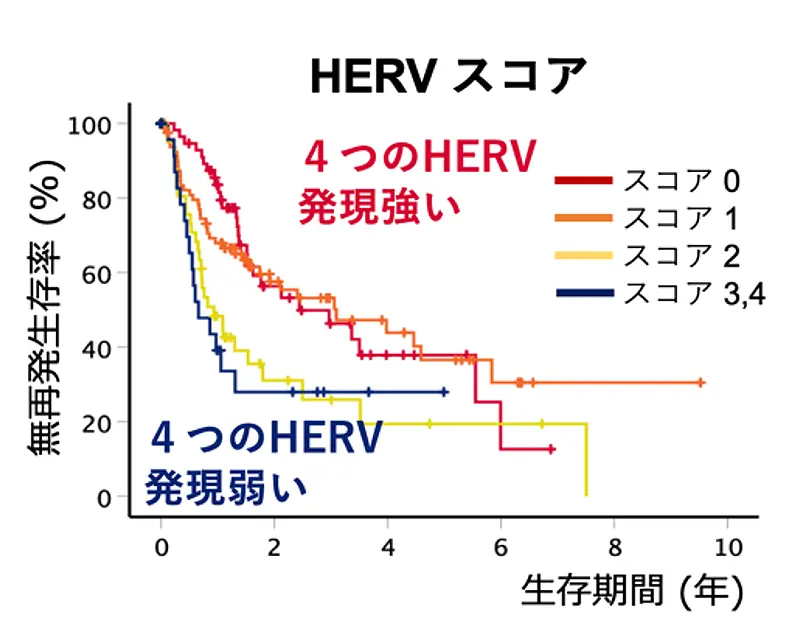
さらに、これら4つのHERVについて各エレメントの低発現をスコア「1」として合計したところ、スコアが高いほど肝がん患者の全生存率および無再発生存率が低下することが明らかになりました(図3)。
SETDB1発現をノックダウンした肝がん細胞株では、4つのHERVエレメントの発現がヒストンH3K9me3の低下を介して上昇しました。加えて、ISG15やIFI30などの複数のインターフェロン誘導遺伝子[用語8]の発現が誘導され、SETDB1-HERV経路を介した「viral mimicry」と抗腫瘍免疫反応の活性化が推測されました。
また、SETDB1をノックダウンした肝がん細胞では、細胞増殖能、遊走能、運動能が低下することが確認されました。その原因の一つとして、がん抑制機能を持つ遺伝子群(RASSF4や LRP1など)の発現亢進が明らかになりました。
本研究では、SETDB1によって発現抑制される4つのHERVを同定しました。これらHERVの発現低下は予後不良を的確に反映する指標となることが示され、腫瘍免疫を標的とした新たな治療戦略の可能性が示唆されました。
社会的インパクト
研究チームは、ヒト肝がんで特異的に発現低下するHERVエレメントが、新たな予後予測のバイオマーカーとなる可能性を示しました。現在、肝がん治療においては免疫チェックポイント阻害薬が第一選択薬とされていますが、その効果が得られるのは一部の症例に限られています。一方で、viral mimicryを介したインターフェロン反応の活性化は、抗腫瘍免疫を強化する可能性があります。
本研究ではHERVに着目することで、新しい予後マーカーの可能性を示すとともに、SETDB1-HERV経路を標的とした新たな治療アプローチの実現性を提示しました。今後、この発見が臨床応用されることで、肝がん患者に対する治療の選択肢が大幅に拡大し、治療効果の向上が期待されます。
今後の展開
現在、SETDB1を標的としたいくつかの阻害薬が報告されていますが、いまだ臨床での使用には至っていません。そのため、SETDB1治療薬の早急な開発が求められています。また、マウスモデルを用いた研究により、HERVの活性化と免疫療法を組み合わせた併用療法の有効性と安全性を検証することが重要です。このような研究が進展すれば、肝がん治療における新たな治療戦略の実現につながる可能性があります。
付記
本研究は文部科学省科学研究費補助金、国立研究開発法人日本医療研究開発機構(AMED)「肝炎等克服実用化研究事業」および「次世代がん医療創生研究事業」(P-CREATE)、高松宮妃癌研究基金研究助成金などのもとにおこなわれたものです。
用語説明
- [用語1]
- TCGA(The Cancer Genome Atlas):アメリカの国立がん研究所(NCI)と国立ヒトゲノム研究所(NHGRI)が共同で開始した大規模ながん研究プロジェクト。TCGAデータベースには33種類以上のがんに関する11,000人以上の患者データが含まれている。
- [用語2]
- SETDB1:ヒストンH3の9番目のリジンをトリメチル化するヒストンメチル化酵素。
- [用語3]
- ヒト内在性レトロウイルス(HERV):レトロエレメントの一種で、進化の過程でレトロウイルスの感染によりヒトゲノム内に残存したレトロウイルス由来のゲノム配列である。ヒトゲノムの約8%を占める。
- [用語4]
- インターフェロン反応:体の細胞が作る「防御シグナル」の一種で、免疫システムを介してがん細胞を抑える効果を持つ。
- [用語5]
- viral mimicry:細胞内で発現した分子や遺伝情報がウイルス感染時と似たような状態を引き起こし、免疫システムを活性化する現象。
- [用語6]
- レトロエレメント:ゲノム内に存在する特定の遺伝配列で、レトロウイルスに由来したDNAの一種。レトロエレメントの発現変化は近傍遺伝子の発現や免疫反応など多くの影響をもたらす。
- [用語7]
- 長鎖末端反復配列(LTR):ウイルスやレトロエレメント配列の両端に位置し、複製や遺伝子発現の調節に関与する反復DNA配列。
- [用語8]
- インターフェロン誘導遺伝子:インターフェロンの刺激を受けて発現が誘導される遺伝子で数百種類が同定されている。
論文情報
- 掲載誌:
- JHEP Reports
- 論文タイトル:
- Identification and clinical implications of endogenous retrovirus elements suppressed by SETDB1 in hepatocellular carcinoma
- 著者:
- Yosuke Igarashi, Yoshimitsu Akiyama, Shu Shimada, Shuichi Watanabe, Megumi Hatano, Keita Kodera, Kohei Okazaki, Yoshiaki Tanji, Shu Tsukihara, Tomohiko Taniai, Atsushi Nara, Masahiro Yamane, Atsushi Kamachi, Kentaro Umemura, Koya Yasukawa, Hiroaki Ono, Keiichi Akahoshi, Minoru Tanabe, Koichiro Haruki, Kenei Furukawa, Toru Ikegami, Shinji Tanaka
研究者プロフィール
田中真二 Shinji TANAKA
東京科学大学 大学院医歯学総合研究科 分子腫瘍医学分野 教授
研究領域:分子腫瘍医学、消化器外科学
秋山好光 Yoshimitsu AKIYAMA
東京科学大学 大学院医歯学総合研究科 分子腫瘍医学分野 講師
研究領域:分子腫瘍医学、癌エピジェネティクス
五十嵐陽介 Yosuke IGARASHI
東京科学大学 大学院医歯学総合研究科 分子腫瘍医学分野 連携研究員
研究領域:分子腫瘍医学、肝胆膵外科学
関連ページ
お問い合わせ
取材申込み
東京科学大学 総務企画部 広報課
- Tel
- 03-5734-2975
- Fax
- 03-5734-3661
- media@adm.isct.ac.jp