ポイント
- 脳や脊髄でRNAスプライシングや翻訳を高効率に制御できる新しい核酸医薬Chol-HDO[PMO]を開発しました。
- 安全性の高いPMOにHDO構造と脂質リガンドを組み合わせることで、従来の核酸医薬で問題となっていた安全性の課題を抑え、有効性と効果の持続性を大幅に向上させました。
- 塩基配列を変えるだけで多様な遺伝子を標的化できるため、中枢神経疾患に対する幅広い創薬応用が期待されます。
概要
東京科学大学(Science Tokyo)核酸・ペプチド創薬治療研究センターの柳平貢特任助教(研究当時、現在:非常勤講師)らの研究グループは、中枢神経を標的とした高い有効性と安全性を両立できる核酸医薬[用語1]を開発しました。
核酸医薬は、これまで治療法がなかった神経難病に対する新しい創薬技術として期待されています。しかし、有効性が十分でなかったり、髄腔内投与で炎症反応などの副作用が見られることがあるなど、有効性と安全性の両面に課題がありました。そのため、有効性の向上と安全性の確保を同時に実現する新しい核酸医薬の開発が求められていました。
本研究では、ホスホロジアミデートモルフォリノオリゴマー(PMO)[用語2]とRNAからなるヘテロ二本鎖核酸(HDO)[用語3]構造を合成し、さらにコレステロールを結合させたChol-HDO[PMO]を作製しました。Chol-HDO[PMO]を中枢神経に投与したところ、高いスプライシング制御[用語4]効率および翻訳制御効率を示しました。また、その効果の持続時間が長く、安全性にも優れていることが明らかになりました。
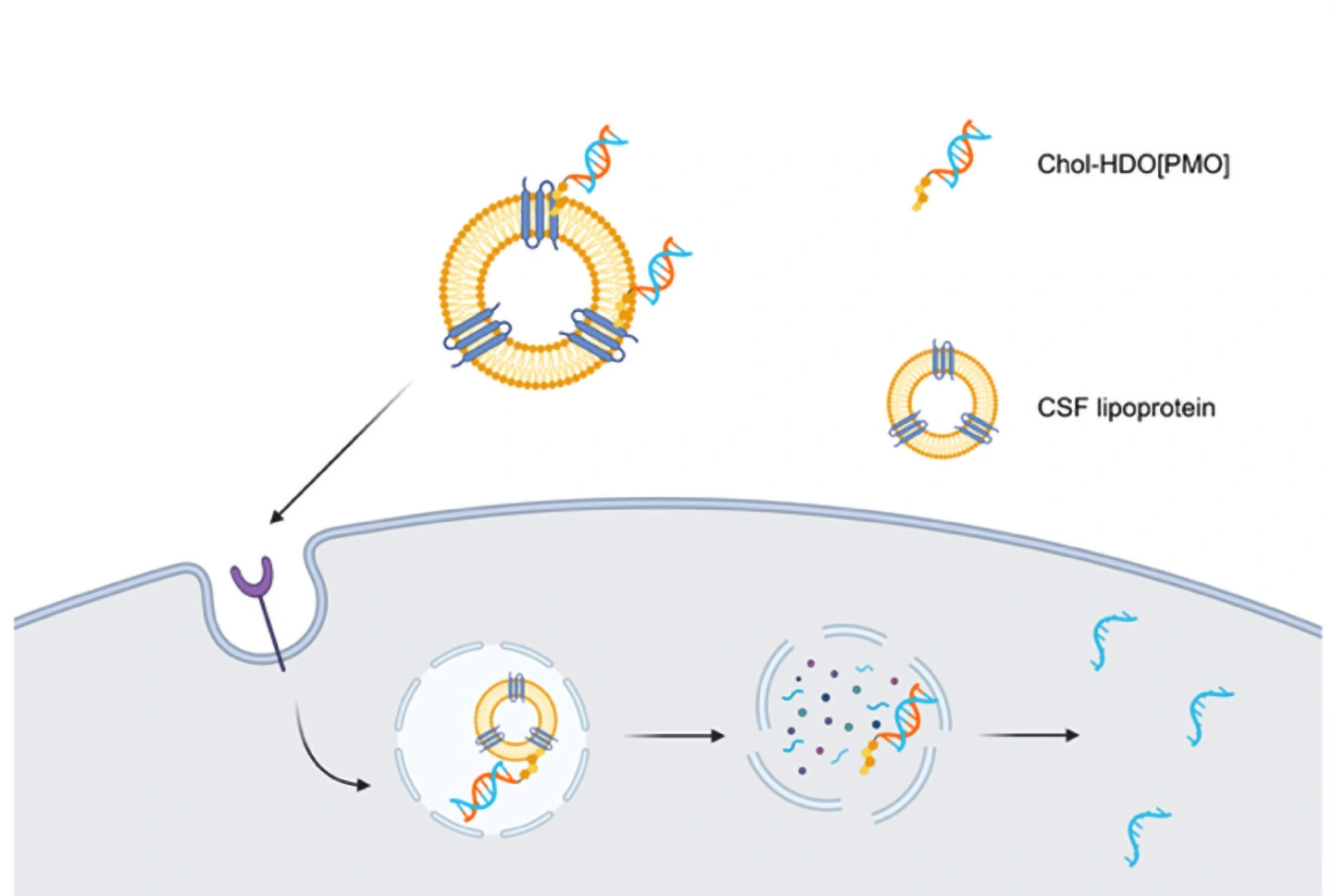
さらに、Chol-HDO[PMO]の優れた効果には、髄液中のリポタンパク質[用語5]との結合が重要であることを見いだしました。一方で、Chol-HDO[PMO]の一部の化学構造を改変するとリポタンパク質との結合が弱まり、効果が減弱することも確認しました。
Chol-HDO[PMO]は、塩基配列を適切に設計することでさまざまな遺伝子を標的化できるため、中枢神経に影響を与える遺伝子疾患に対する有望な医薬技術基盤となることが期待されます。
本成果は、2025年12月22日付(ロンドン時間)の「Nature Communications」誌に掲載されます。
背景
近年、アンチセンスオリゴヌクレオチド(ASO)[用語6]治療は中枢神経疾患へと適用範囲を広げています。特に、遺伝性筋萎縮性側索硬化症(ALS)や脊髄性筋萎縮症(SMA)など、従来は治療が難しかった中枢神経の難治性疾患に対して、国内外でASO新薬が承認されています。中でもステリック・ブロック型ASOは、標的RNAのスプライシングや翻訳を制御できることから、非遺伝性ALSや遺伝性小児てんかんなど、さまざまな疾患で治療手段としての応用が期待されています。
しかし、現行のASOには多くの未解決の課題があります。たとえば髄腔内投与を行った際には、麻痺や鎮静といった急性毒性が報告されています。また、免疫反応を惹起する場合や、遅発性の毒性を引き起こす可能性があることも問題とされています。治療効果の面でも、効果が弱い、持続性が不十分である、腰椎穿刺で投与した薬剤が脳まで十分に到達しないなど、複数の課題が指摘されています。
特に脳脊髄疾患の治療では、核酸医薬は腰椎穿刺によって患者さんに投与されているため、頻回の髄腔内投与は大きな負担となります。このような背景から、高い安全性と高い効果を両立する新しい核酸医薬技術の開発が求められていました。
そこで研究グループは、安全性が高い人工核酸であるホスホロジアミデートモルフォリノオリゴマー (PMO)に着目しました。研究グループがこれまで開発を進めてきたヘテロ二本鎖核酸(HDO)構造[参考文献1]にPMOを組み込み、さらにコレステロールを結合させたChol-HDO[PMO]を設計・合成し、中枢神経投与時の効果を検証しました。
研究成果
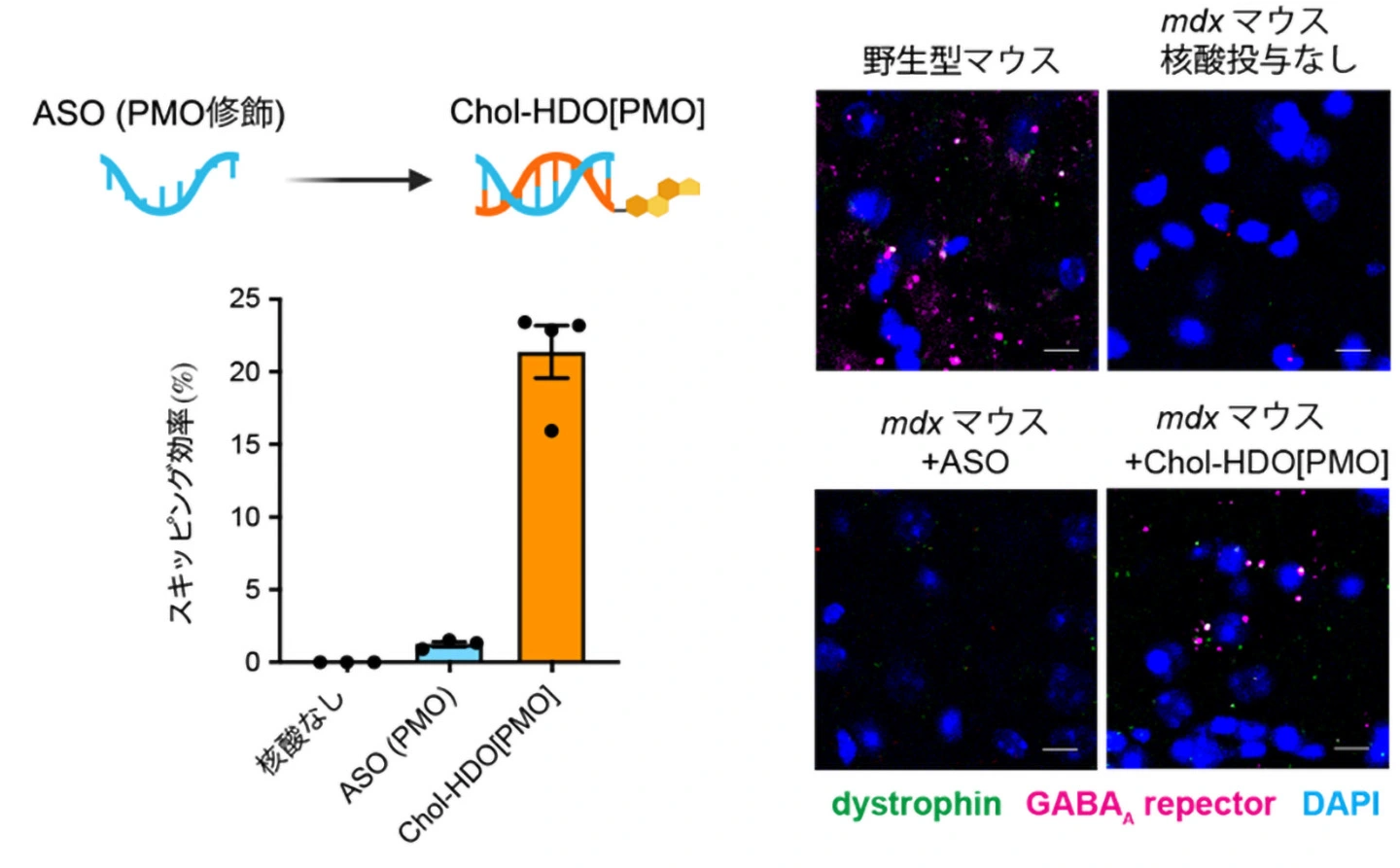
研究グループはまず、dmd遺伝子エクソン23をスキップさせるよう設計した塩基配列を用いてChol-HDO[PMO]を合成し、mdxマウス[用語7]の脳室内に投与しました。その結果、Chol-HDO[PMO]は従来の一本鎖ASOと比較して、最大で16倍という高いスキッピング効果を示しました。さらに、Chol-HDO[PMO]は1回の投与で効果がより長く持続し、脳から離れた腰髄に投与した場合でも脳で高い効果を示しました。
同様に、SOD1遺伝子の翻訳を抑制するよう設計した塩基配列からChol-HDO[PMO]を合成し、モデルマウスに投与したところ、従来の一本鎖ASOよりも強い翻訳抑制効果を示しました。このことから、Chol-HDO[PMO]は塩基配列を変えるだけで多様な標的遺伝子のスプライシングや翻訳を高効率に制御できることが示されました。
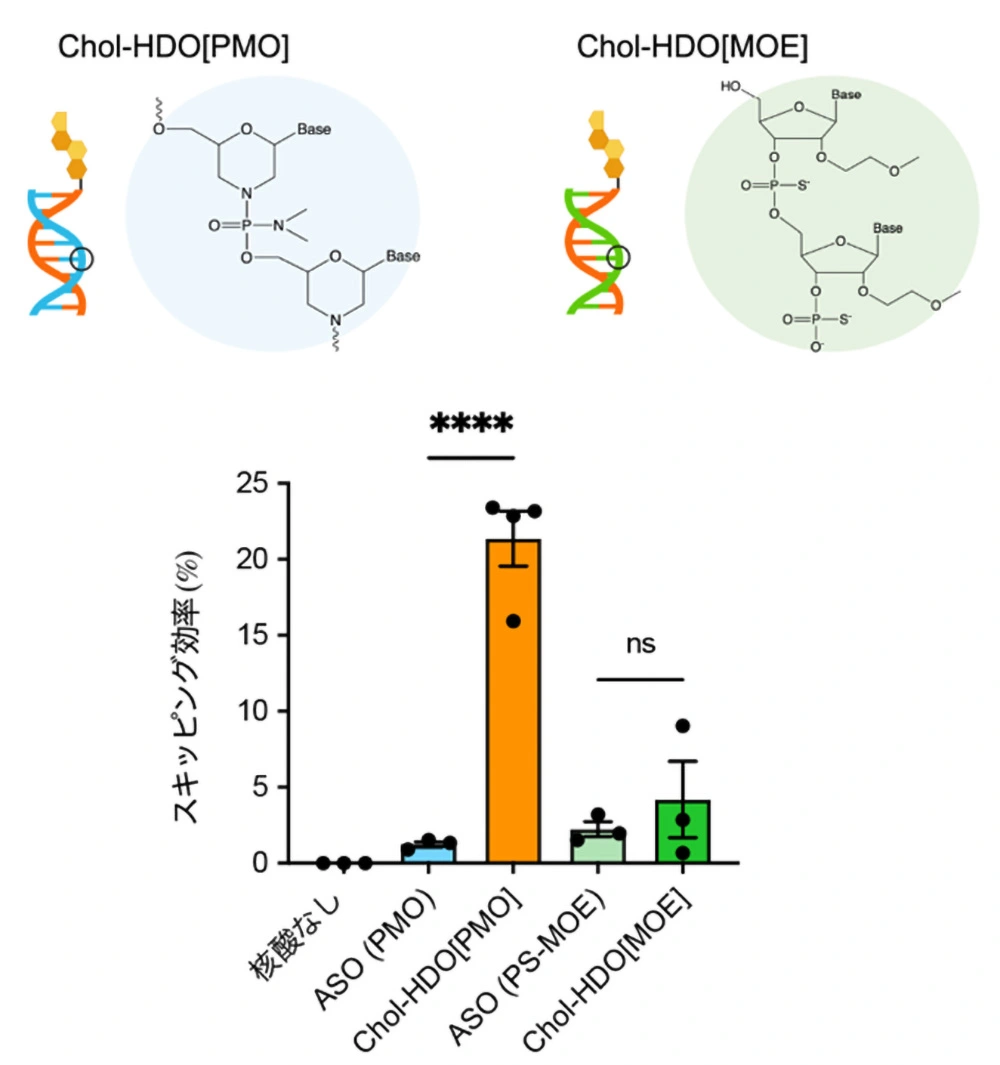
興味深いことに、PMOの代わりにPS-MOE[用語8]と呼ばれる別の化学構造の人工核酸を導入して作製したChol-HDO[MOE]は、Chol-HDO[PMO]のような優れた効果を示しませんでした。この結果は、同じHDO構造であっても含まれる核酸分子の化学構造によって、髄腔内投与時の活性が大きく異なることを示唆しています。
次に、Chol-HDO[PMO]の高い活性の背景を調べるため、ハイブリダイゼーションELISA法[用語9]を用いて組織内の核酸濃度を評価しました。その結果、Chol-HDO[PMO]では組織中濃度が大きく向上した一方、Chol-HDO[MOE]では同様の上昇は見られませんでした。このことから、両者の効果の差には核酸の組織へのデリバリー効果が関与していることがわかりました。また、この結果はHDOに含まれる人工核酸の化学構造が中枢神経組織へのデリバリーに強く影響することを示しています。
さらに研究グループは、Chol-HDO[PMO]が髄液中のリポタンパク質と結合して効率的に中枢神経組織へデリバリーされるのに対し、Chol-HDO[MOE]はリポタンパク質との相互作用が弱いことを明らかにしました。
安全性の観点では、一本鎖ASOを投与したマウスでは鎮静が見られた一方、Chol-HDO[PMO]ではそのような副作用は認められませんでした。さらに、Chol-HDO[PMO]投与後には免疫反応の惹起や長期的な体重変化も見られず、良好な安全性プロファイルを示しました。
社会的インパクト
核酸医薬は、これまで治療法が存在しなかった神経疾患に対する有望な治療選択肢として期待されていますが、その安全性と有効性には臨床応用上の課題が残されていました。本研究では、特に脳や脊髄といった中枢神経に焦点を当て、既存の核酸医薬に比べて安全性と有効性をともに向上させた新しい核酸医薬Chol-HDO[PMO]を開発しました。
Chol-HDO[PMO]は、塩基配列を適切に設計することでさまざまな遺伝子を標的化できるため、中枢神経に影響を及ぼす多様な遺伝子疾患に対する、新たな医薬技術基盤としての発展が期待されます。
今後の展開
本研究では、Chol-HDO[PMO]が中枢神経への投与において優れた有効性と安全性を示すことを確認しました。一方で、化学構造を変更すると有効性が大きく変化することから、化学構造の最適化により、副作用のさらなる低減や効果の一層の向上が期待されます。
これらの成果を踏まえ、今後は核酸医薬を取り巻く"From bench to bedside"の壁を打ち破り、臨床応用の加速につなげていきたいと考えています。
付記
本研究は、日本医療研究開発機構(AMED)の革新的バイオ医薬品創出基盤技術開発事業(18am0301003h0005)および先端的バイオ医薬品創出基盤技術開発事業(20am0401006h0002)、ならびに文部科学省(MEXT)の科学研究費助成事業(科研費)・基盤研究(A)(19H01016)、基盤研究(A)(22H00440)、若手研究(24K18251)の助成を受けて行われました。また、本研究は東京医科歯科大学の重点研究領域助成(RD-2)および武田薬品工業株式会社との共同研究費の支援を受けて行われました。
参考文献
- [参考文献1]
- Nagata T, et al. : Cholesterol-functionalized DNA/RNA heteroduplexes cross the blood–brain barrier and knock down genes in the rodent CNS. Nat Biotechnol. 2021. doi:10.1038/s41587-021-00972-x
用語説明
- [用語1]
- 核酸医薬:DNA、RNAやその化学構造を変化させた化合物で、生体内のRNAや一部のタンパク質と結合して作用するよう設計された薬剤。
- [用語2]
- ホスホロジアミデートモルフォリノオリゴマー(PMO):モルフォリン環を持ち、ホスホロジアミデート結合を特徴とする人工核酸の一種。電荷を持たず、細胞毒性が低い利点がある一方、細胞膜の透過性が低く、組織移行性が低い。
- [用語3]
- ヘテロ二本鎖核酸(HDO):本研究チームが開発してきた二本鎖構造の核酸医薬。一方はRNA鎖であり、もう一方には様々な人工核酸を導入することができる。
- [用語4]
- スプライシング制御:特定の遺伝子のpre-mRNAの特定のエクソンを、mRNAに取り込ませる、もしくは取り込ませない(スキップさせる)よう制御すること。
- [用語5]
- リポタンパク質:ApoEなどのアポリポタンパク質と脂質が結合してできた高分子構造体。生体内の脂質輸送に重要な役割を果たす。
- [用語6]
- アンチセンスオリゴヌクレオチド(ASO):DNAもしくはその誘導体からなる一本鎖の核酸医薬。結合したRNAを分解するギャップマー型と、分解せずにスプライシングや翻訳を制御するステリック・ブロック型がある。
- [用語7]
- mdxマウス:X染色体上のジストロフィン遺伝子(dmd)のエクソン23に点突然変異をもち、ジストロフィンタンパク質が産生されない。デュシェンヌ型筋ジストロフィーのモデルマウスとして知られる。筋症状に加えすくみ行動などの中枢神経症状もきたす。エクソン23をスキッピングすることで、ジストロフィンタンパク質の産生を回復させることができる。
- [用語8]
- PS-MOE:ホスホロチオエート、及び2'-O-メトキシエチルと呼ばれる化学修飾が施された人工核酸。
- [用語9]
- ハイブリダイゼーションELISA法:核酸を特異的に検出・定量するために、ハイブリダイゼーション(相補的塩基対形成)と ELISA(酵素免疫測定法)を組み合わせた手法。これにより、組織に送達された核酸医薬を定量できる。
論文情報
- 掲載誌:
- Nature Communications
- タイトル:
- Morpholino–RNA duplex exhibits robust, sustained, and safe steric-block antisense activity by intracerebroventricular and intrathecal injection
- 著者:
- Mitsugu Yanagidaira*, Tetsuya Nagata*, Juri Hasegawa, Takashi Ishii, Satoe Ebihara, Makiko Nawa, and Takanori Yokota* (*corresponding author)
研究者プロフィール
柳平 貢 Mitsugu Yanagidaira
東京科学大学 核酸・ペプチド創薬治療研究センター 特任助教(研究当時、現在:核酸・ペプチド創薬治療研究センター/脳神経病態学分野(脳神経内科)非常勤講師、兼 Brigham and Women's Hospital Research Fellow)
研究分野:脳神経内科学、核酸医薬、遺伝子変異
