ポイント
- インスリノーマが引き起こす低血糖の主因が、「インスリン合成の増加」ではなく「分泌の異常」にあることを解明。
- インスリノーマの中で、インスリンを過剰に分泌する細胞集団を特異的に識別できる新規遺伝子「DOCK10」を発見。
- DOCK10 の下流に位置する Cdc42 経路を阻害すると、インスリノーマにおけるインスリン過剰分泌が抑制されることを提示。
- 研究の過程で、ヒトインスリノーマが産生するホルモンを長期間維持できるインスリン分泌オルガノイドの培養技術を確立。
概要
東京科学大学病院 長寿・健康人生推進センター/消化器内科の伊藤剛助教、および同 大学院医歯学総合研究科 消化器病態学分野の勝田景統大学院生らの研究チームは、独クリスティアン・アルブレヒト大学キール 臨床分子生物学研究所(Institute of Clinical Molecular Biology, Christian-Albrecht-University)のフィリップ・ローゼンスティール(Philip Rosenstiel)教授と国際共同研究を行い、インスリノーマにおけるイスリン過剰分泌の中核を担う原因遺伝子DOCK10を世界で初めて特定しました。
本研究では、多数の手術検体と患者由来オルガノイドを組み合わせた網羅的解析から、インスリノーマではインスリン合成よりも「分泌機構の異常」が主因であることを明らかにしました。さらに、DOCK10–Cdc42 経路の阻害により異常なインスリン分泌が抑制されることを実証し、インスリン分泌能を長期間維持できるヒトインスリノーマオルガノイド培養系も確立しました。本成果により、DOCK10 が分泌病変の新たな診断マーカーおよび治療標的となる可能性が示され、将来的な診断技術や創薬開発への応用が期待されます。
この研究成果は、国際科学誌「Cellular and Molecular Gastroenterology and Hepatology」において、2025年12月11日付のオンライン版で公表されました。
背景
膵神経内分泌腫瘍は人口10万人あたり2〜3人が発症する稀な膵臓腫瘍[参考文献1]ですが、近年は画像診断や内視鏡技術の進歩により診断数が年々増加しています。膵神経内分泌腫瘍は、ホルモン分泌に伴う症状の有無により機能性と非機能性に分類されます。その中でもインスリノーマは、機能性膵神経内分泌腫瘍の中で最も頻度が高く、腫瘍が小さい段階から過剰なインスリン分泌により、意識障害を伴う重篤な低血糖発作を引き起こします[参考文献2]。
多くのインスリノーマは単発で良性ですが、肝転移を伴う悪性例では、腫瘍内に「インスリンを分泌する病変」と「分泌しない病変」が混在することが知られています[参考文献3]。症状改善のために分泌病変のみを選択的に切除するケースもあり、その際には「どの病変がインスリンを分泌しているか」を正確に特定することが不可欠です。しかし現状では、侵襲性の高い検査に頼らざるを得ません。また、高齢や併存疾患により手術が困難な場合には薬物療法が選択されますが、副作用や効果の限界があるため、治療選択肢が非常に限られているのが現状です[参考文献4]。
このように、インスリン分泌病変を正確に同定する新たな診断技術の開発と、インスリン過剰分泌を安全に抑制する新規薬物治療の創出が強く求められています(図1)。しかしインスリノーマは希少疾患であり、症例の蓄積不足や検体採取の困難さから、研究が進みにくい状況が続いていました。
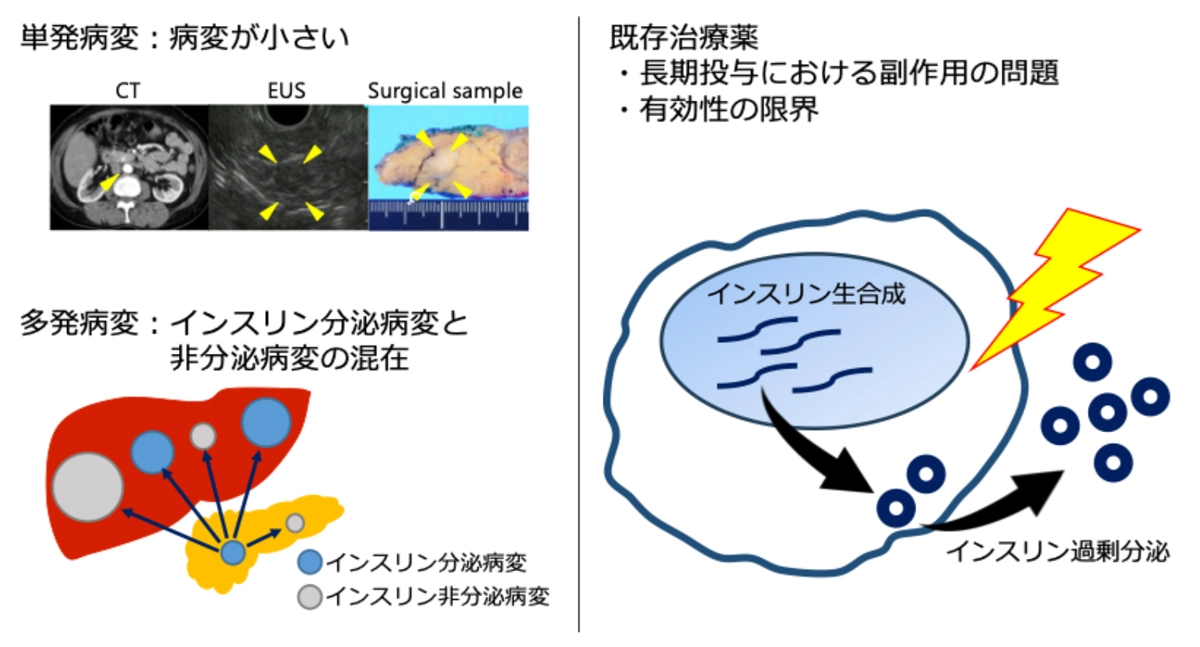
本学肝胆膵外科は膵神経内分泌腫瘍の豊富な症例数を有し、多くの手術実績があります。そこで、本学肝胆膵外科(伴大輔教授)と共同で、消化器病態学分野(岡本隆一教授)が得意とする腫瘍病態解析手法として近年注目されるオルガノイド技術[用語1]を応用しました。さらに、手術検体およびオルガノイドを用い、Institute of Clinical Molecular Biology(キール大学・ドイツ)が得意とする網羅的遺伝子解析技術[用語2]組み合わせ、インスリノーマにおけるインスリン分泌病変を特異的に標識する遺伝子の探索と、インスリン分泌異常の病態解明を目的とした国際共同研究を実施しました。
研究成果
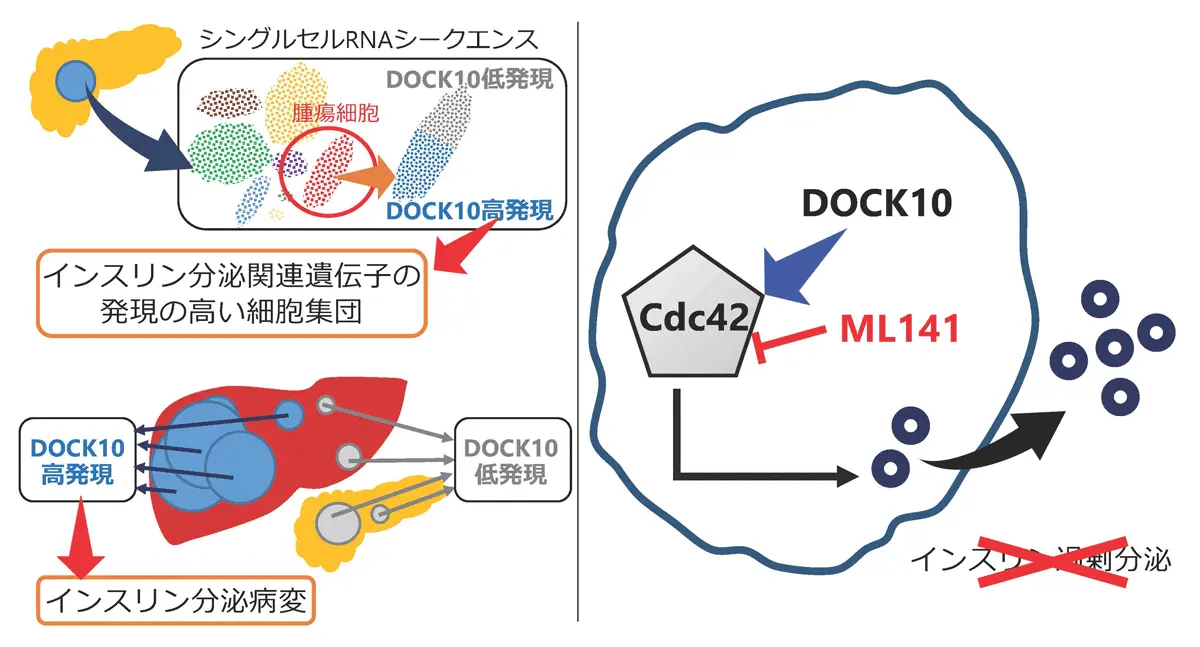
研究グループは、手術検体と患者由来オルガノイドを用いて、正常膵や非機能性膵神経内分泌腫瘍では認められず、インスリノーマに特徴的に発現する遺伝子群を網羅的に解析しました。その結果、インスリノーマではインスリンの「合成」よりも「分泌」に異常があることが示唆されました。
さらに、転移先でインスリン分泌能を失った腫瘍と、分泌能を維持した腫瘍を比較した免疫染色による解析に加え、インスリノーマとしては初となるシングルセルRNAシークエンス[用語3]を行った結果、インスリン分泌病変を特異的に標識する新規遺伝子DOCK10[用語4]を同定しました。
DOCK10の機能を検証するため、研究チームは初めて、インスリン分泌能を1ヵ月以上維持できるヒトインスリノーマオルガノイドの長期培養系を確立しました。このモデルおよび培養細胞を用いた解析により、DOCK10およびその下流分子Cdc42[用語5]を阻害すると、インスリン過剰分泌が抑制されることを発見しました。さらに、インスリノーマ移植マウスモデル[用語6]でも、同経路の阻害により異常なインスリン分泌が改善し、生存率が向上することを明らかにしました。
本成果により、DOCK10がインスリン分泌病変を特定する新規バイオマーカー[用語7]となり得ること、さらにDOCK10–Cdc42 経路が新たな治療標的となる可能性が示されました(図2)。
社会的インパクト
本研究は、これまで治療選択肢が限られていた希少腫瘍インスリノーマに対し、新規診断マーカーおよび新規治療標的の候補を提示するものであり、世界的にも前例が少ない点で大きな意義があります。特に、非侵襲的に分泌病変を同定できるようになれば、侵襲的検査への依存を減らし、患者の負担軽減に寄与します。また、DOCK10–Cdc42経路を抑制する薬剤の開発が進めば、手術が困難な症例に対する新たな内科的治療の実現が期待されます。
さらに、本研究で確立したヒトインスリン分泌細胞の長期培養モデルは、インスリン分泌異常の研究に応用可能な新たなプラットフォームとなり、糖尿病をはじめとする代謝疾患の研究や創薬にも波及効果をもたらすと考えられます。
今後の展開
本研究は症例数が限られていたため、今後は症例数を増やした大規模コホートにおいて、DOCK10 の発現とインスリン分泌能との関連をより精密に検証する必要があります。また、DOCK10の機能解析をさらに進め、関連するシグナル経路を標的とした新規阻害剤の開発や、同経路を標識して画像化する核医学診断(シンチグラフィー[用語8])への応用を推進します。
さらに、本研究で得られた知見を応用し、インスリン分泌促進に利用可能な経路を明らかにできれば、糖尿病などの代謝疾患に対する新たな治療戦略につながる可能性があります。今後も本研究成果を基盤として、診断法・治療法のトランスレーショナルリサーチ[用語9]を進めていきます。
付記
本研究は、日本学術振興会(JSPS)科学研究費助成事業(20K22895、21KK0146、21K15967、23K07394、22H00472)、科学技術振興機構(JST)次世代研究者挑戦的研究プログラム(SPRING)(JPMJSP2180)および東京科学大学医歯学系重点領域の助成を受けて実施されました。
参考文献
- [参考文献1]
- 日本神経内分泌腫瘍研究会(JNETS)膵・消化管神経内分泌腫瘍診療ガイドライン第2版作成委員会. 膵・消化管神経内分泌腫瘍(NEN)診療ガイドライン2019(第2版)., 2019.
- [参考文献2]
- Service FJ, McMahon MM, O'Brien PC, et al. Functioning insulinoma--incidence, recurrence, and long-term survival of patients: a 60-year study. Mayo Clin Proc 1991;66:711-9.
- [参考文献3]
- Maekawa A, Kudo A, Kishino M, et al. Hormonal tumor mapping for liver metastases of gastroenteropancreatic neuroendocrine neoplasms: a novel therapeutic strategy. J Cancer Res Clin Oncol 2022;148:697-706.
- [参考文献4]
- Okabayashi T, Shima Y, Sumiyoshi T, et al. Diagnosis and management of insulinoma. World J Gastroenterol 2013;19:829-37.
用語説明
- [用語1]
- オルガノイド技術:ヒトや動物の幹細胞などから、臓器の“ミニチュア版”のような立体構造(オルガノイド)を試験管内で作り出す技術。
- [用語2]
- 網羅的遺伝子解析技術:生体内の多数の遺伝子を一度に調べ、その働きや異常を明らかにする技術。病気の原因解明や治療法開発に役立つ。
- [用語3]
- シングルセルRNAシークエンス:個々の細胞がどの遺伝子をどれだけ発現しているかを調べる解析技術。細胞ごとの違いを高精度に把握でき、病気の詳細な仕組み解明に役立つ。
- [用語4]
- DOCK10:細胞の形や動きを調節するグアニン交換因子というタンパク質をつくる遺伝子。報告はまだ少ないが、免疫細胞などで重要な役割を果たすとされる。
- [用語5]
- Cdc42:細胞の形や運動、増殖などを制御する小さな分子(小型Gタンパク質)。膵臓ではインスリンの分泌に関わるとされる。
- [用語6]
- インスリノーマ移植マウスモデル:マウス由来のインスリノーマ細胞株を皮下に移植して作製する、インスリノーマの病態を再現した研究モデル。治療効果や腫瘍の性質を評価するために用いられる。
- [用語7]
- バイオマーカー:病気の有無や進行、治療効果などを判断するための指標となる物質や遺伝子。血液や組織から測定でき、診断や予後予測に利用される。
- [用語8]
- シンチグラフィー:放射性物質を体内に投与し、その分布を特殊なカメラで撮影して臓器や病変の状態を調べる検査。負担が比較的少なく、機能の評価にも適している。
- [用語9]
- トランスレーショナルリサーチ:基礎研究で得られた知見を、実際の医療に応用するためにつなぐ研究。病気の理解から新しい診断法や治療法の開発までを橋渡しする役割を担う。
論文情報
- 掲載誌:
- Cellular and Molecular Gastroenterology and Hepatology
- タイトル:
- DOCK10 Regulates Insulin Hypersecretion in Insulinoma and Serves as a Diagnostic and Therapeutic Target
- 著者:
- Hiromune Katsuda, Go Ito, Franziska Kimmig, Tomohiro Muto, Neha Mishra, Joana Pimenta Bernardes, Yui Hiraguri, Hironari Yamashita, Akira Ito, Yuko Kinowaki, Takahiro Shin, Satoru Fujii, Masato Miyoshi, Masanori Kobayashi, Daisuke Asano, Yoshiya Ishikawa, Hiroki Ueda, Keiichi Akahoshi, Eriko Katsuta, Yoshihito Kano, Shiro Yui, Yasuhiro Nemoto, Atsushi Kudo, Daisuke Ban, Yasuhiro Asahina, Stefan Schreiber, Mamoru Watanabe, Philip Rosenstiel, and Ryuichi Okamoto.
研究者プロフィール
勝田 景統 Hiromune Katsuda
東京科学大学 大学院医歯学総合研究科 消化器病態学 大学院生
研究分野:消化器病態学
伊藤 剛 Go Ito
東京科学大学病院 長寿・健康人生推進センター/消化器内科 助教
研究分野:消化器病態学
伴 大輔 Daisuke Ban
東京科学大学 大学院医歯学総合研究科 肝胆膵外科学分野 教授
研究分野:肝胆膵外科学
岡本 隆一 Ryuichi Okamoto
東京科学大学 大学院医歯学総合研究科 消化器病態学 教授
研究分野:消化器病態学
関連リンク
お問い合わせ
東京科学大学病院 長寿・健康人生推進センター/消化器内科
助教 伊藤 剛
- gitogast@tmd.ac.jp
- Tel
- 03-5803-5973
- Fax
- 03-5803-0262