ポイント
- PGC-1αというタンパク質がメスに特異的に働く(作用する)ことで、ミトコンドリアのリン脂質合成を促進し、ミトコンドリア機能を高める結果、メスの褐色脂肪組織における高いカロリー消費能を実現していることを、マウスを使った実験で明らかにしました。
- PGC-1αノックアウトマウスなどの遺伝子改変動物を用い、トランスクリプトーム解析、メタボローム解析、リピドーム解析など、多角的かつ網羅的な解析を組み合わせて、この性差メカニズムを詳細に解明しました。
- 本研究成果は、カロリー消費を高める新たなアプローチや薬剤の開発につながる可能性があり、肥満や糖尿病の予防・治療への応用が期待されます。
概要
東京科学大学(Science Tokyo)大学院医歯学総合研究科 分子内分泌代謝学分野の辻本和峰助教、竹内彬大学院生、青木惇大学院生、山田哲也教授らの研究チームは、東京大学 大学院薬学系研究科の河野望准教授、可野邦行助教、青木淳賢教授らの研究チームと共同で、脂肪を燃やしてカロリーを消費す褐色脂肪組織(BAT;Brown Adipose Tissue)[用語1]に見られる男女差の仕組みを明らかにしました。
女性は男性よりも糖尿病や肥満になりにくいことが知られていますが、その理由は十分に解明されていませんでした。研究グループは、体温を維持するためにエネルギーを消費するBATに着目し、その性差について詳しく調べました。その結果、メスマウスのBATではPGC-1αというタンパク質が多く作られ、メス特有の分子メカニズムを通じてミトコンドリア[用語2]のリン脂質合成を促進し、それによってミトコンドリア機能を向上させることで、高い熱産生機能およびカロリー消費能を担っていることが明らかになりました。
この知見は、個体のカロリー消費における性差に対する新たな理解を促すものです。また、肥満症や肥満に伴う糖尿病は、我が国のみならず世界的にも増加しており、深刻な健康問題の要因となるだけでなく、大きな社会問題ともなっていますが、その予防や改善は容易ではありません。今回得られた知見を発展させることにより、食事療法の実施に加えて、カロリー消費を促進することで肥満症や肥満に伴う糖尿病を予防・改善する手法や、新規薬剤の開発につながることが期待されます。
本成果は、7月14日(現地時間)付で「Nature Communications」誌に掲載されました。
背景
肥満は、2型糖尿病や脂質異常症といった代謝性疾患、さらには脳梗塞や心筋梗塞といった心血管疾患の主な原因の一つです。これらの疾患の有病率の上昇は、深刻な社会問題となっています。女性(特に閉経前の女性)は、同年代の男性に比べて糖尿病や心血管疾患の有病率が低いことが知られています。このような「女性の優位性」については、性ホルモンや遺伝的要因、ライフスタイルなどの観点からさまざまな研究が行われてきましたが、その根本的なメカニズムはまだ十分に解明されていませんでした。
褐色脂肪組織(BAT)は、エネルギー基質を分解して熱エネルギーとして放出する、独自のカロリー消費能を持つ組織です。ヒトにおいては、BATの量が多いほど糖尿病や心血管疾患のリスクが低いことが報告されています[参考文献1]。また、BATは肥満や関連疾患の予防・治療において有望なターゲットとされています。特に女性は、BATの量だけでなく代謝活性も男性より高いことが明らかになっており[参考文献1]、BATが女性の代謝上の利点に寄与している可能性があります。
げっ歯類のBATにおいても、性別による組織学的・機能的な違いが存在することが知られています。たとえば、メスのラットのBATでは、オスに比べてミトコンドリアが大きく密集しており、熱産生を担う脱共役タンパク質1(UCP-1(uncoupling protein-1)[用語3])も、メスで多く発現しています[参考文献2]。これらの知見は、メスのBATがオスよりも代謝活性が高いことを示唆しています。しかし、こうした性差の背景にある分子メカニズムについては、これまで十分に解明されていませんでした。
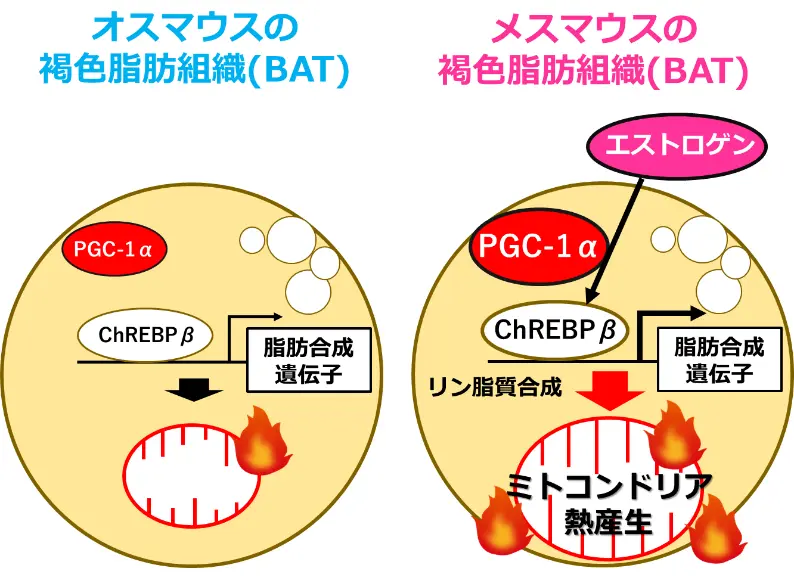
ペルオキシソーム増殖因子活性化受容体γ共活性化因子1α(PGC-1α)は、ミトコンドリアのエネルギー代謝を制御する重要なタンパク質であり、BATにおける熱産生を調節しています。本研究では、BATにおけるPGC-1αの機能に性差があることを発見しました。さらに、メスマウスのBATでは、PGC-1αがオスとは異なる独自のメカニズムによって熱産生およびカロリー消費の調節を促進し、全身のカロリー消費を高める役割を果たしていることを明らかにしました。
研究成果
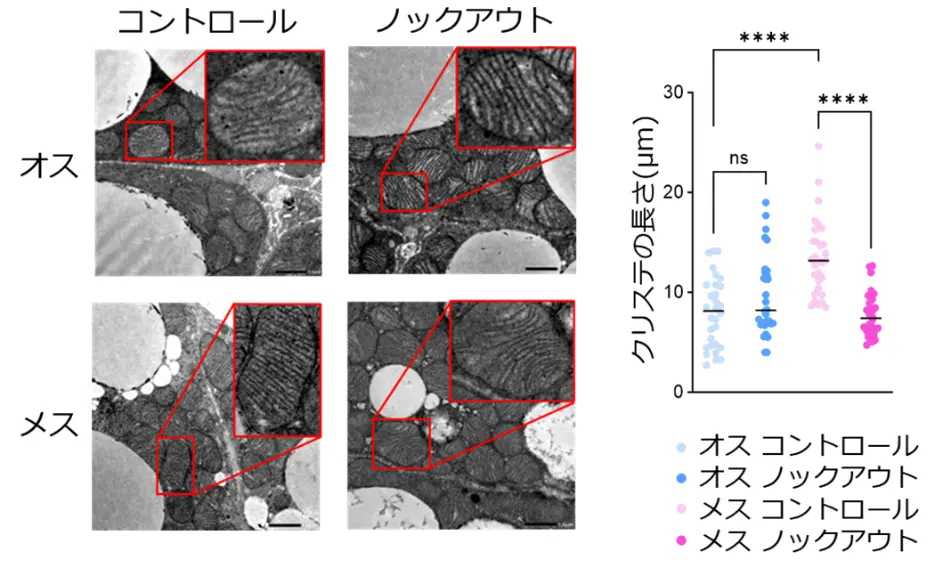
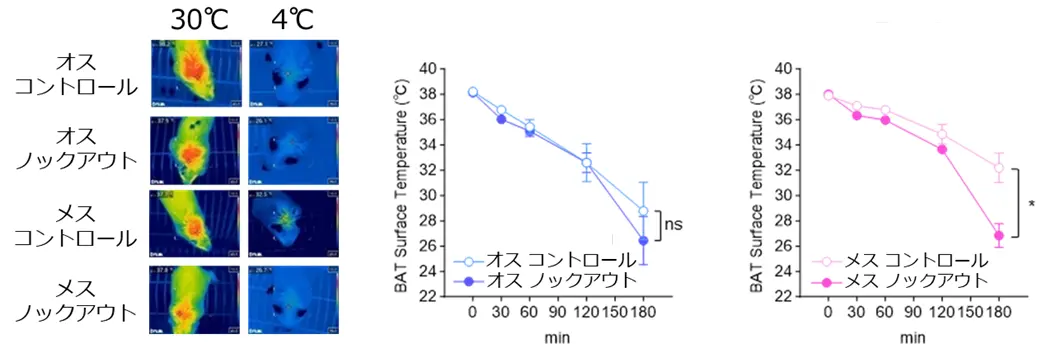
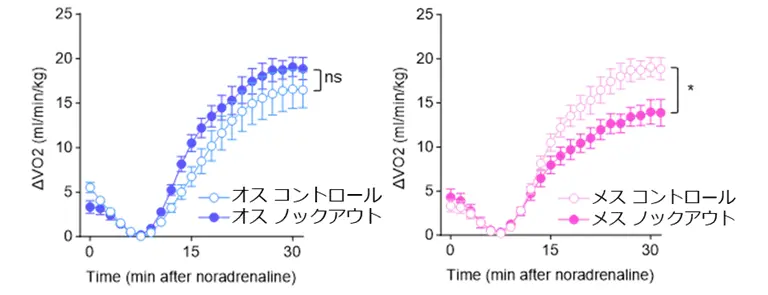
まず、BATの熱産生活性およびカロリー消費能が、オスマウスよりもメスマウスで高いことを確認しました。次に、両性のマウスにおいて脂肪細胞でPGC-1αをノックアウト(除去)したところ、メスでのみミトコンドリアの構造変化(クリステ[用語4]の短縮、図1)およびBATの熱産生・カロリー消費能の低下(図2)が見られました。
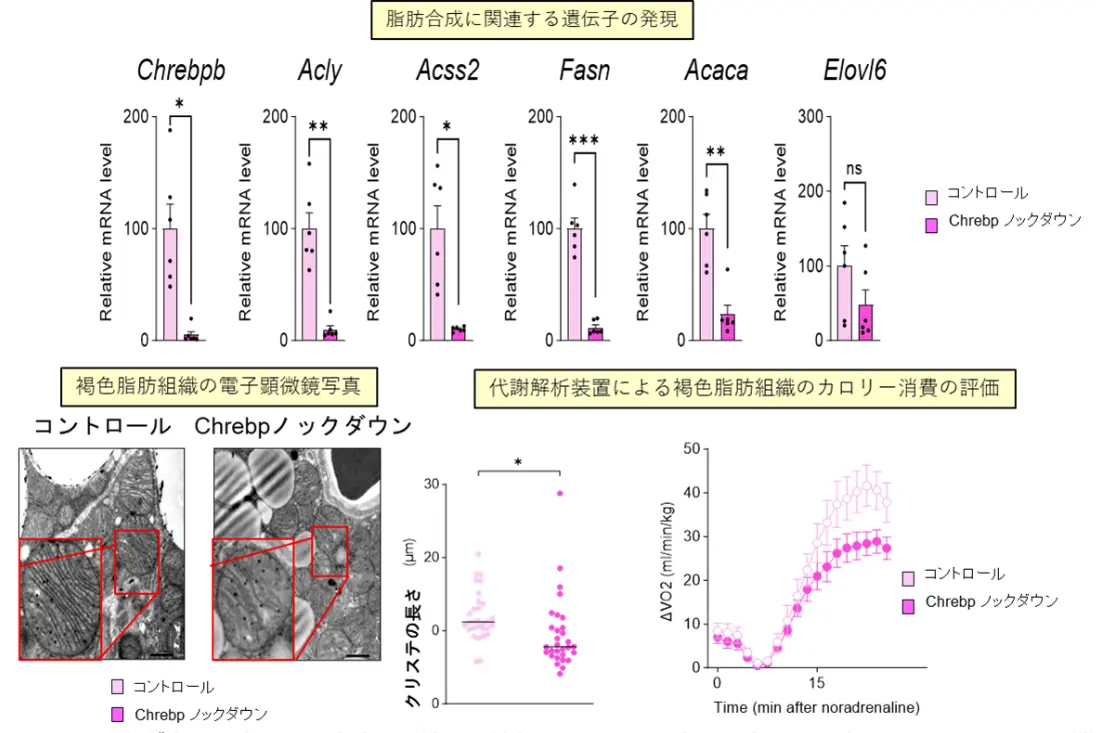
この原因を探るため、遺伝子発現の変化を網羅的に解析した結果、Chrebpβ[用語5]およびその下流の脂肪合成に関連する遺伝子の発現が、メスのノックアウトマウスでのみ低下していることが判明しました(図3)。次に、メスのBATにおいてChrebpβをノックダウン(抑制)すると、脂肪合成に関連する遺伝子の発現が減少し、クリステの短縮ともに、BATのカロリー消費能が低下することが確認されました(図4)。
褐色脂肪組織の電子顕微鏡写真
サーモグラフィーによる褐色脂肪組織の温度の評価
代謝解析装置による褐色脂肪組織のカロリー消費の評価
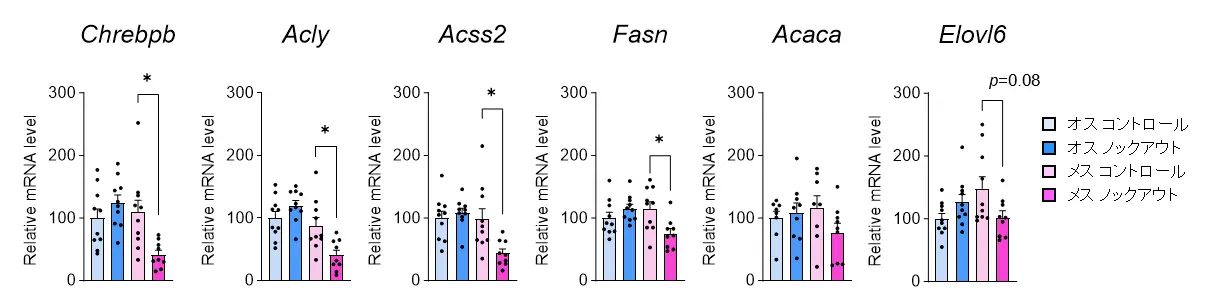
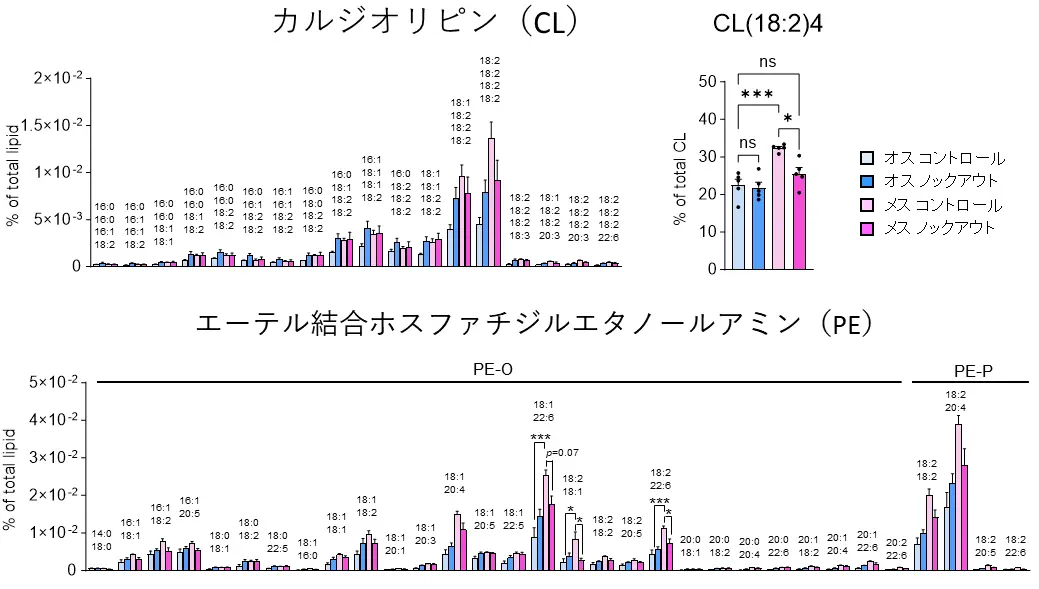
さらに、BATの脂質構成を質量分析計により網羅的に解析したところ、PGC-1αをノックアウトすることで、メスマウスにおいてのみ、ミトコンドリアの構造や機能維持に重要なリン脂質(エーテル結合ホスファチジルエタノールアミン(PE)やカルジオリピン(CL)など)が減少することが明らかとなりました(図5)。
質量分析計による脂質構成の評価
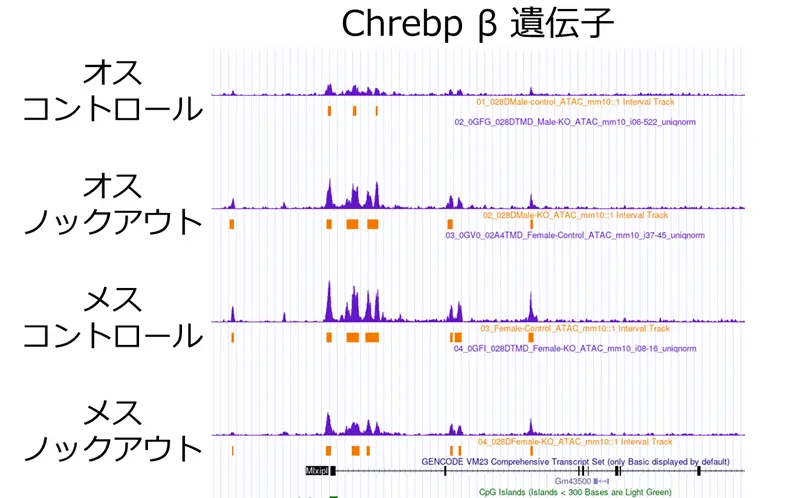
次に、PGC-1αがメス特異的にChrebpβの転写調節に関与している仕組みを明らかにするため、ATACシークエンスを用いてゲノム全体のクロマチンアクセシビリティ[用語6]を評価しました。その結果、Chrebpβの転写開始部位近傍におけるクロマチンアクセシビリティは、メスのBATでオスよりも高く、PGC-1αノックアウトマウスではこの性差が消失していました(図6)。つまり、PGC-1αはメス特異的にChrebpβ遺伝子座のクロマチンを開いた状態に保つことで、同遺伝子の発現を促進していることが示されました。
ATACシークエンスによるクロマチンアクセシビリティの評価
さらに、エストロゲンがメスマウスのBATにおいてのみChrebpβおよび脂肪合成に関連する遺伝子の発現を増加させること、そしてその作用がPGC-1αに依存していることも明らかになりました(図7)。
エストロゲン(E2)の添加が脂肪合成に関連する遺伝子の発現に及ぼす影響の評価(ex vivo)
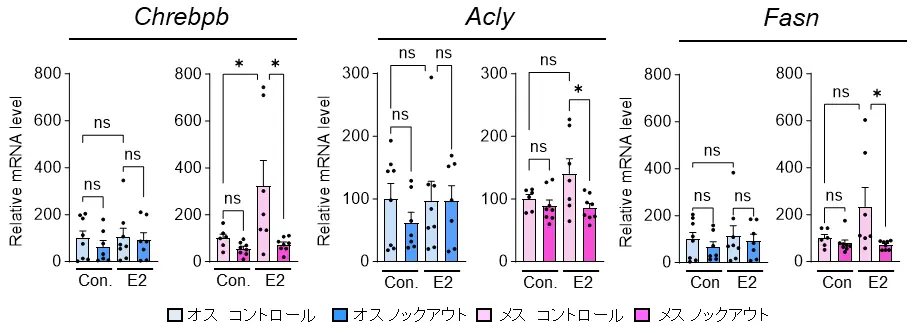
以上の結果から、PGC-1αはエストロゲンと協調して、メスマウスにおいてのみミトコンドリアの構造や機能に重要なリン脂質の合成を制御し、ミトコンドリアの機能を高めることで、BATの熱産生および全身のカロリー消費におけるメスの優位性を形成していることが明らかになりました。
社会的インパクト
肥満やそれに伴う2型糖尿病は、日本のみならず世界中で増加しており、深刻な健康問題であると同時に社会問題も引き起こしています。しかし、その予防や改善は容易ではありません。今回得られた知見を発展させることで、食事療法に加え、カロリー消費を促進する新たな方法や薬剤の開発が進み、肥満およびそれに伴う糖尿病の予防や改善につながることが期待されます。
本研究では、BATのミトコンドリア構造および機能に性差が存在すること、そしてその差異にPGC-1αが重要な役割を果たしていることを明らかにしました。一方で、BAT以外の臓器、たとえば肝臓、脳、骨格筋など、ミトコンドリアを多く含む組織においても、女性のミトコンドリアは男性よりも高いエネルギー産生能力を持つことが報告されています[参考文献3]。
本研究の成果は、BATにとどまらず、こうした他の臓器・組織における機能の性差や、それに関連する疾患における性差のメカニズムの理解にも寄与すると考えられます。ひいては、性別に基づいた個別化医療の発展にも貢献することが期待されます。
今後の展開
本研究で明らかになったPGC-1αを介した性差特異的な分子メカニズムについて、今後はその詳細をさらに解明していく予定です。特に、PGC-1αがどのようにエストロゲンと連携し、ミトコンドリア機能や脂質代謝を制御しているのかを掘り下げることで、エネルギー代謝の性差の理解が一層深まると期待されます。
また、こうした基礎的な知見を応用し、将来的にはカロリー消費を促進する新たな治療法や薬剤の開発につなげることを目指しています。肥満や糖尿病の予防・改善に向けた選択肢を広げる一助となるよう、引き続き研究を進めていきます。
付記
本研究は、日本学術振興会(JSPS)の科学研究費助成事業22H03126、21K16350および科学技術振興機構(JST)のムーンショット型研究開発事業(JPMJPS2023)による支援を受けました。
科学技術振興機構(JST)ムーンショット型研究開発事業
片桐秀樹プロジェクトマネージャーからのコメント
本研究により得られた知見は、個体のエネルギー消費に認められる性差の新たな理解を促すものである。このことは肥満のなりやすさのメカニズムを明らかにするもので、糖尿病未病段階を解明し正常に回復させる手法/薬剤の開発につながることが期待され、本ムーンショット目標2の目的にまさに合致する画期的な成果と考える。
参考文献
- [1]
- Becher, T. et al. Brown adipose tissue is associated with cardiometabolic health. Nat. Med. 27, 58-923 65(2021)
- [2]
- Quevedo, S., Roca, P., Pico, C. & Palou, A. Sex-associated differences in cold-induced UCP1 synthesis in rodent brown adipose tissue. Pflugers Arch. 436, 689-695 (1998).
- [3]
- Ventura-Clapier, R. et al. Mitochondria: a central target for sex differences in pathologies. Clin. Sci. (Lond) 131, 803-822 (2017).
用語説明
- [用語1]
- 褐色脂肪組織(BAT;Brown Adipose Tissue):脱共役タンパク質(UCP-1)を発現するミトコンドリアを含み、熱産生およびカロリー消費を担う脂肪組織。
- [用語2]
- ミトコンドリア:細胞内に存在する小器官であり、電子伝達系によりミトコンドリア内膜を挟んで形成される電位勾配を利用して、ATP合成酵素によってATPを産生する。
- [用語3]
- UCP-1(uncoupling protein-1):ミトコンドリア内膜に存在するH+(プロトン)輸送体として機能するタンパク質。ミトコンドリアの電子伝達系によって形成された電位勾配を消失させることで、電子伝達系とATP合成を切り離し(脱共役)、その過程でエネルギーを熱として放散する役割を担う。
- [用語4]
- クリステ:ミトコンドリア内膜に存在する管状に折りたたまれた構造で、電子顕微鏡では櫛(くし)状の形態として観察される。電子伝達系やUCP-1は、内膜の中でもこのクリステ上に多く存在する。
- [用語5]
- Chrebpβ:脂肪合成に関連する複数の遺伝子の発現を制御するマスター転写因子。
- [用語6]
- クロマチンアクセシビリティ:クロマチン構造の局所的な「ゆるみ」によって生じるアクセスのしやすさのこと。アクセシビリティが高まることで転写複合体がDNAに結合しやすくなり、標的遺伝子の発現が促進される。
論文情報
- 掲載誌:
- Nature Communications
- タイトル:
- Sex difference in BAT thermogenesis depends on PGC-1α–mediated phospholipid synthesis in mice
- 著者:
- Akira Takeuchi1*, Kazutaka Tsujimoto1*†, Jun Aoki1*, Kenji Ikeda1, Nozomu Kono2, Kuniyuki Kano2, Yoshihiro Niitsu1, Masato Horino1, Kazunari Hara1, Rei Okazaki1, Ryo Kaneda1, Masanori Murakami1, Kumiko Shiba1,3, Chikara Komiya1, Junken Aoki2, Tetsuya Yamada1†
- 所属:
- 1Department of Molecular Endocrinology and Metabolism, Graduate School of Medical and Dental Sciences, Institute of Science Tokyo, Tokyo 113-8510, Japan.
2Laboratory of Health Chemistry, Graduate School of Pharmaceutical Sciences, University of Tokyo, Tokyo, Japan.
3The Center for Personalized Medicine for Healthy Aging, Institute of Science Tokyo, Tokyo, Japan.
(*Contributed equally to this work as the first author, and †corresponding author)
研究者プロフィール
辻本 和峰 Kazutaka TSUJIMOTO
東京科学大学 大学院医歯学総合研究科 分子内分泌代謝学分野 助教
研究分野:糖・エネルギー代謝調節メカニズム、肥満、糖尿病などの病態解明や治療法開発
竹内 彬 Akira TAKEUCHI
東京科学大学 大学院医歯学総合研究科 分子内分泌代謝学分野 大学院生
研究分野:糖・エネルギー代謝調節メカニズム、肥満、糖尿病などの病態解明や治療法開発
青木 惇 Jun AOKI
東京科学大学 大学院医歯学総合研究科 分子内分泌代謝学分野 大学院生
研究分野:糖・エネルギー代謝調節メカニズム、肥満、糖尿病などの病態解明や治療法開発
山田 哲也 Tetsuya YAMADA
東京科学大学 大学院医歯学総合研究科 分子内分泌代謝学分野 教授
研究分野:糖・エネルギー代謝調節メカニズム、肥満、糖尿病などの病態解明や治療法開発
関連リンク
お問い合わせ
研究に関すること
東京科学大学 大学院医歯学総合研究科 分子内分泌代謝学分野
教授 山田 哲也
- Tel
- 03-5803-5966
- Fax
- 03-5803-0261
- tyamada.mem@tmd.ac.jp
東京科学大学 大学院医歯学総合研究科 分子内分泌代謝学分野
助教 辻本 和峰
- Tel
- 03-5803-5216
- Fax
- 03-5803-0172
- ktsujimoto.mem@tmd.ac.jp
JST事業に関すること
科学技術振興機構 ムーンショット型研究開発事業部
松尾 浩司
- Tel
- 03-5214-8419
- Fax
- 03-5214-8427
- moonshot-info@jst.go.jp