ポイント
- 統合失調症の高リスク遺伝子XPO7の機能低下による脳病態を解明
- XPO7は統合失調症に関連するシナプス分子AMPA受容体サブユニットGRIA3の挙動を制御
- XPO7の遺伝子変異が複数の統合失調症高リスク遺伝子の発現にも影響を与え、高リスク遺伝子同士の相互作用があることを確認
概要
東京科学大学(Science Tokyo)※ 医歯学総合研究科 精神行動医科学分野の塩飽裕紀テニュアトラック准教授、豊田早織博士課程大学院生、高橋英彦教授らの研究チームは、新潟大学 脳研究所の菊地正隆准教授および慶應義塾大学 医学部の田中謙二教授との共同研究において、統合失調症高リスク遺伝子であるXPO7の遺伝子変異が引き起こす脳病態を明らかにしました。
XPO7の遺伝子機能が半減する遺伝子変異が統合失調症の発症率を28.1倍に増加させることが、2022年に「Nature」誌で報告されました。しかし、この遺伝子変異が具体的にどのような病態を引き起こすのかについては、これまで報告されていませんでした。
本研究では、XPO7の遺伝子機能が半減したXPO7ヘテロノックアウトマウス[用語1]を作成し、それらが行動病態を示すことを確認しました。また、その背景として、特に45の脳分子の細胞内局在が影響を受けることを示しました。この中には、XPO7と同様に高リスク遺伝子であるAMPA受容体[用語2]サブユニットのGRIA3(統合失調症オッズ比20.1)が含まれることを発見しました。さらに、発症期と慢性期に分けて詳細に遺伝子発現を解析した結果、XPO7遺伝子変異において統合失調症高リスク遺伝子同士が相互作用しながら病態を形成することが示されました。
今回の研究成果は、これらの遺伝子変異が存在しない統合失調症にも共通した病態がある可能性を探る意義を示しています。
本成果は、2025年1月7日付(ロンドン現地時間)の「EMBO reports」誌に掲載されました。
- 2024年10月1日に東京医科歯科大学と東京工業大学が統合し、東京科学大学(Science Tokyo)となりました。
背景
統合失調症は、幻覚や妄想といった陽性症状、うつや感情の平板化といった陰性症状、さらに認知機能の低下を特徴とし、約 100 人に 1 人が発症する比較的頻度の高い精神疾患です。その原因は十分に解明されていませんが、2022年に「Nature」誌において統合失調症の高リスク遺伝子が10個報告されました。この研究(The Schizophrenia Exome Sequencing Meta-Analysis (SCHEMA) consortium:統合失調症エクソームシーケンスメタ解析コンソーシアムによる研究)を基に、今後の統合失調症研究の重要性が指摘されています。
その10個の遺伝子の一つであるExportin 7(XPO7)は、機能が半減する遺伝子変異によって統合失調症の発症率を28.1倍に増加させることが報告されています。XPO7はその名の通り、細胞内分子を核内から核外へ輸送(export)する主な役割を持つと考えられていますが、培養細胞においては、核外から核内への輸送機能を持つことも確認されています。しかし、脳内でXPO7が具体的にどのような分子をターゲットにしているか、また統合失調症を高リスク遺伝子であるXPO7が機能半減した際にどのような病態を引き起こすについては、これまで報告がありませんでした。
さらに研究チームは、統合失調症において未治療期間の長期化や治療中断の繰り返しが治療抵抗性を生じさせる点に着目し、XPO7の機能不全のように長期間にわたり多様な分子の局在に影響を与える分子が原因となる場合、進行性の病態が形成されやすいのではないかとの仮説を立てました。この仮説に基づき、研究を進めました。
研究成果
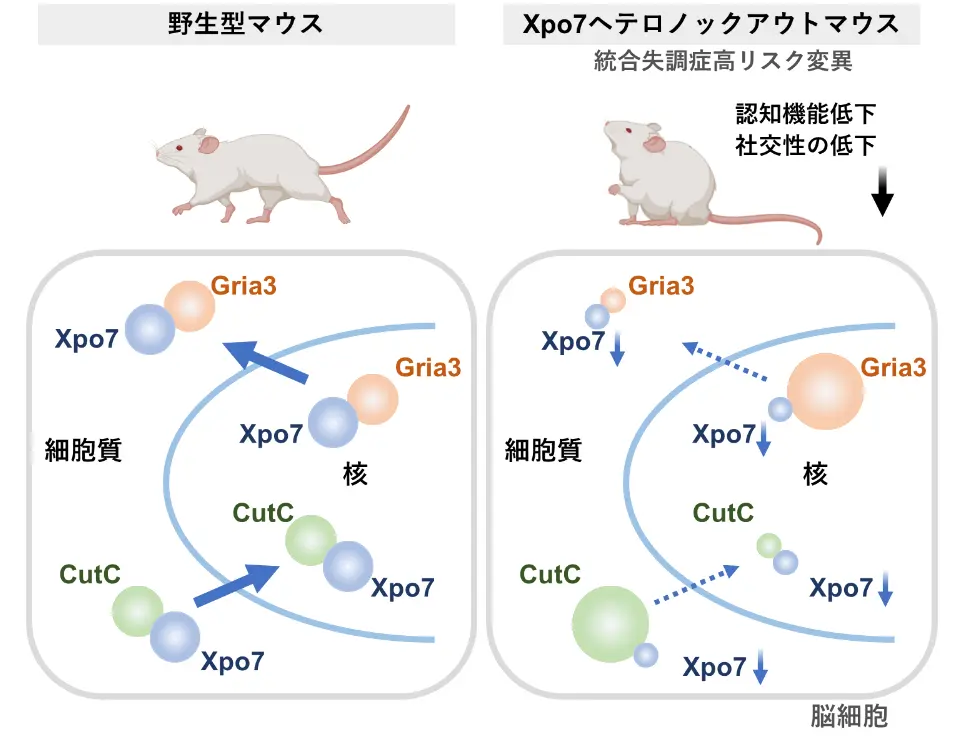
研究チームは、XPO7ノックアウトマウスを作成し、統合失調症の高リスク状態を再現したヘテロノックアウトマウスを用いて研究を行いました。このヘテロノックアウトマウスは、青年期にあた3ヵ月齢で認知機能の低下やプレパルス抑制(PPI)の異常を示し、慢性期に相当する6ヵ月齢では社交性の低下が顕著に観察されました(図1)。
分子病態の解析では、XPO7がヘテロノックアウトで量が半減した際に影響を受ける神経系の分子に対してプロテオーム解析を実施し、影響を受ける45個の分子を同定しました。その中には多くのシナプス分子が含まれており、特にシナプス受容体の一つであるGRIA3(AMPA受容体サブユニットの一つ)が含まれていました。GRIA3は、2022年に報告された統合失調症の高リスク遺伝子10個のうちの一つでもあります。GRIA3は通常、シナプスで機能するために核外に輸送される必要がありますが、XPO7がヘテロノックアウトになると核内にトラップされ、機能不全を引き起こすことが確認されました。
さらに、CutC(体内微量元素である銅からの細胞ダメージを防ぐ分子)や神経細胞特異的スプライシング調節因子であるRbfox3もXPO7のターゲットであることが明らかになりました(図1)。
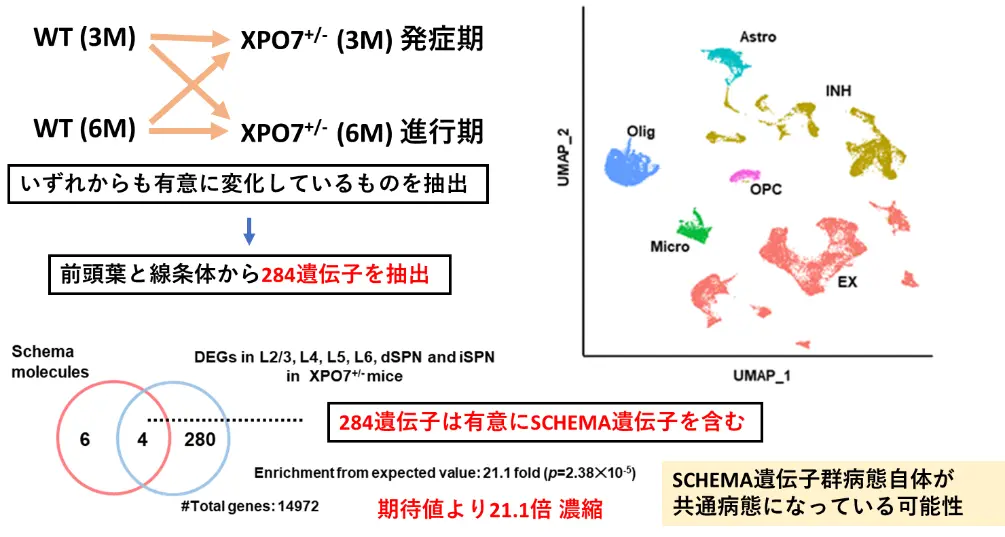
加えて、研究チームは発症期(3ヵ月齢)と慢性期(6ヵ月齢)に分け、前頭葉および線条体におけるシングル核RNA解析を実施しました。その結果、特に病態に関連性が高いと考えられる284個の遺伝子発現変化を特定しました。この中には、2022年に報告された10個の高リスク遺伝子のうち4つが含まれていました。また、XPO7の遺伝子変異の下流で、これらの高リスク遺伝子がSCHEMA研究で報告された遺伝子発現変化に有意な影響を及ぼしていることが示されました(図2)。
社会的インパクト
統合失調症は、治療が困難な症状を伴うことが多く、新しい治療法の開発に向けてさらなる研究が求められています。本研究では、統合失調症の発症リスクを28.1倍に増加させるXPO7遺伝子変異が引き起こす脳病態を初めて明らかにしました。この成果は、XPO7遺伝子変異を持つマウスが、今後の統合失調症の分子病態研究における重要な基盤(モデル)の一つとなる可能性を示しています。
さらに、この研究により統合失調症の脳分子病態のさらなる解明が期待され、新たな治療戦略の開発に貢献する道を開くと考えられます。
今後の展開
XPO7遺伝子の変異は統合失調症の発症リスクを大幅に高める一方で、この遺伝子変異を持つ患者は極めて少ないことが報告されています。SCHEMA研究で指摘された10個の高リスク遺伝子変異は、いずれも、発生頻度の低い遺伝子変異が引き起こす「レアバリアント病態[用語3]」に該当します。しかし、これらのレアバリアントの解析から、より多くの患者に共通する病態を発見し、還元することが今後の重要な課題です。
本研究では、複数の高リスク遺伝子が病態形成において相互に関連し合っていることを示しました。このことから、これらの遺伝子変異を持たない患者であっても、これらの高リスク遺伝子に関連する病態が存在する可能性が示唆されます。この発見は、より広範な患者層に対して、適用可能な病態モデルや治療法の開発に向けた道を開くものと期待されます。
付記
本研究は、国立研究開発法人日本医療研究開発機構(AMED)「Brain/MINDS 2.0 脳神経科学統合プログラム」、「脳とこころの研究推進プログラム(領域横断的かつ萌芽的脳研究プロジェクト)」、科学技術振興機構(JST)創発的研究支援事業、文部科学省科学研究費補助金などの支援を受けて行われました。
用語説明
- [用語1]
- ヘテロノックアウトマウス:遺伝子は父親からと母親からそれぞれ引き継がれるが、その片方の遺伝子の発現がなくなる遺伝子改変を行ったマウス。
- [用語2]
- AMPA受容体:シナプス伝達物質であるグルタミン酸の受容体の一種。
- [用語3]
- レアバリアント病態:1万人に1~10人程度の遺伝子変異による病態。
論文情報
- 掲載誌:
- EMBO reports
- タイトル:
- Schizophrenia-related Xpo7 haploinsufficiency leads to behavioral and nuclear transport pathologies
- 著者:
- Saori Toyoda, Masataka Kikuchi, Yoshifumi Abe, Kyosei Tashiro, Takehisa Handa, Shingo Katayama, Yukiko Motokawa, Kenji F Tanaka, Hidehiko Takahashi, and Hiroki Shiwaku
研究者プロフィール
塩飽裕紀 Hiroki Shiwaku
東京科学大学 精神行動医科学分野 テニュアトラック准教授
研究分野:精神医学、神経科学、分子細胞生物学

豊田早織 Saori Toyoda
東京科学大学 精神行動医科学分野 博士課程大学院生
研究分野:精神医学、神経科学、分子細胞生物学

髙橋英彦 Hidehiko Takahashi
東京科学大学 精神行動医科学分野 教授
研究分野:精神医学、神経科学、行動科学
