概要
東京科学大学(Science Tokyo)物質理工学院 応用化学系の田中浩士特任教授(兼 順天堂大学 薬学部 教授)、千葉大学大学院 薬学研究院の鈴木博元助教、上原知也教授、量子科学技術研究開発機構の石岡典子上席研究員、大阪大学大学院 医学系研究科の渡部直史講師を中心とする共同研究グループは、皮膚がんの中で最も悪性度が高く、放射線治療にも抵抗性を示す悪性黒色腫を標的とした、新たなアスタチン-211(211At)[用語1]標識ペプチド薬剤の開発に初めて成功しました(図1)。211Atはアルファ線[用語2]という放射線を放出する原子であり、がん組織へ211Atを送達することで標的アルファ線治療[用語3]が可能となります。アルファ線は非常に高エネルギーであるため、悪性黒色腫に対しても高い治療効果が期待できる一方、副作用が少なく、遠隔転移が生じた場合でも適応可能です。そのため、本研究成果は悪性黒色腫の新たな治療法として今後の応用が期待されます。
本研究成果は、2025年1月20日(月)(日本時間)にEuropean Journal of Nuclear Medicine and Molecular Imaging誌に掲載されました。
背景
核医学治療では、放射性核種を結合した放射性薬剤を生体に投与し、標的部位に集積後放出される放射線によって治療を行います。従来はベータ線[用語4]が使用されてきましたが、近年、より効果的で副作用の少ない治療として、アルファ線を使用する治療法「標的アルファ線治療」が注目されています。しかし、アルファ線を放出する放射性核種の中で臨床応用可能なものは限られており、いずれも供給面に課題があります。アスタチン-211(211At)は臨床応用が期待されているアルファ線を放出する核種の一つで、現在国内では精力的に211At標識薬剤の開発研究が行われています。
皮膚がんの一種である悪性黒色腫は悪性度の高いがんで、遠隔転移が生じた場合の5年生存率は20%以下と報告されています。免疫チェックポイント阻害剤[用語5]の登場により悪性黒色腫の治療成功率は向上していますが、効果が得られる患者は限られることから、新たな治療法の開発が望まれています。悪性黒色腫は放射線治療の効果が出にくいがんですが、重粒子線治療[用語6]のようにがん細胞へのエネルギー供給が大きければ良好な効果が得られています。しかし、重粒子線治療は局所に対して行う治療であり、転移が見られるがんは原則適応外となります。一方で標的アルファ線治療であれば、遠隔転移が生じた症例にも適応可能であり、効果も十分期待できます。
これまで211At標識薬剤の開発では、生体内安定性が高い薬剤を開発することが困難でした。安定性の低い多くの薬剤は、がんへ送達される211Atが減少し、治療効果を最大限発揮できなくなります。また、胃や脾臓、肺、甲状腺などの正常組織に集積することによる副作用が懸念されていました。
研究グループは以前の研究にて安定した211At結合分子を構築するための標識法を開発しており[参考文献1]、本研究では、その標識法を利用して悪性黒色腫標的211At標識ペプチド薬剤の開発を行いました。211Atは半減期が7.2時間と比較的短く、効果的な治療のためには211Atを速やかにがん部位へ送達する必要があります。このため、がんへの集積に数日を要する抗体などの高分子薬剤よりも集積の速いペプチドなどを母体とする薬剤が適しています。一方で、高分子薬剤の開発では、211At標識部位を導入しても薬剤の標的親和性や生体内挙動には影響が出にくいのですが、ペプチド薬剤の場合は大きく影響されます。そこで、4種の異なるリンカー構造を導入した候補薬剤を作製し、腫瘍親和性や体内挙動について検討しました。
研究成果
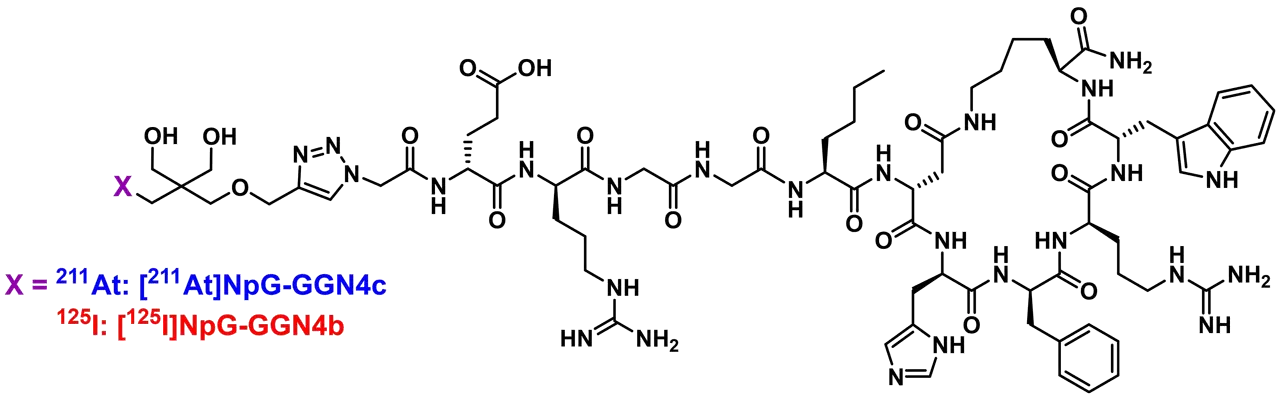
211Atは入手機会が限られるため、アスタチンと同族元素である放射性ヨウ素を用いて4種のペプチド薬剤を作製しました。その結果、[125I]NpG-GGN4b(図1)がマウス悪性黒色腫細胞株であるB16F10細胞に最も高い親和性を示し、B16F10移植マウスへ投与した場合にも最も高い腫瘍集積を示しました。一般に水溶性の高い放射性ペプチド薬剤は排泄経路である腎臓に集積しますが、それ以外の正常組織には集積しません。[125I]NpG-GGN4bも投与早期に腎臓に高い集積を示しましたが、その後速やかに排泄され、その他の正常組織には集積しませんでした。
このように良好な腫瘍親和性や体内挙動が確認できたことから、[125I]NpG-GGN4bの構造を基に、放射性ヨウ素標識と同様の手法を用いて211At標識ペプチド薬剤[211At]NpG-GGN4c(図1)を作製しました。
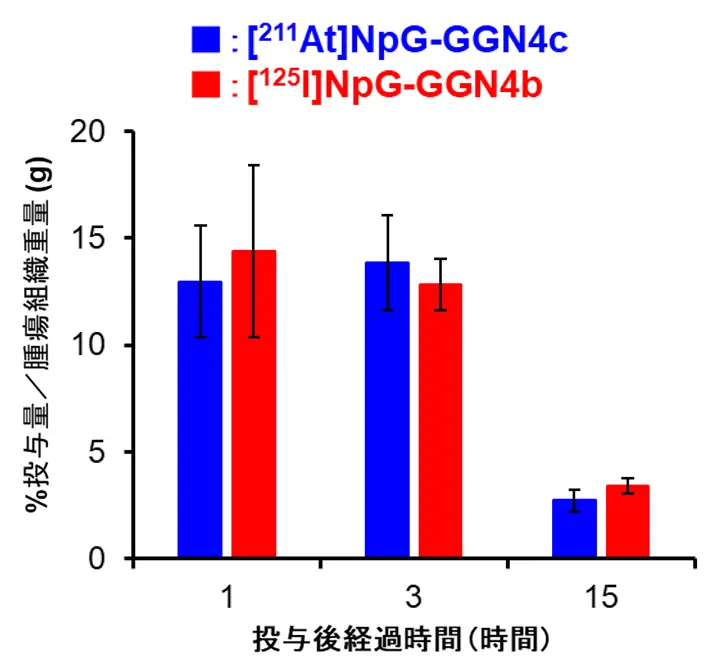
[211At]NpG-GGN4cも[125I]NpG-GGN4bと同様、B16F10移植マウス投与後に高い腫瘍集積を示しました(図2)。また、[211At]NpG-GGN4cは腎臓以外の正常組織への集積を示さず、血漿中安定性試験や尿分析の結果からも、生体内でも良好な安定性を示すことが分かりました。
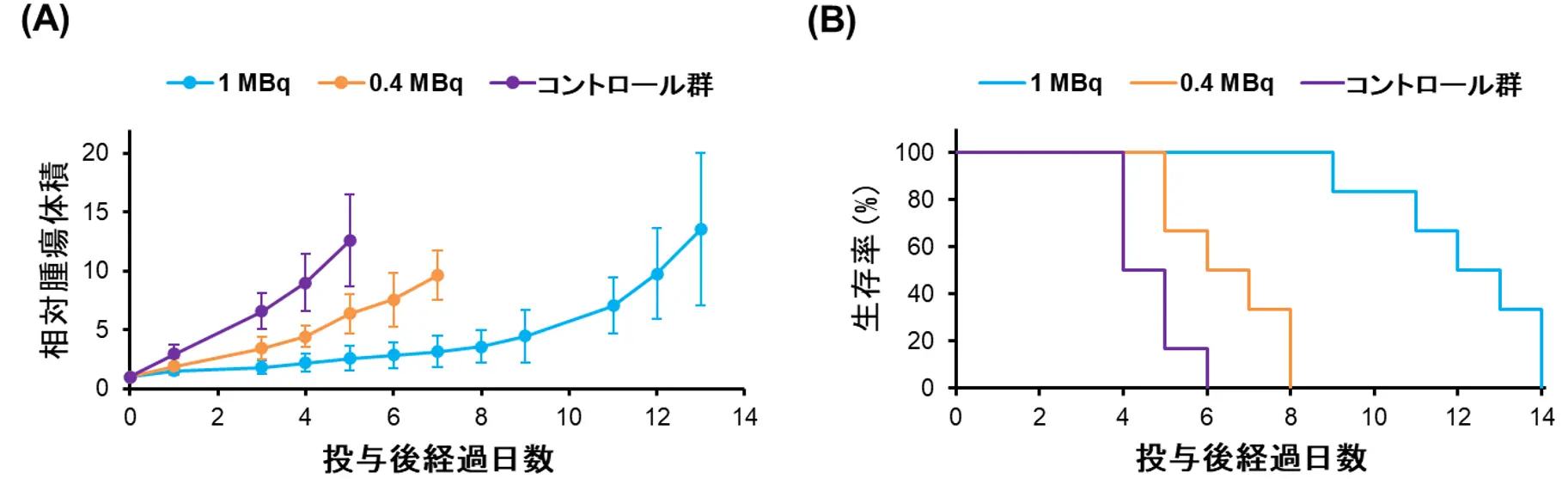
1MBq[用語7](水色)または0.4 MBq(オレンジ)の[211At]NpG-GGN4cをB16F10移植マウスに投与し、治療効果を検証したところ、いずれの投与量においてもコントロール群(紫)と比較して有意な腫瘍増殖抑制効果を示し、生存期間を延長しました(図3)。以上より、[211At]NpG-GGN4cの投与により悪性黒色腫に対しても良好な治療効果が得られることが示されました。
今後の展望
本研究では、[211At]NpG-GGN4cによる悪性黒色腫の標的アルファ線治療の有効性を実証するとともに、研究グループが以前に開発した211At標識法を用いた、ペプチド薬剤の開発に成功しました。本研究成果は、悪性黒色腫の新たな治療法や、種々のがんを標的としたペプチド薬剤開発への応用につながることが期待されます。
研究プロジェクトについて
本研究は、科学研究費助成事業(22K07686、23KK0291)の支援により遂行されました。また本研究で使用した211Atは、科学研究費助成事業(22H04924)の助成を受けた短寿命RI供給プラットフォームによって供給されました。
参考文献
用語説明
- [用語1]
- アスタチン-211(211At):原子番号85のハロゲン元素であるアスタチンの放射性同位体の一つ。半減期が7.2時間と臨床応用に適しており、安定同位体の鉛-207に壊変するまでにアルファ線を1回放出する。国内において複数の研究機関で製造実績がある。本研究では、高崎量子技術基盤研究所にて製造された211Atが用いられた。
- [用語2]
- アルファ線:到達範囲が細胞数個分(0.1 mm未満)と非常に短く、ベータ線よりも選択的にがん細胞などの標的細胞を破壊する。アルファ線が単位長さ当たりに与えるエネルギー量は、ベータ線の400倍とも言われ、ベータ線よりも高い治療効果が期待されている。
- [用語3]
- 標的アルファ線治療:体内にアルファ線を放出する放射性核種を投与し、がんなどの標的部位に集積した後に放出されるアルファ線によって治療を行う治療法。標的部位に選択的に集積する性質を有する分子に放射性核種を結合(標識)した放射性薬剤、または放射性核種自体が標的に集積する性質を有する場合は、それ自体を放射性薬剤として使用する。
- [用語4]
- ベータ線:エネルギーが高く、細胞を殺傷可能であることから、従来核医学治療に用いられてきた放射線。その到達範囲は数mm程度であり、正常組織への影響は比較的少ないとされている。
- [用語5]
- 免疫チェックポイント阻害剤:がん細胞は免疫反応を抑制して正常な細胞を守る「免疫チェックポイント」という仕組みを利用して免疫系から逃れようとすることがある。このチェックポイントをブロックして、免疫細胞ががん細胞を攻撃できるようにする薬のこと。
- [用語6]
- 重粒子線治療:加速した炭素イオンを照射する放射線治療。放射線治療では、一般的に光子線であるX線などが使われるが、重粒子線の場合、より大きなエネルギーを標的細胞に供給できるため、効果の高い治療が可能となる。
- [用語7]
- MBq:放射能の単位である メガベクレル(Megabecquerel)のこと。核医学では、投与される核医学治療での薬剤量がMBq単位で表される。
論文情報
- 掲載誌:
- European Journal of Nuclear Medicine and Molecular Imaging
- タイトル:
- An 211At-labeled alpha-melanocyte stimulating hormone peptide analog for targeted alpha therapy of metastatic melanoma
- 著者:
- Hiroyuki Suzuki, Saki Yamashita, Shoko Tanaka, Kento Kannaka, Ichiro Sasaki, Yasuhiro Ohshima, Shigeki Watanabe, Kazuhiro Ooe, Tadashi Watabe, Noriko S. Ishioka, Hiroshi Tanaka, Tomoya Uehara
関連リンク
お問い合わせ
取材申込み
東京科学大学 総務企画部 広報課
- media@adm.isct.ac.jp
- Tel
- 03-5734-2975
- FAX
- 03-5734-3661