ポイント
- 豊富で安価な鉄を用い、これまで制御が極めて困難だった脂肪族グリニャール反応剤による不斉1,6-付加を世界で初めて実現。
- 四環性キラルNHC配位子を導入することで、高い不斉収率を達成し、cis-選択的な立体制御にも成功。
- レアメタルに依存しない次世代のサステイナブル不斉合成法として、創薬化学・機能性材料分野への応用を期待。
概要
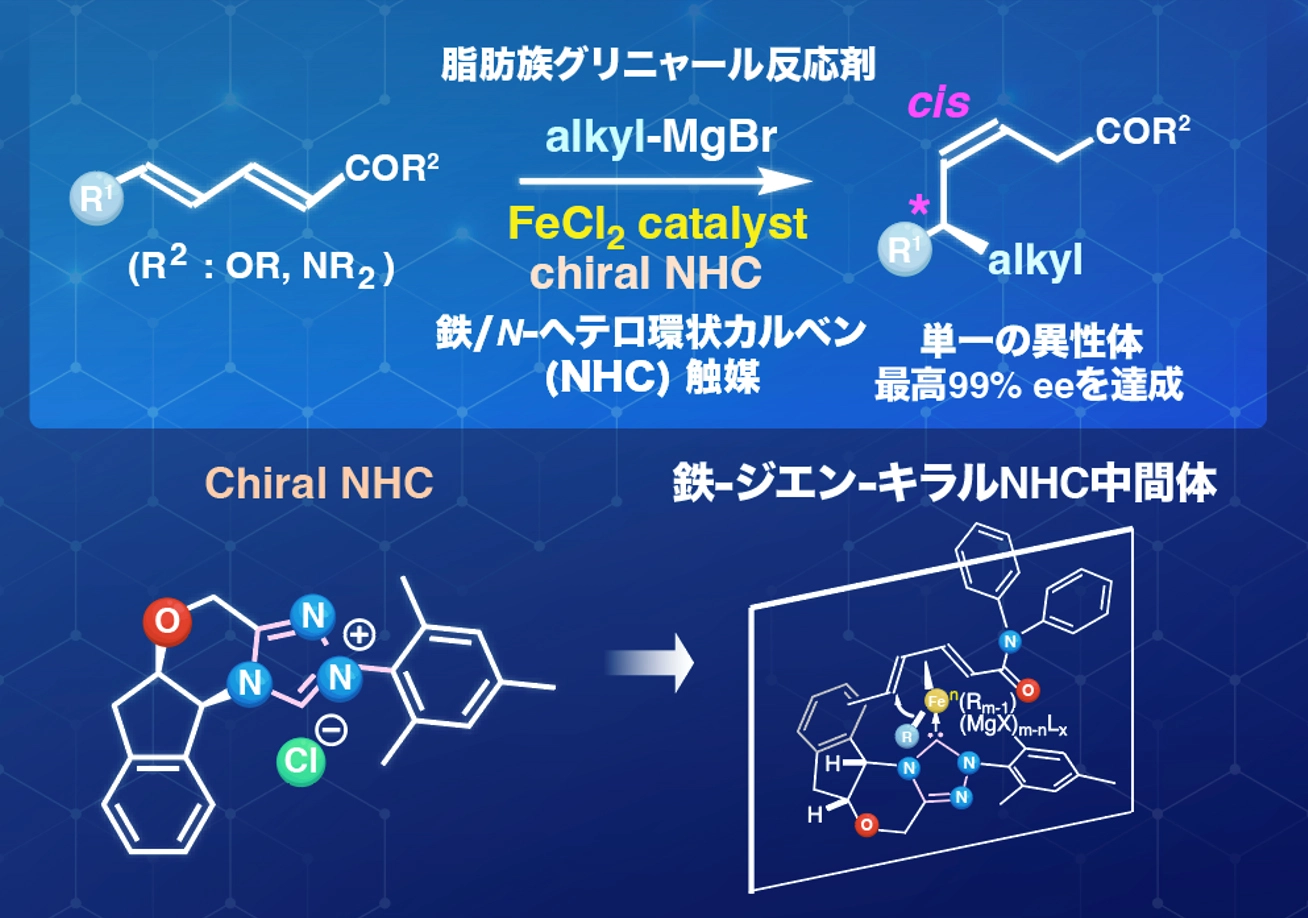
東京科学大学(ScienceTokyo) 生命理工学院 生命理工学系の秦猛志 准教授らの研究グループは、鉄とキラルNHC[用語1]配位子を組み合わせることで、α,β,γ,δ-不飽和カルボニル化合物に対する脂肪族グリニャール反応剤[用語2]の高選択性での不斉1,6-付加反応を世界で初めて実現しました。
従来の1,6-付加反応[用語3]は、反応点が金属中心から遠いことからβ/δ位での競合反応が起きやすく、β-水素脱離[用語4]などの副反応が阻害要因となるため、脂肪族求核剤ではほぼ不可能とされてきました。
今回の研究では、脂肪族グリニャール反応剤を用いた1.6-付加反応に、反応場の三次元構造を高度に規定する四環性キラルNHC配位子[用語5]を導入することで、鉄中心の周囲に剛直な非対称空間(キラルポケット)を形成し、アルキル基が選択的に移動する反応経路の構築に成功しました。その結果、生成物は、二重結合の立体配置が完全にcis [用語6]に制御され、さらに最大99% ee [用語7]という極めて高い光学純度を示しました。この反応は幅広い脂肪族グリニャール反応剤や共役カルボニル化合物に適用可能です。さらに、重水素(D)標識実験により、マグネシウムエノラート中間体の生成を確認しました。これにより、本反応が鉄–NHC–アルキル複合体→s-cis誘導体形成→アルキル移動→マグネシウムエノラート→プロトン化という一連の触媒サイクルを経ることを解明しました。
今回の研究成果は、パラジウムやロジウム等のレアメタルを全く必要としない、グリーンで高難度な不斉炭素–炭素結合形成を初めて実現した例として、有機合成化学に新しい道を開くものです。今後は、創薬・材料化学・ファインケミカル工業に新しい基盤技術をもたらすと期待されます。
本成果は、11月6日付の「Angewandte Chemie International Edition」誌に掲載されました。なお、本論文はVIP(Very Important Paper)に選出されました。
背景
炭素–炭素結合形成反応は、有機合成化学や創薬化学の根幹を支える基本反応です。その1つである、共役系の遠隔位置に選択的に結合を形成する1,6-付加反応は、電子伝達の距離が長く、配座変換を伴うなど反応経路が複雑化するため、位置選択性と立体選択性の両方の制御が極めて難しいとされてきました。さらに、一般的なアルキル型グリニャール反応剤では、β-水素脱離により金属–アルキル種が分解しやすく、副反応が主反応に優先して進行することから、実用的な1,6-付加はほとんど達成されていませんでした。さらに、高い立体選択性を要する不斉1,6-付加反応となると、これまではロジウムやイリジウムなどのレアメタル触媒系に限られており、資源偏在性や環境負荷の観点から持続可能性の課題が残っていました。
研究成果
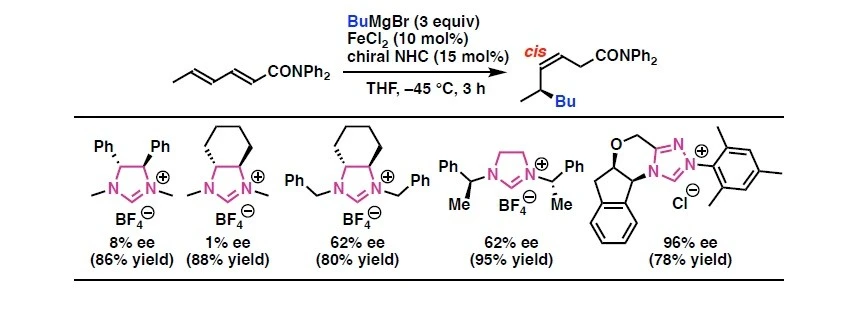
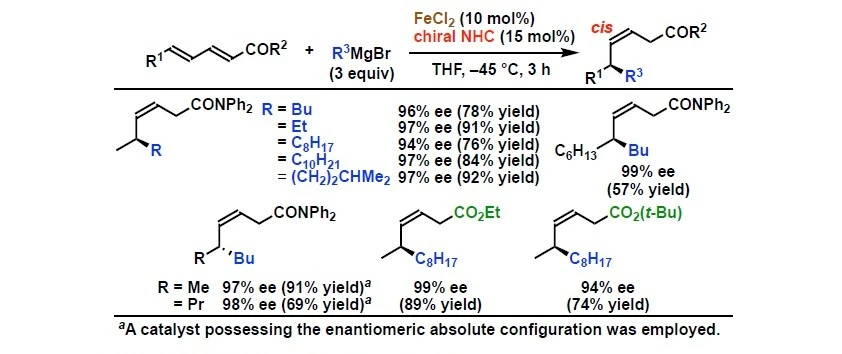
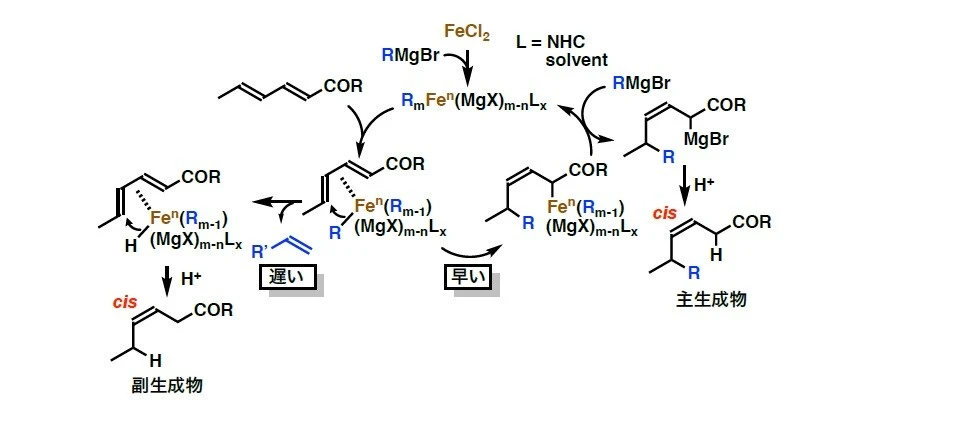
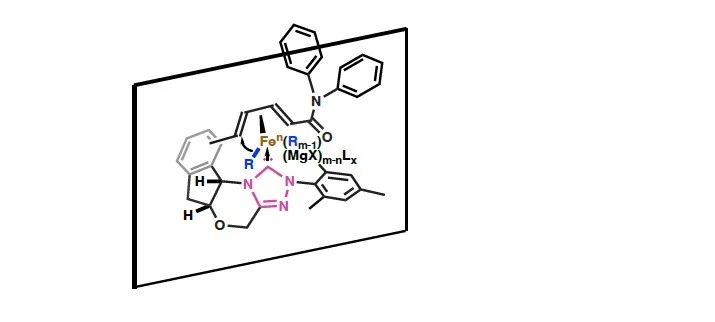
研究チームは、これまでの研究で鉄触媒反応の開発を積極的に行っており、さまざまな新規有機合成反応を見出しています[参考文献1-2]。今回の研究では、触媒量の塩化鉄存在下で、α,β,γ,δ-不飽和カルボニル化合物に対して脂肪族グリニャール反応剤を作用させる際に、さまざまなキラルNHCをスクリーニングしました。その結果、四環性キラルNHC配位子を用いることで、高い選択性でのアルキル基の不斉1,6-付加反応を、世界で初めて実現しました(図1)。この触媒系は、強いσ供与性と剛直な立体骨格により、鉄–アルキル種の分解要因であるβ-水素脱離を抑制しながら、電子不足共役ジエンへの配位とs-cis誘導を制御します。これにより、δ位への立体選択的アルキル移動を可能にし、cis-選択的生成物を最大99% eeという高い不斉収率で得ることに成功しました。この反応には、幅広い脂肪族グリニャール反応剤が適用可能で、直鎖・分岐・官能基含有基質に対しても良好な反応性を示します(図2)。重水素標識実験を行ったところ、マグネシウムエノラート中間体の生成が確認され、予測されるFe/NHC触媒サイクルが実際に働いていることを強く支持する結果となりました(図3)。
さらに今回の研究では、四環性キラル配位子を用いることで、鉄中心の周囲に剛直な非対称空間(キラルポケット)が形成され、アルキル基が選択的に移動する反応経路の構築にも成功しました(図4)。
社会的インパクト
今回の成果は、レアメタルを必要としない持続可能な不斉炭素–炭素結合形成法として、創薬化学や材料科学への大きな応用が期待されます。今回確立した、レアメタル不要の不斉合成技術は、製薬・農薬・機能材料合成の分野で用いられる大規模プロセスにおいて、環境・コスト面での大きなメリットをもたらすと期待されます。さらに今回の成果を基にして、医薬品原薬の前駆体、光学材料などで利用可能な、新規キラルビルディングブロックの供給プラットフォームを実現できます。今回の研究成果は、鉄資源の高価値化を通して、現在重点的な取り組みが行われているグリーンケミストリー・元素戦略の推進に寄与するものです。さらにC–H活性化、骨格編集、遠隔立体制御への応用展開も見込まれており、鉄触媒化学の概念をさらに拡張すると期待されます。
今後の展開
今回の研究では、従来はレアメタルでしか実現できなかった精密不斉反応を、鉄という身近な金属で達成しました。今後は、より複雑な分子変換や医薬品合成への応用を通じて、持続可能な有機合成化学の確立を目指します。
付記
本研究は以下の支援を受けて実施されました。
日本学術振興会 科学研究費助成事業(JP23K04733、JP20K05507、JP17K05855、JP 26410112、JP23750102)、倉田記念日立科学技術財団、住友電工グループ社会貢献助成、東京化成工業研究助成、DLabチャレンジ研究助成(東京科学大学)、およびJST-PRESTO(分子技術、JPMJPR14KC)、JST-CREST(海洋カーボン、JPMJCR23J2)。
参考文献
- [参考文献1]
- T. Hata, K. Nishi, D Goto, Y. Tatsumi, M. Shigeta, and H. Urabe, “Iron-Catalyzed Reductive Coupling of Nitro Compounds with Grignard and Organozinc Reagents for Synthesis of Functionalized Secondary Amines”, Adv. Synth. Catal. 2025, 367, e202401034. DOI: 10.1002/adsc.202401034
- [参考文献2]
- S. Kobayashi, K. Abe, and T. Hata, “Iron-N,N,N’,N’-Tetramethylethylene-diamine-Catalyzed Selective Substitution of Diene and Triene Monoepoxides with Aliphatic Grignard Reagents”, Adv. Synth. Catal. 2024, 366, 5183-5189. DOI: 10.1002/adsc.202400832
用語説明
- [用語1]
- NHC:隣接する2つの窒素原子に挟まれた環状カルベン種。窒素原子上にかさ高い置換基を導入することで、立体配座が固定され安定化し、有機金属錯体の配位子として広く使われている。
- [用語2]
- グリニャール反応剤:マグネシウム金属をハロゲン化アルキル/アルケニル/アリールと反応させて得られる高い反応性を持つハロゲン化有機マグネシウム。
- [用語3]
- 1,6-付加反応:共役した炭素鎖の中で、通常の1,4-付加よりもさらに離れたδ位(6番目の炭素)に求核剤が付加する反応。遠隔位置での結合制御が必要なため、位置選択性と立体選択性の両立が難しい高度な反応形式。
- [用語4]
- β-水素脱離:有機金属化合物などで見られる反応で、金属に結合したアルキル基の「β位(ベータ位)」の水素原子が脱離して、アルケンと金属ヒドリドが生成する。
- [用語5]
- 四環性キラルNHC配位子:Bode教授らによって開発されたキラルなcis-1,2-アミノインダノールを主骨格とした四環性のNHC配位子。
- [用語6]
- cis:同種の原子や原子団が、二重結合を挟んで同じ側に配置されているもの。
- [用語7]
- ee:鏡像体過剰率(enantiomeric excess)のことで、光学活性を持つ化合物の光学純度を示す指標。
論文情報
- 掲載誌:
- Angewandte Chemie International Edition
- タイトル:
- Iron/NHC-Catalyzed Regio- and Stereoselective 1,6-Additions of Aliphatic Grignard Reagents to α,β,γ,δ-Unsaturated Carbonyl Compounds: Asymmetric Variants with Chiral NHCs
- 著者:
- Kazuma Abe, Koki Nishi, Hirokazu Ito, Shoma Kobayashi, Shumpei Saito, Takeshi Hata*
*Corresponding author
研究者プロフィール
秦 猛志 Takeshi Hata
東京科学大学 生命理工学院 准教授
研究分野:有機合成化学、有機金属化学
