ポイント
- 市販のマレイミド誘導体を用いて、ペプチドやタンパク質のN末端アミノ酸に多様な機能性分子を結合させる新しい化学修飾法を開発した。
- タンパク質と市販の試薬をpH 6の水溶液中で混合するだけで、蛍光分子や医薬品分子を結合した新たな機能性タンパク質やペプチドを作製できる、非常に簡便な方法である。
- 開発した手法を用いて、N末端で架橋されたタンパク質複合体や、抗体–薬物複合体(ADC)の作製に成功し、その応用可能性を実証した。
概要
東京科学大学 理学院 化学系の河野正規教授、和田雄貴助教、慶應義塾大学 薬学部の花屋賢悟講師、田口和明准教授による共同研究グループは、市販のマレイミド誘導体を用いて、タンパク質のN末端に蛍光分子や医薬分子などの機能性人工分子を結合させる、簡便な化学修飾法を開発しました。
タンパク質の化学修飾は、特定のアミノ酸残基に人工分子を結合させることで、タンパク質に新たな機能を付加する技術です。この技術は、タンパク質の機能解明を目的とした生命科学研究だけでなく、創薬など幅広い分野で活用されています。特にマレイミドは、アミノ酸の一種であるシステインと特異的に反応する化合物として知られており、さまざまな機能性分子を結合させた誘導体が市販され、タンパク質の化学修飾において最も広く利用されている試薬の一つです。しかし、マレイミドと反応可能なシステインを持たないタンパク質は多く存在しています。このため、マレイミド誘導体を用いた化学修飾が可能なタンパク質は限られるという課題がありました。
本研究では、タンパク質にマレイミド誘導体とともに2-PCA、銅(II)塩を加えることでN末端アミノ酸[用語1]を化学修飾する新しい新たな手法を開発し、この課題を克服しました。この手法は、特定のアミノ酸残基や配列を必要とせず、幅広いタンパク質に適用可能です。さらに、N末端で架橋したタンパク質–タンパク質複合体や抗体–薬物複合体(ADC:Antibody-Drug Conjugates)[用語2]の作製にも成功し、マレイミド誘導体を用いた化学修飾法の適用範囲を大幅に拡大させました。
この成果は、タンパク質をベースにしたバイオ医薬品[用語3]や生体材料開発の新たな可能性を切り開くものであり、さまざまな科学分野への貢献が期待されます。本研究成果は、2024年11月27日に国際学術誌「Angewandte Chemie International Edition」に掲載されました。
背景
タンパク質の化学修飾は、タンパク質と他の生体高分子や機能性人工分子を架橋することで、天然には存在しない新たな機能を持つタンパク質の創製を可能にする重要な技術です。この技術は、生命科学研究だけでなく、タンパク質を基盤としたバイオ医薬品や、人工臓器やインプラントなど、ヒトへの移植を目的とした生体材料の開発など幅広い分野で応用されています。均一な構造や性質を示す修飾タンパク質を得るためには、特定のアミノ酸残基を選択的に化学修飾する方法が必要です。
マレイミドはアミノ酸の一種であるシステインと特異的に反応することが知られており、さまざまな機能性分子が結合したマレイミド誘導体が市販されています。これらを用いた化学修飾は操作が簡便で、現在では標準的な方法として広く用いられています(図1上)。しかし、多くのタンパク質はマレイミド誘導体との反応に必要なシステイン残基を持たないため、適用可能なタンパク質が限られるという課題がありました。
一方、N末端アミノ酸はすべてのタンパク質に共通して存在しているため、化学修飾の反応部位として非常に有望です。そのため、市販のマレイミド誘導体を用いてN末端アミノ酸を修飾する簡便な代替手法の開発は、マレイミド誘導体の適用範囲を大幅に拡大すると期待されます。

システインがある場合には、マレイミド誘導体はシステインと反応する(上)。システインがない場合には、マレイミド誘導体とともに2-PCA、銅(II)塩を加えるとN末端アミノ酸を化学修飾できる(下)。この反応は銅(II)–エノラート中間体とマレイミド誘導体の1,3-双極子付加環化反応を経由していると考えられる。
研究成果
本研究グループは以前、N末端アミノ酸と2-ピリジンカルボキシアルデヒド(2-PCA)によって生成されるイミンが、銅(II塩と中性水溶液中で安定な金属錯体を形成する特性を利用し、アルドール反応によるN末端アミノ酸の化学修飾法を報告しました[参考文献1]。今回の研究では、この反応過程で生成されると考えられる銅(II)–エノラート中間体が1,3-双極子として機能する点に着目しました(図1下)。
具体的には、さまざまなN末端アミノ酸を有するタンパク質にマレイミド誘導体、2-PCA、銅(II)塩を加え、pH 6の水溶液中で反応させることで、N末端アミノ酸上で1,3-双極子付加環化反応[用語4]が進行し、効率的かつ選択的にN末端を修飾できることを発見しました。この方法は、特定のアミノ酸残基や特殊なアミノ酸配列を必要とせず、広範囲のペプチドやタンパク質の修飾に適用可能な点が特長です。
さらに、アジド基を有する2-PCA(アジド–2-PCA)とマレイミド誘導体でタンパク質を化学修飾し、続いてアジド基を活用する既存の反応を用いて別の機能性分子を導入することで、2種類の機能性人工分子をN末端アミノ酸上に導入したタンパク質を調製することにも成功しました(図2)。
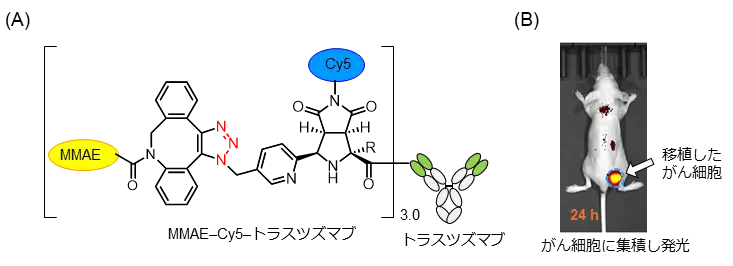
この技術を活用し、N末端で架橋されたタンパク質複合体や、抗体であるトラスツズマブに蛍光分子Cy5と生理活性物質モノメチルアウリスタチンE(MMAE)を搭載した抗体–薬物複合体、MMAE–Cy5–トラスツズマブの調製を実現しました(図3A)。がん細胞を移植したマウスにMMAE–Cy5–トラスツズマブを注射すると、がん細胞に集積して可視化することができました(図3B)。

今後の展開
これまで、さまざまなアミノ酸残基を標的とするタンパク質の化学修飾法が報告されてきましたが、必要な試薬をオンデマンドで合成する必要がある場合が多く、その手間が広範な研究者による応用を妨げていました。一方、本研究では、全て市販されていて容易に入手可能である、銅塩と2-PCAに加え、多様なマレイミド誘導体を活用することで、簡便で再現性の高い修飾法を実現しました。この方法は特別な試薬合成を必要としないため、幅広い科学者が手軽に実施できると期待されます。
本研究で開発した実用的な化学修飾法は、タンパク質の化学修飾を基盤とした基礎研究や応用研究を加速させ、医薬品や生体材料の開発など、多くの分野における技術革新に大きく貢献することが期待されます。
参考文献
- [1]
- Kengo Hanaya et al. Chem. Eur. J. 28, e202201677 (2022).
用語説明
- [用語1]
- N末端アミノ酸:タンパク質やペプチド鎖を構成するアミノ酸鎖の末端で、遊離のアミノ基(ペプチド結合していないアミノ基)のある側にあるアミノ酸残基。遊離のカルボキシ基のある側のアミノ酸残基をC末端アミノ酸と呼ぶ。
- [用語2]
- 抗体–薬物複合体(ADC):抗体に抗がん剤などの薬物を結合させた医薬品。がん細胞と特異的に結合する抗体の性質を利用して、抗がん剤をがん細胞に送達するよう設計されている。
- [用語3]
- バイオ医薬品:生体分子を遺伝子組み換えや細胞培養技術などのバイオテクノロジーを応用して製造された、タンパク質など生体分子からなる医薬品。
- [用語4]
- 1,3-双極子付加環化反応:隣接する三原子の間で4個の電子を共有する化学種である1,3-双極子と不飽和結合を有する分子の間の付加反応で、生成物が環式化合物となる反応。
論文情報
- 掲載誌:
- Angewandte Chemie International Edition
- 論文タイトル:
- One-Step Maleimide-Based Dual Functionalization of Protein N-Termini
- 著者:
- Kengo Hanaya*, Kazuaki Taguchi, Yuki Wada, Masaki Kawano
関連リンク
お問い合わせ
取材申込み
慶應義塾 広報室
- Tel
- 03-5427-1541
- Fax
- 03-5441-7640
- m-pr@adst.keio.ac.jp
東京科学大学 総務企画部 広報課
- Tel
- 03-5734-2975
- Fax
- 03-5734-3661
- media@adm.isct.ac.jp